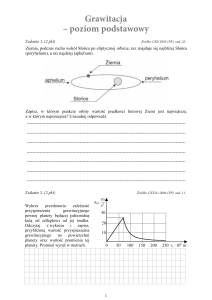
n
za
li
3. Niektóre metody badaĔ wáaĞciwoĞci warstw TiN
3.1. Badanie profilu skáadu chemicznego warstw metodami Spektroskopii Elektronów Auger’a oraz Optycznej Spektroskopii
Emisyjnej Wyáadowania Jarzeniowego.
os
Poáączenie metod pozwalających na analizĊ skáadu chemicznego powierzchni ciaáa staáego z technikami sukcesywnego strawiania (rozpylania)
tej powierzchni umoĪliwia uzyskanie informacji o zmianach skáadu chemicznego warstw poczynając od jej powierzchni, w gáąb, aĪ do podáoĪa. Badania
tego rodzaju nazywamy analizą profilową skáadu chemicznego warstw.
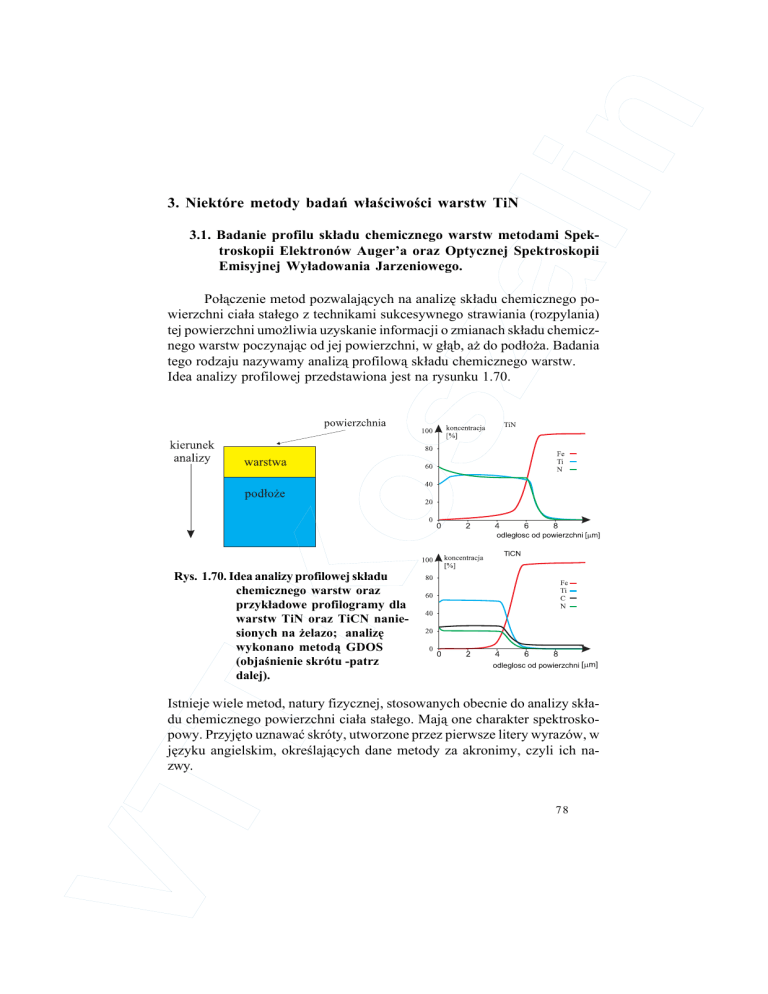
Idea analizy profilowej przedstawiona jest na rysunku 1.70.
TK
odległosc od powierzchni
Rys. 1.70. Idea analizy profilowej skáadu
chemicznego warstw oraz
przykáadowe profilogramy dla
warstw TiN oraz TiCN naniesionych na Īelazo; analizĊ
wykonano metodą GDOS
(objaĞnienie skrótu -patrz
dalej).
odleglosc od powierzchni
VT
Istnieje wiele metod, natury fizycznej, stosowanych obecnie do analizy skáadu chemicznego powierzchni ciaáa staáego. Mają one charakter spektroskopowy. PrzyjĊto uznawaü skróty, utworzone przez pierwsze litery wyrazów, w
jĊzyku angielskim, okreĞlających dane metody za akronimy, czyli ich nazwy.
78
n
za
li
VT
TK
os
WymieĔmy kilka z tych metod:
• AES - Auger Electron Spectroscopy - spektroskopia elektronów Auger’a,
• SIMS - Secondary Ion Mass Spectroscopy - spektroskopia masowa jonów wtórnych,
• SNMS - Secondary Neutrals Mass Spectroscopy - spektroskopia masowa zobojĊtnionych jonów wtórnych,
• ESCA - Electron Spectroscopy for Chemical Analysis - spektroskopia
elektronowa dla celów analizy chemicznej. Metoda ta ma dwa warianty,
zaleĪnie od energii fotonów pobudzających próbkĊ; mamy wiĊc:
• UPS - Ultraviolet Photoelectron Spectroscopy - spektroskopia
fotoelektronów wzbudzanych promieniowaniem ultrafioletowym,
• XPS X-ray Photoelectron Spectroscopy - spektroskopia fotoelektronów wzbudzanych promieniowaniem rentgenowskim,
• RBS - Rutherford Back Scattering - spektroskopia jonów rozpraszanych
w geometrii Rutherforda,
• GDOES Glow Discharge Optical Emission Spectroscopy - optyczna spektroskopia emisyjna wyáadowania jarzeniowego (niekiedy stosowana jest nazwa: GDOS - Glow Discharge Optical Spectroscopy - spektroskopia optyczna wyáadowania jarzeniowego),
• GDMS - Glow Discharge Mass Spectroscopy - spektroskopia masowa
wyáadowania jarzeniowego.
Wszystkie z wymienionych metod (oprócz GDOS) pozwalają na analizĊ próbek na gáĊbokoĞü kilku do kilkudziesiĊciu Å ngstromów, tj. kilku do
kilkunastu staáych sieci. Chcąc dokonaü analizy profilowej naleĪy sukcesywnie usuwaü przeanalizowane juĪ warstwy poprzez rozpylanie, zwykle przy
pomocy dziaáa jonowego.
Ogólna idea wszystkich metod jest taka sama, niezaleĪnie od wykorzystanych do celów analizy zjawisk fizycznych. Powierzchnia próbki poddawana jest dziaáaniu strumienia cząstek (elektronów, jonów, fotonów) o
okreĞlonych parametrach (energia, natĊĪenie), a analizie i detekcji podlegają cząstki wyzwalane z powierzchni (jony, elektrony, fotony). W rezultacie
otrzymuje siĊ zapis natĊĪenia emitowanych z powierzchni cząstek w funkcji
energii, masy lub czĊstotliwoĞci, czyli ich widmo (inaczej spektrum). Stąd
okreĞlenie ich nazw - spektroskopowe.
Inną wspólną cechą dla metod analizy powierzchni jest wykorzystywanie wysokiej jakoĞci systemów próĪniowych w zakresie ultrawysokiej wysokiej próĪni oraz wyrafinowanych elementów techniki i miernictwa próĪniowego.
79
n
za
li
Dalej zostanie
omówiona jedna z wymienionych wyĪej metod,
mianowicie
GDOS. Jednak dla zilustrowania róĪnorodnoĞci zjawisk fizycznych
wykorzystywanych w
analizie profilowej omówmy najpierw pokrótce najpopularniejszą chyba
z nich tj. SpektroskopiĊ Elektronów Auger’a.
Schemat ideowy metody AES przedstawiony jest na rysunku 1.71.
Na powierzchniĊ próbki pada wiązka elektronów Ep o duĪej energii, 5 - 10
keV, znacznie przewyĪszającej energiĊ jonizacji atomów próbki z podstawowego poziomu energetycznego K. W wyniku oddziaáywania padającej wiązki elektronów z powierzchnią próbki nastĊpuje rozpraszanie padających elektronów ER, wyemitowane zostają wybite z poziomów wewnĊtrznych atomów elektrony EE, wypromieniowana jest fala elektromagnetyczna w zakresie rentgenowskim X oraz emitowane są elektrony o charakterystycznym widmie energetycznym, zwane elektronami Auger’a.
TK
os
Auger Pierre Victor ur. 1899 fizyk francuski, prof. Sorbony, i dyr. Dept. Nauk. Przyrodniczych UNESCO; prace z
fizyki atomowej i promieniowania kosmicznego.
Zjawisko Auger'a - bezradiacyjny sposób przejĞcia atomu
ze wzbudzonego stanu elektronowego do stanu o niĪszej
energii poáączony z emisją elektronów (tzw. elektronów
Auger'a z zewnĊtrznej Powáoki elektronowej)
Rys. 1.71. Schemat ideowy metody AES
- wiązka elektronów jonizujących,
EP
- elektrony wybite z próbki w wyniku jonizacji,
EE
- elektrony rozproszone,
ER
- elektrony Auger’a,
EA
VT
WyjaĞnijmy mechanizm emisji elektronów Auger’a, wykorzystując w tym celu
uproszczony, schematyczny wykres struktury energetycznej elektronów w ciele
staáym, ĞciĞlej w metalu. Przedstawia go rysunek 1.72.
80
n
za
li
os
Rys. 1.72. Schematyczny wykres pasmowej struktury energetycznej metalu
ilustrujący mechanizm generacji elektronów Auger’a (w AES
przyjmuje siĊ zwyczajowo zero energii na poziomie Fermiego).
TK
Po lewej stronie pokazany jest stan podstawowy ukáadu. Na rysunku
Ğrodkowym padający elektron o energii EP>>EK wybija elektron z poziomu K (jonizacja) wytwarzając na nim dziurĊ. Dziura ta zapeániana jest przez
elektron rekombinujący z poziomu L1. Wyzwalana jest przy tym energia
∆E=E K-EL1, która moĪe zostaü uwolniona poprzez emisjĊ fotonu o czĊstotliwoĞci:
ν=
1
( E K − E L1 )
h
VT
lub teĪ zostaü przekazana bezpromieniĞcie innemu elektronowi na
tym samym poziomie energetycznym (lub poziomie bardziej páytkim) powodując jego emisjĊ.
Pierwszy z procesów nazywany jest fluorescencją rentgenowską
i wiąĪe siĊ z tzw. charakterystycznym promieniowaniem rentgenowskim,
drugi zaĞ jest procesem emisji elektronu Auger’a.
W przykáadzie na rysunku nadmiar energii zostaá przekazany elektronowi na poziomie L2,3, a zatem wyemitowany elektron Augera ma energiĊ:
E A = E KL1L 23 = E K − E L1 − E ∗L 2 , 3
81
n
za
li
Gwiazdka przy sym-
∗
bolu E L 2 , 3 oznacza, Īe war-
toĞü energii elektronu na
tym poziomie mierzona jest
w warunkach istnienia dziury na poziomie EL1 , róĪna
jest zatem od energii EL23.
Naturalnie w atomach ciaáa staáego, którego
struktura energetyczna
przedstawiona jest na rysunku moĪliwe są i realizują siĊ,
inne przejĞcia np. KL 1L 1,
L1L2,3L2,3. Elektrony biorące
udziaá w procesie Auger’a
mogą pochodziü takĪe z pasma walencyjnego. W tym
przypadku przyjĊto uĪywaü
oznaczeĔ na przykáad KL1V
- jeĞli jeden elektron pochodzi z pasma walencyjnego
lub teĪ KVV jeĞli obydwa
elektrony pochodzą z pasma
walencyjnego.
os
Gwoli ĞcisáoĞci naleĪy wyjaĞniü pewną niekonsekwencjĊ oznaczeĔ na rysunku 4.3. JeĞli rysunek ten ilustruje strukturĊ energetyczną elektronów
w metalu, to zbĊdne jest wydzielanie pasma walencyjnego. Z teorii elektronów swobodnych wiadomo
bowiem, Īe w metalach puste pasmo przewodnictwa
przekrywa siĊ z pasmem elektronów walencyjnych
tworząc kontinuum. W spektroskopii wydziela siĊ to
pasmo pragnąc podkreĞliü, Īe chodzi o elektrony biorące udziaá w wiązaniach chemicznych - elektrony
walencyjne. MoĪna, idąc na pewnego rodzaju kompromis, powiedzieü, Īe rysunek 4.3. przedstawia sytuacjĊ dla temperatury równej 0°K, w której elektrony swobodne zajmują wszystkie poziomy energetyczne do poziomu Fermiego.
ENERGIA FERMIEGO EF - najwyĪsza wartoĞü energii elektronów swobodnych w metalu w temperaturze zera
bezwzglĊdnego, lub teĪ, dla T > 0°K, taki poziom
energetyczny w paĞmie przewodnictwa, którego
prawdopodobieĔstwo obsadzenia przez elektrony
wynosi 1/2. Definicje te wynikają z funkcji rozkáadu
statystycznego energii elektronów swobodnych w
metalu, tzw. funkcji Fermiego - Diraca:
f F − D (E ) =
1
E − EF
exp
+1
kT
TK
PRACA WYJĝCIA elektronów z metalu (oznaczenie φ lub
w) to wartoĞü energii, którą trzeba dostarczyü elektronowi przewodnictwa by wyprowadziü go z
wnĊtrza metalu. WielkoĞü ta wprowadzona jest w sáynnym wzorze Einstein`a opisującym efekt fotoelektryczny (zewnĊtrzny):
hν=W+Ekinet
Najistotniejszym jest, Īe energie elektronów Auger’a wyraĪone for-
muáą typu E KL1L 2 , 3 są funkcją jedynie atomowych poziomów energetycz-
VT
nych, zatem dla kaĪdego pierwiastka ukáadu okresowego istnieje jeden i
tylko jeden zbiór energii elektronów Auger’a, nie ma bowiem dwóch pierwiastków o tych wartoĞciach energii wiązania elektronów.
82
n
za
li
TK
os
Stąd AES pozwala na jednoznaczną analizĊ jakoĞciową, tj. identyfikacjĊ pierwiastków próbki, nawet w przypadku gdy obydwa elektrony biorące
udziaá w procesie Auger’a pochodzą z pasma walencyjnego. Identyfikacja
taka jest moĪliwa, poniewaĪ w wyraĪeniu na energiĊ elektronu Auger’a dominującym czáonem jest energia wyjĞciowego jonizowanego poziomu
energetycznego.
VT
Rys. 1.73. Schemat ideowy wyáadowawczej lampy Grimm’a oraz ilustracja
realizowanego
w niej obciĊtego wyáadowania jarzeniowego.
83
n
za
li
VT
TK
os
Analiza iloĞciowa przy pomocy AES polega na porównywaniu uzyskiwanych widm z widmami próbek wzorcowych.
PrzejdĨmy do zapowiadanego opisu innej z metod analizy profilowej,
GDOS - Optycznej Spektroskopii Emisyjnej Wyáadowania Jarzeniowego.
Do badania profilu skáadu chemicznego warstw i podáoĪa w GDOS
wykorzystuje siĊ zjawisko wyáadowania jarzeniowego w anormalnej czĊĞci
jego charakterystyki. Badana próbka (warstwa, lity materiaá) stanowi katodĊ komory pomiarowej. AnodĊ stanowi obudowa.
Metoda GDOS jako narzĊdzie analityczne zostaáa wprowadzona w
1968 roku przez W. Grimm’a. Grimm podaá teĪ rozwiązanie komory pomiarowej, która stosowana jest do dziĞ. Przedstawiona jest ona na rys. 1.73.
W istocie swej lampa Grimma stanowi napylarkĊ diodową, w której
podáoĪem jest specjalnie skonstruowana anoda (a wáaĞciwie ekran katody),
katodĊ zaĞ stanowi badana próbka. DziĊki takiemu rozwiązaniu realizujące
siĊ lampie Grimma wyáadowanie jarzeniowe zostaje ograniczone do obszaru
zorzy (poĞwiaty) ujemnej.
W GDOS Ĩródáem informacji o rodzaju i iloĞci atomów tworzących
badaną próbkĊ jest powstające w wyáadowaniu jarzeniowym promieniowanie elektromagnetyczne w obszarze ultrafioletu, widzialnym i podczerwieni,
czyli w przybliĪeniu w zakresie dáugoĞci fali od 2000Å do 9000Å .
Widmo to moĪe pochodziü zarówno od atomów jak i jonów wybijanych z podáoĪa dziĊki efektowi rozpylania diodowego i wzbudzanych optycznie w aktach zderzeĔ z elektronami.
Jako gaz roboczy stosuje siĊ zwykle argon o wysokiej czystoĞci, którego linie emisyjne wystĊpują oczywiĞcie takĪe w badanym widmie optycznym stanowiąc niepoĪądane táo.
ZauwaĪmy, Īe dziĊki wykorzystaniu wyáadowania jarzeniowego w
GDOS uzyskuje siĊ jednoczeĞnie: Ĩródáo informacji o próbce (widmo optyczne) oraz efekt ciągáego strawiania powierzchni niezbĊdnej dla analizy profilowej.
Zwróümy teraz uwagĊ na schemat ideowy spektrometru GDOS
(rys. 1.74). CiĞnienie robocze argonu w lampie Grimma moĪna zmieniaü
typowo w granicach 0,1 - 50 Tor. Za ciĞnienie robocze uwaĪa siĊ ciĞnienie w
strefie anodowej (patrz rysunek 1.73). StrefĊ katody, tj. bardzo wąski obszar
miĊdzy katodą a anodą, odpompowuje siĊ do wyĪszej próĪni, tak aby niemoĪliwe byáo powstanie w niej „faászywego” wyáadowania jarzeniowego.
OdlegáoĞü katoda - anoda w tej strefie musi byü zatem mniejsza od szerokoĞci ciemni katodowej w caáym zakresie stosowanych ciĞnieĔ Ar.
84
n
za
li
os
Rys. 1.74 Schemat ideowy spektrometru GDOS.
TK
Dla uzyskania dokáadnoĞci i powtarzalnoĞci pomiarów metodą GDOS
stabilizuje siĊ ciĞnienie gazu roboczego wykorzystując na przykáad sprzĊĪenie próĪniomierza strefy anodowej z elektromagnetycznym zaworem dozującym ten gaz.
JeĪeli przedmiotem badaĔ są próbki przewodzące (metale, póáprzewodniki o maáej opornoĞci elektrycznej) do wzbudzenia wyáadowania jarzeniowego stosuje siĊ regulowane zasilacze staáoprądowe stabilizowane bądĨ
prądowo, bądĨ napiĊciowo. Typowe wartoĞci stosowanych prądów i napiĊü
to:
• prąd: od kilkunastu do 300 mA,
• napiĊcie: od kilkuset do 2 kV.
VT
Dla analizy próbek izolacyjnych stosuje siĊ zasilanie prądem przemiennym wysokiej czĊstotliwoĞci (typowo 13,56 MHz).
W związku z duĪą wartoĞcią mocy wydzielanej na katodzie jej korpus
cháodzony jest intesywnie wodą.
Standardowo Ğrednica wewnĊtrzna anody w lampie Grimm’a wynosi
4 lub 8 mm, jednak Ğrednica próbki (w ksztaácie páaskiego walca) musi byü
duĪo wiĊksza (10 - 300 mm) ze wzglĊdu na koniecznoĞü dobrego kontaktu
cieplnego z korpusem katody (cháodzenie).
85
n
za
li
TK
os
W torze analizy optycznej uĪywa siĊ róĪnego rodzaju elementy dyspersyjne i detektory pozwalające na ciągáy, w czasie, zapis wybranego obszaru
widma lub tylko wybranych linii emisyjnych.
Typowa, zdolnoĞü rozdzielcza ukáadów optycznych wynosi od 1Å do 0,1Å .
Przy pomocy szybkiego systemu zbierania i obróbki danych zapisuje
siĊ widmo w wybranym zakresie dáugoĞci fali, identyfikuje poszczególne linie widmowe pierwiastków wchodzących w skáad próbki, a nastĊpnie zapisuje siĊ je w funkcji czasu. Przy znanej szybkoĞci strawiania próbki transformuje siĊ uzyskane przebiegi czasowe na zaleĪnoĞü koncentracji (zwykle wzglĊdną) okreĞlonego pierwiastka od odlegáoĞci od powierzchni. Uzyskuje siĊ w
ten sposób obraz profilu skáadu chemicznego próbki.
W metodzie GDOS typowe prĊdkoĞci strawiania powierzchni to: 1 - 100
nm/s.
Granica detekcji w GDOS wynosi od 1 - 10 ppm.
AnalizĊ iloĞciową skáadu chemicznego przeprowadza siĊ w oparciu o
wykresy uzyskane dla próbek wzorcowych opierając siĊ na zaáoĪeniu, Īe
natĊĪenie linii widmowej danego pierwiastka jest proporcjonalne do jego
iloĞci w badanej próbce.
Dodajmy, Īe GDOS wystĊpują typowe dla metod spektrometrycznych problemy jak wybór do analizy „czystej” linii emisyjnej nie przekrywającej siĊ z liniami od innych pierwiastków, lub jej separacja, czy teĪ zagadnienie zwiĊkszania stosunku sygnaá uĪyteczny - szum.
W GDOS dla celów analitycznych stosuje siĊ nastĊpujące parametry:
• szybkoĞü rozpylania:
q=
m
µg
,
t
s
gdzie: m - ubytek masy katody, t -
czas.
• zredukowana szybkoĞü rozpylania Q, tj. szybkoĞü rozpylania znormalizowana do prądu katodowego:
Q=
q
µg
,
I
s ⋅A
• szybkoĞü penetracji „W” tj. szybkoĞü rozpylania w jednostkach gruboĞü
warstwy na czas:
10 − 2 µg ⋅ s −1 µm
10 − 2 q
w=
,
=
ρ⋅S
g ⋅ cm 2 s
3
cm
gdzie: q - szybkoĞü rozpylania,
VT
r - gĊstoĞü próbki, S - powierzchnia próbki.
86
n
za
li
• zredukowana szybkoĞü penetracji, tj. szybkoĞü penetracji znormalizow
µm
,
I
s ⋅ A
• wydajnoĞü rozpylania (wydajnoĞü kwantowa) S, tj. iloĞü wybitych z
wana do prądu katodowego: W =
10 −6 qN ⋅ e
S
=
katody atomów przez jeden padający na katodĊ jon:
M ⋅ I jon gdzie:q
- szybkoĞü rozpylania [(g(s-1], N - liczba Avogadro [mol-1], e - áadunek
elektryczny [C], M -ciĊĪar atomowy, Ijon - prąd jonowy
I
os
• prąd jonowy związany jest z prądem caákowitym relacją: I jon = 1 + γ ,
gdzie: γ - Ğrednia iloĞü elektronów wtórnych wybijanych z katody przez
jeden jon.
Podstawiając numeryczne dane do wyraĪenia na S i wykorzystując definicjĊ
q oraz Ijon otrzymuje siĊ parametr:
S
Q
= 0,0965 ,
1+ γ
M
który okreĞla siĊ mianem
skorygowanej wydajnoĞci kwantowej.
Dla celów analizy iloĞciowej istotna jest znajomoĞü szybkoĞci rozpylania danej próbki. Okazuje siĊ, Īe szybkoĞü rozpylania q speánia prostą, em-
VT
TK
piryczną formuáĊ: q = C Q I(U − U 0 ) gdzie: I, U - prąd i napiĊcie wyáadowania, CQ,U0 - staáe zaleĪne od materiaáu katody, rodzaju uĪytego gazu roboczego i geometrii komory wyáadowawczej, lecz niezaleĪnie od prądu i napiĊcia wyáadowania oraz ciĞnienia gazu roboczego.
Metoda GDOS znajduje coraz szersze zastosowanie tak w pracach
typowo badawczych jak i w kontrolnych laboratoriach przemysáowych ze
wzglĊdu na prostotĊ konstrukcji i niezawodnoĞü dziaáania lampy Grimm’a,
wysoką czuáoĞü, krótki czas przeprowadzania analiz oraz stosunkowo nieduĪe koszty urządzenia.
Inne zalety metody GDOS to:
• minimalny wpáyw osnowy (matrycy) materiaáu na rezultaty analizy,
• liniowoĞü krzywych kalibracji dla analizy iloĞciowej,
• moĪliwoĞü wykorzystania jednej krzywej kalibracyjnej dla analizy kilku
materiaáów,
• moĪliwoĞü równoczesnego okreĞlenia dominujących, minimalnych i Ğladowych koncentracji pierwiastków w badanym materiale,
• minimalne táo widmowe.
87
n
za
li
Oprócz zaakcentowanego na początku zastosowania GDOS do analizy
profilu skáadu chemicznego twardych pokryü typu TiN, metodĊ tĊ wykorzystuje siĊ do analizy miĊdzy innymi:
• rezultatów azotowania, nawĊglania, azotonawĊglania, borowania stali,
• skáadu warstw skorodowanych, utlenionych, spasywowanych,
• rezultatów implantacji jonowej,
• wszelkiego rodzaju warstw nakáadanych róĪnymi metodami,
• analizy iloĞciowej: Īeliwa (biaáego, szarego, wysokostopowego itd.), stali
wszelkiego rodzaju, niklu i stopów kobaltowych, stopów miedzi (brązy,
mosiądze), stopy aluminium, stopy tytanu itd.
3.2. Pomiar gruboĞci cienkich warstw metodą Kalotest.
os
Do pomiaru gruboĞci cienkich warstw wykorzystuje siĊ wiele metod.
WĞród nich znajdują siĊ miĊdzy innymi:
• metoda grawimetryczna,
• metoda profilograficzna,
• metoda zwana Kalotest.
TK
Metoda grawimetryczna (rys. 1.75) jest chyba najstarszą z metod pomiaru gruboĞci warstw. Procedura tej metody sprowadza
siĊ do waĪenia podáoĪa przed
i po naniesieniu na nie cienkiej warstwy.
JeĪeli: W - jest róĪnicą
w ciĊĪarze, A - powierzchnią
podáoĪa na które naniesiono
warstwĊ, r - ciĊĪarem wáaĞciwym materiaáu warstwy, to
Rys. 1.75.
Metoda wagowa pomiaru
gruboĞü warstwy wynosi:
d=
W
A⋅ ρ
gruboĞci warstw
VT
Pomijając wszystkie, rzucające siĊ w oczy zastrzeĪenia, które moĪna mieü
analizując tĊ metodĊ naleĪy zauwaĪyü, Īe jej dokáadnoĞü jest duĪa (~1%) i
Īe pozwala zmierzyü gruboĞü warstw rzĊdu kilku Å .
88
n
za
li
Rys. 1.76. Metoda profilograficzna
pomiaru gruboĞci
warstw
os
W metodzie profilograficznej
(rys. 1.76) do okreĞlenia gruboĞci
warstw wykorzystuje siĊ standardowy profilograf uĪywany zwykle do
charakteryzowania chropowatoĞci
powierzchni. Idea pomiaru przedstawiona jest na rysunku. W wyniku zastosowania tej metody otrzymuje siĊ
profilogram warstwy z podáoĪem,
przy czym próbkĊ wykonuje siĊ w ten
sposób, Īe warstwa posiada jeden lub
kilka uskoków. OkreĞlając bezpoĞrednio z profilogramu wysokoĞü tego
uskoku otrzymuje siĊ gruboĞü warstwy.
Istnienie uskoków warstwy moĪna zabezpieczyü przed procesem jej
nanoszenia poprzez wykonanie odpowiedniego maskowania fragmentów
powierzchni podáoĪa lub teĪ moĪna je wykonaü na naniesionej juĪ warstwie
na przykáad metodami selektywnego trawienia chemicznego lub jonowego,
czy teĪ poprzez mechaniczne Ğcieranie.
TK
Zasada metody Calotest („calo” - wá. - ubytek, strata na wadze) jest
niezwykle prosta. Kula, zwykle stalowa, o znanym promieniu R obraca siĊ
na powierzchni warstwy. W wyniku tarcia nastĊpuje usuniĊcie materiaáu
warstwy i podáoĪa. Geometrycznie,
Ğlady usuniĊtych: warstwy i podáoĪa mają ksztaát koncentrycznych
kóá. W celu wyznaczenia gruboĞci
warstwy wykonuje siĊ pomiar ich
Ğrednic, zazwyczaj przy pomocy mikroskopu metalograficznego.
VT
Kolejny zamieszczony rysunek
(rys. 1.77) ilustruje bliĪej tĊ metodĊ,
nastĊpne zaĞ pomocne są przy wyprowadzaniu wzorów na gruboĞü
warstwy.
Rys. 1.77. Idea metody Kalotest
89
n
za
li
x=
PoniewaĪ:
os
Dla wyprowadzenia wzoru na gruboĞü warstwy mierzonej metodą
Calotest wprowadzimy nastĊpujące oznaczenia (patrz rysunki 1.78, 1.79,
1.80):
R - promieĔ kuli Ğcierającej warstwĊ,
T - wysokoĞü odcinka kuli (takĪe caákowita gáĊbokoĞü wytarcia),
D - Ğrednica odcinka kuli (takĪe zewnĊtrzna Ğrednica wytarcia),
d - wewnĊtrzna Ğrednica wytarcia
(Ğrednica wytarcia podáoĪa),
S - gruboĞü warstwy,
Rys. 1.78. Oznaczenie parametrów
t - gruboĞü startego podáoĪa.
kuli.
x, y - wielkoĞci pomocnicze, przy czym,
jak widaü z rysunku:
D+d
2
,
y=
D−d
.
2
S=T-t ,
T = R − 12 4R 2 − D 2 , t = R − 12 4 R 2 − d 2 ,
to gruboĞü warstwy S wynosi:
a:
TK
S=
1
2
[ 4R
2
]
− d 2 − 4R 2 − D 2 .
Dla obliczenia S moĪna posáuĪyü siĊ
uproszczoną formuáą; zauwaĪmy, Īe:
d<<R oraz D<<R.
Rozwijając, przy tych warunkach,
wzór na "S" w szereg Taylora otrzymamy:
S=
xy
.
2R
Báąd obliczeĔ S oceniany jest na ≤
1%
VT
Rys. 1.79. Oznaczenie Ğladów wytarcia
w przypadku jednej
warstwy
90
n
za
li
os
JeĪeli badana warstwa ma
strukturĊ wielowarstwową (patrz
rysunek 1.80), to do obliczeĔ gruboĞci poszczególnych warstw naleĪy wielokrotnie wykorzystaü wprowadzony wzór.
Zwróümy uwagĊ, Īe Ğlad wytarcia warstwy i podáoĪa kulką stalową, przy duĪej jej Ğrednicy - standardem jest ϕ = 10mm - jest w rzeczy samej szlifem ukoĞnym. MoĪna
zatem dodatkowo oceniü:
• budowĊ warstwy (lita, porowata,
kompo zytowa itd.),
Rys. 1.80. Oznaczenie Ğladów
• strukturĊ warstwy (jedno- czy wielowytarcia w przypadku
fazowa).
trzech warstw
MoĪna teĪ oceniü jej odpornoĞü na zuĪycie poprzez okreĞlenie objĊtoĞci V
usuniĊtej warstwy i podáoĪa w jednostce czasu t (np. 1 minuta).Wprowadza
siĊ w tym celu parametr:
t s
V m 3
ObjĊtoĞü odcinka kuli, V wynosi :
1
V
t
=
TK
γ=
V = 13 πh 2 (3R − h )
Rys. 1.81. Odcinek kuli.
VT
Na koniec kilka uwag praktycznych:
• dla szybkiego uzyskania szlifu stosuje siĊ drobnoziarnistą pastĊ diamentową,
• aby uzyskaü wyraĨnie zarysowaną granicĊ: podáoĪe - warstwa moĪna uĪyü
Ğrodka trawiącego i zaczerniającego podáoĪe, a nie trawiącego materiaáu
warstwy. Na przykáad dla warstw TiN na stalach wystarczy sáaby roztwór kwasu azotowego.
• nacisk kulki na podáoĪe moĪna zmieniaü przez dobór kąta pochylenia α
(patrz rys. 1.77).
91