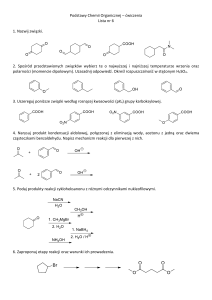
Test II modelowanie
Zakres materiału ze skryptu od str.
64
Bieg każdej reakcji chemicznej może się
zatrzymać:
• A) Po dojściu do stanu
równowagi,
• B) Po podwyższeniu ciśnienia,
• C) Po podwyższeniu temperatury.
•
1
Entalpla tworzenia siarczków dla siarczków
FeS, Na2S, ZnS jest najmniejsza dla:
• A) FeS
• B) Na2S
• C) ZnS
2
Stała Równowagi KC:
• A) nie może być obliczona ze swobodnych entalpii
substancji,
• B ) może być obliczona ze swobodnych entalpii substancji,
• C) może być obliczona ze stałej równowagi.
• 3
Stała Równowagi Kp:
• a) może być obliczona jeśli znana jest aktywność
ciśnieniowa aj,
• b) nie może być obliczona nawet jeśli znana jest
aktywność ciśnieniowa aj,
• c) nie zależy od aktywności ciśnieniowej aj.
• 4
xj oznacza
• a) ułamek molowy pod ciśnieniem całkowitym P,
• b) ułamek molowy pod ciśnieniem cząstkowym pi,
• c) aktywność cząstkowa.
• 5
Ponadczasowym zbiorem wszelkich danych
fizykochemicznych zestawionych dla
różnych indywiduów oraz zmiennych i
stałych parametrów:
• a) jest poradnik zwany Kalendarzem
Chemicznym,
• b) jest encyklopedia techniki ,
• c) jest encyklopedia techniki tom Chemia.
•6
Maksymalny stopień przemian Umax przy
odpowiednio wysokim rozcieńczeniu:
• a) nie może być obliczony dzięki obliczeniu
log Kp - S [vi log(fj P)] (86),
• b) może być obliczony dzięki obliczeniu log
Kp - S [vi log(fj P)] (86),
• c) pobierany jest z tabel.
• 7
Entalpia swobodna dla gazu w stanie
doskonałym pod ciśnieniem 1013 hPa to:
• a) Hth/T = (H-H0)/T kJ/kmol (92),
• b) G0 = H0 – TS kJ/kmol
(93),
• c) (G0 - Hoo)/T kJ/kmol deg (94.
• 8
Wartość funkcji entalpii swobodnej pod
ciśnieniem 1013 hPa, jak również entalpii
tworzenia w temp. 0°K, które podano w
tabeli 2:
• a) można znaleźć w dziele Ullmanna tom I
str. 891,
• b) można znaleźć w dziele Kalendarz
chemiczny tom I str . 891,
• c) można znaleźć w dziele Encyklopedia
Techniki tom Chemia str. 891.
• 9
Fundamentalnym dziełem - książką
niezwykle pomocną w obliczeniach entalpii
jest wymieniona w skrypcie:
• a) Walter Broetz: „Grundlagen der chemischen
Reaktionstechnik” Verlag Chemie, 1958,
• b) Walter Broetz: Podstawy Inżynierii reakcji
chemicznych PWN W-wa, 1964, str.36
• c) Tadeusz Hobler – „Ruch ciepła i wymienniki”,
WNT, Warszawa 1962
• 10
Systemy komputerowego projektowania
materiałowego indywiduów oraz zmiennych
i stałych parametrów:
• a) SKPM
• b) CAMD
• c) SKPMOz.
• 11
Systemy komputerowego planowanie i
sterowanie produkcją to:
• a) SKOiSP,
• b) PPC,
• c) SKPiSP.
• 12
Systemy komputerowego
wspomagania wytwarzania to:
• a) CAD,
• b) SKWiW,
• c) CAM.
• 13
Systemy z grupy CAxx obejmujące
Projektowanie wytworu, produktu,
Określanie parametrów jakości, Pomiary,
Statystyka i protokoły to :
• a) CAQ,
• b) PPC,
• c) CAD.
• 14
Pakiet programów flowsheetingowych ***** firmy
Chemstations Inc to:
• a) CHEMCAD,
• b) HYSYS,
• c) ASPEN.
• 15
Pakiety programów ***** firmy Chemstations Inc są :
• a) programami z serii GNU,
• b) licencjonowane iI zabezpieczane
kluczem,
• c) Programami Open – sources.
•
http://en.wikipedia.org/wiki/List_of_che
mical_process_simulators
• 16
Główny składnik ChemCad’a służy do projektowania,
wyznaczania szybkości i optymalizacji procesów :
• a) w warunkach nieustalonych,
• b) w warunkach równowagowych,
• c) w warunkach chwilowych.
• 17
Moduły ChemCad’a pozwalają na wykonywanie
obliczeń:
• a) Analizy ryzyka (bezpieczeństwa),
• b) nie pozwalają na obliczanie Analizy ryzyka
(bezpieczeństwa),
• c) Analizy ryzyka (bezpieczeństwa) po wniesieniu
dodatkowych opłat.
18
Moduły ChemCada wyposażone są w pozwalają na
wykorzystywanie możliwości:
• a) opcji Visual Basic,
• b) opcji Turbo Pascal,
• c) opcji Delphi.
•
19
Symulator ChemCada:
• a) nie ma bazy danych fizykochemicznych
substancji i równowag fazowych,
• b) wyposażony jest w sporą bazę danych
fizykochemicznych substancji i równowag
fazowych,
• c) pozwala na zainstalowanie bazy danych
fizykochemicznych substancji i równowag fazowych
za dodatkową opłata.
20
Moduły ChemCada mają:
• a) Utrudniony dostęp do wyboru składników
chemicznych układu, elektrolitów i składników stałych a
także do krzywych destylacyjnych,
• b) Szybki dostęp do wyboru składników chemicznych
układu, elektrolitów i składników stałych a także do
krzywych destylacyjnych,
• c) dostęp do wyboru składników chemicznych układu,
elektrolitów i składników stałych a także do krzywych
destylacyjnych po wniesieniu dodatkowych opłat .
21
Kwas siarkowy:
• a) wytwarzany jest w okolicy rynków zbytu tego
produktu,
• b) wytwarzany jest w okolicy źródeł siarki kopalnej,
• c) wytwarzany jest głównie na Podkarpaciu.
22
Butadien otrzymuje się przez:
• a) uwodornienie butanu,
• b) odwodornienie butanu,
• c) izomeryzację butanu.
23
Z wykresu Sankeya wynika, że butadien powstaje
butanu z wydajnością:
• a) ok. 93%,
• b) ok. 7%,
• c) ok. 100% .
24
Reakcja otrzymywania kumenu jest reakcją:
• a) endotermiczną,
• b) egzotermiczną,
• c) autotermiczną.
25
Reakcja otrzymywania kumenu jest reakcją:
• a) sulfonowania,
• b) alkilowania,
• c) arylowania.
26
Reakcja otrzymywania kumenu prowadzona
jest z wydajnością ok.:
• a) 78% kumenu,
• b) 96% kumenu,
• c) 100%.
27
Aceton i fenol otrzymuje się głownie:
• a) przez rozkład wodoronadtlenku
kumenu,
• b) metodą bioinżynieryjną,
• c) metodą fermentacyjną.
28
Aceton i fenol powstają w metodzie „kumenowej” w
proporcjach:
• a) fenol 100Mg/Aceton 42Mg,
• b) fenol 100Mg/Aceton 62Mg,
• c) fenol 62Mg/Aceton 100Mg.
29
Kwas acetylosalicylowy powstaje:
• a) w procesie chlorowania kwasu
salicylowego,
• b) w procesie acylowania kwasu
salicylowego,
• c) w procesie hydrolizy estru.
30
Przy 100% wydajności na 100Mg kwasu
acetylosalicylowego należy użyć:
• a) ok. 77,42 Mg kwasu
salicylowego,
• b) ok. 79,63 Mg kwasu
salicylowego,
• c) ok. 144 Mg kwasu salicylowego.
31
Głównym źródłem przemysłowego
wytwarzania kwasu octowego jest:
• a)fermentacja alkoholowa cukrów,
• b) karbonylowanie metanolu,
• c) utlenianie alkoholu z fermentacj.
32
Na każde 100Mg kwasu octowego z karbonylowania
metanolu przy 100% wydajności należałoby użyć:
• a) 53,3 Mg metanolu,
• b) 114,3 Mg metanolu,
• c) 214,29 Mg metanolu.
33
Entalpia tworzenia Kwasu octowego
wynosi:
• a) -223 830 kJ/mol,
• b) -481 850 kJ/mol,
• c) -108, 940 kJ/mol.
34
Największe ilości kwasu octowego zużywa
się do produkcji:
• a) octanu sodu,
• b) octanu winylu,
• c) octanu amylu.
35
BAT -przemysł chemiczny organicznynUE
został podzielony na :
:
• a) trzy sektory,
• b) cztery sektory,
• c) pięć sektorów.
36