Własności cieplne materii
Ciepło – sposób przekazywania energii między ciałami
Tc Tn
Q
Temperatura – parametr
określający stan ciała
zależy od średniej energii
kinetycznej molekuł, z
których zbudowane jest ciało
Ek T
W T=0K zamiera bezładny, translacyjny ruch cząsteczek.
Rozkład prędkości cząsteczek azotu w różnych
temperaturach
zakres prędkości
m/s
ułamek w % cząsteczek azotu z
prędkościami o wartościach w podanym
zakresie
od
do
291 K
421 K
0
100
300
500
700
1000
100
300
500
700
1000
1
25
42
24
7
1
0.6
12.6
30.0
29.0
23.0
5.4
mv 2
Ek
2
N2
Pęd cząsteczki azotu
p mv 2 14 1,6 1027 500
44,8 10
27
500 2,24 10
23
m
kg
s
p 2,24 1023
F
2,24 1020 N
t
0,001
Ciężar człowieka o masie 70 kg
Q mg 70 10 700 N
5
t[C] (t 32) F
9
T [K ] t[C] 273
T[ K ] T2 T1 t2 273 (t1 273) t2 t1 t[C]
Niektóre temperatury [K]
Helowa reakcja termojądrowa
108
Wnętrze Słońca
107
Powierzchnia Słońca
Topnienie wolframu
6103
3,6103
Topnienie ołowiu
6102
Zamarzanie wody
2,7102
Skraplanie tlenu
9101
Skraplanie wodoru
2101
Skraplanie helu (4He)
Skraplanie helu (3He) przy najniższym osiągalnym
ciśnieniu
4,2
310-1
Adiabatyczne rozmagnesowanie soli
paramagnetycznych
10-3
Adiabatyczne rozmagnesowanie jąder atomowych
10-6
Pomiar temperatury
Termometr – dowolny układ makroskopowy do mierzenia
temperatury:
• parametr termometryczny układu zmienia się dostatecznie
szybko, gdy układ traci lub pobiera energię
• jest znacznie mniejszy niż układy, które badamy przy jego
pomocy
• termometr pokazuje własną temperaturę = temperaturze
badanego ciała. Wskazania będą błędne, jeśli będzie
dodatkowe źródło ciepła, np. promienie słoneczne
termometr
Parametr termometryczny X
cieczowy – rtęć lub alkohol
wysokość słupa cieczy
gazowy o stałej objętości
ciśnienie
gazowy o stałym ciśnieniu
objętość
oporowy
oporność
termopara
siła termoelektryczna
itd
oporność metali
l
R
S
R Ro (1 t )
oporność półprzewodnika
Rozszerzalność cieplna
Amplituda drgań ~ 10-9 cm, częstość
~ 1013 Hz.
Przy wzroście temperatury rośnie
odległość między atomami.
kryształ NaCl
Zmiana wymiaru liniowego ciała – rozszerzalność
liniowa
·10-6 [K-1]
aluminium
23
arsen
6
kobalt
12.6
żelazo
12.5
potas
84
srebro
20
porcelana
4
stal
13
diament
1
lt l0 1 t
długość w
temperaturze t
długość w
temperaturze t =0ºC
Bimetal – element termostatu
Zmiana objętości ciała –
rozszerzalność objętościowa.
Dla ciał izotropowych współczynnik
rozszerzalności objętościowej
3
Vt V0 1 t
objętość w temperaturze t
objętość w temperaturze t =0ºC
Gęstość ciał
Gęstość ciał maleje z temperaturą
o
m
m
V Vo (1 t ) 1 t
• ogrzane ciecze i gazy unoszą się do góry,
• siła wyporu staje się mniejsza – większe zanurzenie
Fw Qc C gV
cieczy ciał st
Ciało stałe zanurzone w cieczy
• po ogrzaniu objętość ciała stałego rośnie
Vcst V0 1 cst t
• gęstość cieczy maleje
o
c
1 c t
• siła wyporu maleje
Fw C gV
cieczy ciał st
Rozszerzalność wody
Vt V0 1 t
Wartości współczynnika rozszerzalności wody
t [ºC]
0
10
20
30
40
50
60
70
80
90
100
·10-4
[1/K]
-63
+88
207
304
390
46
53
58
63
70
75
Maleje objętość – rośnie gęstość
Vt V0 1 t
0
od 0 do 4°C
o
c
1 c t
Woda z powierzchni opada na dno po oziębieniu do 4°C!
wodór
sarin
1 cm3 gazu
1019 cząsteczek.
Kalorymetria
Do ogrzania masy m danej substancji o T należy dostarczyć ciepło
Q mcT
Ciepło właściwe
1 Q
c
m T
ilość ciepła potrzebna do podgrzania 1kg danej substancji o 1K.
Pojemność cieplna
C mc
Ciepło właściwe
J/(kgK)
Ciepło
topnienia J/kg
Ciepło parowania
J/kg
aluminium
895
32·104
miedź
395
22·104
platyna
120
10.5·104
woda
4187
33.4·104
22.6·105
benzen
1710
12.7·104
39.4·104
rtęć
138.5
11.7·103
27·104
Ciepło przemiany fazowej – ciepło utajone
Q mc
topnienie (krzepnięcie)
parowanie (skraplanie)
Przemiany fazowe
topnienie
ciało stałe
ciecz
krzepnięcie
ciecz
parowanie (wrzenie)
gaz
skraplanie
sublimacja
ciało stałe
gaz
resublimacja
Co to jest przejście fazowe?
gaz
ciecz
ciało stałe
Temperatury topnienia (krzepnięcia)
rtęć
wolfram
żelazo
ołów
naftalen
parafina
alkohol etylowy
alkohol metylowy
- -39ºC
- 3380 ºC
- 1540 ºC
- 327 ºC
- 80 ºC
- 52.5 ºC
- -117,3 ºC
- - 97,8 ºC
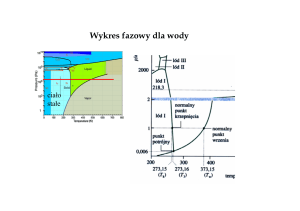
Temperatura topnienia zależy od ciśnienia
Tt
rośnie gdy
p
rośnie
topnienie
woda
lód
krzepnięcie
temperatura T
Ciała bezpostaciowe – szkło, smoła – stopniowo miękną,
przechodzą w ciecz o coraz mniejszej lepkości
Krzywa topnienia ciał
amorficznych – szkieł
ciepło Q
Parowanie i wrzenie
Parowanie jest szybsze gdy:
• jest wyższa temperatura,
• większa powierzchnia,
• ruch powietrza (wiatr).
Energia potrzebna do odparowania cieczy może
pochodzić od samej cieczy lub otoczenia
Temperatury wrzenia – ciśnienie (1000hPa), temperatura
20ºC
woda
aceton
alkohol etylowy
alkohol metylowy
gliceryna
rtęć
azot (ciekły)
- 100 ºC
- 57 ºC
- 78,3 ºC
- 64,7 ºC
- 291 ºC
- 356,9 ºC
- -195,8 ºC
Temperatura wrzenia cieczy zależy od ciśnienia
dla wody
p [hPa]
2000
1000
500
23
6,1
tw [°]
120
100
82
20
0
Objętość wody w stanie ciekłym jest mniejsza niż w stanie
stałym
Punkt potrójny – dla wody 6,1 hPa, 0,01°C
Suchy lód – zestalony CO2, temp. sublimacji -78,5°C
1 dm3 CO2 sublimuje w temperaturze pokojowej ok. 2 – 3
godz.
Roztwory
Woda morska (3,5% soli) – tw = 100,6°C, tk = -2°C
Temperatura krzepnięcia nasyconego roztworu NaCl -21°C
Podczas wrzenia i krzepnięcia roztworów w stan
gazowy/stały przechodzi rozpuszczalnik – góry lodowe
nie są słone!
Skraplanie gazów
gęstość cieczy > gęstości gazu
Skraplanie gazów – zwiększanie gęstości
przez obniżanie temperatury lub sprężanie
Punkt C – powyżej temperatury krytycznej
TC substancja nie przechodzi w fazę ciekłą
Temperatury krytyczne
tlen -119ºC
azot -147ºC
wodór -240 ºC
hel
-267,9 ºC
Wróblewski i Olszewski
Uniwersytet Jagielloński
1883 r
Energia wewnętrzna
Każdy makroskopowy układ fizyczny posiada pewien zasób
energii wewnętrznej.
Każdej pracy wykonanej przez układ lub pracy wykonanej
nad układem przez siły zewnętrzne towarzyszy zmiana stanu
układu – zmiana energii wewnętrznej.
Energia wewnętrzna układu znajdującego się w kontakcie
termicznym z innym układem również ulega zmianie.
Zmiana energii
wewnętrznej układu
praca
wymiana ciepła
Różny od pracy sposób wymiany energii nazywa się
wymianą energii na sposób ciepła.
Energia wewnętrzna to:
• energia kinetyczna ruchu cieplnego cząsteczek
• energia kinetyczna – rotacje, oscylacje, itp.
• energia potencjalna oddziaływania cząsteczek
• oraz wszelkie inne rodzaje energii.
Doświadczenie Joule’a
James Prescott Joule
(1818-1898)
Z określonej ilości pracy
otrzymuje się zawsze taką
samą ilość ciepła.
W mgh, Q mcT
• naczynie kalorymetryczne z wodą
(rtęcią),
• mieszadło – skonstruowane tak, by
opór przy mieszaniu był duży
• izolacja cieplna – układ
adiabatyczny,
• układ napędzający mieszadło,
• ciężar wykonujący pracę w polu
grawitacyjnym,
• termometr
Taki sam efekt można osiągnąć dostarczając do układu
energię na sposób ciepła
obydwa
sposoby wymiany energii są sobie równoważne.
Sumaryczna energia Wszechświata jest stała
nie można jej tworzyć lub niszczyć
a jedynie przekazywać między układami
(H. Helmholtz, 1821-1894)
Transport ciepła
przewodzenie
konwekcja
promieniowanie
przewodzenie ciepła
T2
T1
kS(T2 T1 )
Q
t
l
Współczynniki przewodnictwa cieplnego k [Wm-1K-1]
miedź
- 400
aluminium
- 240
żelazo
- 80
drewno, beton, powietrze, woda, tkanki człowieka (w tym
tłuszczowa – k < 1
Konwekcja - unoszenie
Q bSTt
Dla ciała ludzkiego współczynnik konwekcji b 7 Wm-2K-1
Promieniowanie
Prawo Stefana-Boltzmanna
T2 2T1
E2 16E1
3
3 10
m
m
T
3 10 3
m
m 10-6 m 1000nm
3000
3 10 3
m
m 0,5 10-6 m 500nm
6000
E dT St
4
Termosy – nie ma przewodnictwa i konwekcji, ścianki
metaliczne odbijają promieniowanie
Dewar - naczynie o podwójnych ściankach z wypompowanym
powietrzem do przechowywania, transportu skroplonych
gazów: tlenu, azotu, argonu, helu itp.
Wynaleziony w 1892 przez brytyjskiego fizyka Jamesa
Dewara
Energetyka organizmów
Źródło energii – utlenianie spożywanych produktów
przetwarzanie
(układ pokarmowy)
produkty
spożywcze
łączenie z tlenem
(w obecności
enzymów)
Proces odbywa się etapami – na każdym jest wyzwalana
energia
Podstawowe produkty
węglowodany
białka
tłuszcze
Wartości energetyczne
węglowodany i białka
tłuszcze
– ok. 17,5·106 J/kg
- ok. 39·106 J/kg
Organizm prawie w całości wykorzystuje ciepło spalania
węglowodanów i tłuszczów – są źródłem energii,
przekształcanie białek – pochłania 30% ich energii – są
materiałem budulcowym
Wypoczynek – 90% energii organizm uzyskuje z tłuszczów,
praca fizyczna – 60 %
intensywny wysiłek – 30%
źródłem energii neuronów jest glukoza.
Proces przemiany energii (I zasada termodynamiki)
U W Q
W – „zewnętrzna” praca organizmu, którą wykonuje
człowiek
Q – powstające ciepło, w większości wydalane z organizmu
Ciepło powstaje podczas pracy „wewnętrznej” organizmu:
• tworzenie wiązań w białkach
• transport wewnętrzny – krążenie, oddychanie, transport
jonów, powstawanie impulsów nerwowych, skurcze mięśni.
Podczas pracy wewnętrznej pokonywane są opory – np.
związane z lepkością – wydziela się ciepło – utrzymywana
jest stała temperatura
Wydajność organizmu
zewnętrzna praca mechaniczna
energia chemiczna z pożywienia
nie przekracza 30%.
Człowiek zużywa energię nawet nie wykonując pracy
zewnętrznej.
Szybkość zużywania energii potrzebnej do podtrzymania
funkcji biologicznych – nazywa się podstawowym tempem
metabolizmu.
Średnia jego wartość
1,2 W na 1 kg wagi młodego mężczyzny
1,1 W na 1 kg wagi młodej kobiety.
Człowiek o średniej masie zużywa energię w tempie:
80 J/s
150 J/s
mózg)
- podczas snu,
- w dzień, bez aktywności fizycznej (40 W
Przyjmując średnie dobowe podstawowe tempo
metabolizmu 115 W otrzymamy dobowe minimalne zużycie
energii
115·24·3600 = 9936000 ≈ 9,9 MJ
1 J = 0,24 cal
9,9 MJ = 9,7·0,24 cal = 2,376 ·106 cal = 2376 kcal
Podczas wykonywania różnych czynności tempo metabolizmu
– ΔU/Δt – wzrasta o:
• 7,7 W/kg - powolna jazda na rowerze,
• 11 W/kg
- pływanie,
• 18 W/kg - intensywny krótki bieg,
W trakcie intensywnego wysiłku człowiek zużywa energię z
szybkością 1000 W, z czego 100 W na pracę zewnętrzną.
Większa część pokrywa zwiększone zapotrzebowanie
organizmu, np. na pracę mięśni.
Można określić wydajność organizmu człowieka o masie m
podczas pracy
W 1
t m 100%
U 1
Vm
t m
Wydajności te są równe:
• 3 – 10%
• 25 – 30%
- praca łopatą, podnoszenie ciężarów,
- jazda na rowerze, wchodzenie pod górę.
Szybkość wykonywania pracy zależy od czasu jej trwania:
ponad 20 W/kg – przy wysiłkach krótkich (finisz biegu),
przy długotrwałej pracy powinno być mniejsze od 4 W/kg.
Energia uzyskiwana ze spalania produktów służy do syntezy
ATP – adenozynotrifosforanu, w którym jest magazynowana
energia chemiczna potrzebna do funkcjonowania organizmu.
ATP – akumulator energii
P. Boyer, J. Walker, 1997, nagroda Nobla z chemii za
wyjaśnienie podstaw procesów komórkowych dotyczących
przemian energetycznych z wykorzystaniem ATP.
ATP to: zasada azotowa (adenina), cukier (ryboza), 3
połączone kwasu fosforowego.
Zawartość ATP w organizmie człowieka wynosi kilkadziesiąt
gramów, dobowe zużycie – przy braku dużej aktywności
fizycznej – nawet 40 kg.
resynteza ATP z ADP – po dostarczeniu energii z procesów
spalania produktów pokarmowych.
Odłączenie ostatniej reszty kwasu fosforowego, przy udziale
wody, daje ADP (adenozynodifosforan), przy czym wydziela
się energia 29,3 kJ/mol – reakcja egzoenergetyczna.
Regulacja temperatury w organizmie
człowieka
Temperatura wpływa na przebieg procesów fizycznych i
chemicznych
• lepkość,
• gęstość,
• szybkość reakcji chemicznych.
temperatura otoczenia temperatura człowieka
Źródłem ciepła w organizmie są procesy przemiany materii.
Wartość podstawowego tempa metabolizmu
Wm = 1,2 W na 1 kg
m = 70 kg
W = 1,2 ·70 = 84 W
Energia wytworzona w ciągu 1 godziny
E = 84·3600 302 kJ
Przy intensywnej pracy energia jest dużo większa!!!
Zapobieganie przegrzaniu organizmu
przekazanie
ciepła do otoczenia
głównie konwekcja,
promieniowanie, odparowanie wody ze skóry
Przewodzenie ciepła ma istotne znaczenie gdy człowiek
znajduje się w wodzie.
Ciepło parowania wody w temp. ciała = 2,4·106 J/kg, przy
intensywnym wysiłku człowiek może odparować ponad 1 kg
potu w ciągu godziny.
Sposoby oddawania ciepła do otoczenia:
• niska temperatura otoczenia (20ºC) – promieniowanie
• wyższa temperatura (30º) – rośnie udział konwekcji
(szczególnie parowania wody)
• temp. człowieka = temperaturze otoczenia – ustaje
konwekcja i promieniowanie, pozostaje parowanie wody
Wilgotność powietrza
Para w stanie równowagi z cieczą – para nasycona
W atmosferze znajduje się para wodna – wilgotność
wilgotność względna – stosunek ilości pary wodnej
znajdującej się w danej temperaturze w określonej ilości
powietrza do ilości pary, która nasyciłaby powietrze o tej
samej temperaturze i objętości
w
100%,
n
p
w
100%
pn
Wilgotność powietrza odgrywa ważną rolę :
• przy produkcji i przechowywaniu artykułów (przędza,
papier, ziarno, zbiory muzealne),
• decyduje o zjawiskach atmosferycznych (deszcz, rosa,
mgła, chmury),
• wpływa na funkcjonowanie organizmu (pocenie się,
regulacja temperatury)
Punkt rosy – temperatura, przy której podczas oziębiania
rozpoczyna się proces skraplania pary wodnej.
Niższa temperatura – mniej pary wodnej w powietrzu do
osiągnięcia stanu nasycenia.
Najbardziej sprzyjająca człowiekowi jest wilgotność 60%.
Lepszy jest klimat gorący i suchy niż gorący i wilgotny.
Temp. otoczenia ok. 20ºC
tracenie ciepła przez:
- konwekcję – 25% do 50 % przy wietrze
- promieniowanie – 50% do 70% przy niższej temp.
- parowanie wody – 25% do 100% przy upalnej pogodzie.
ciepło z wewnętrznych narządów jest dostarczane do warstwy
powierzchniowej organizmu
jest przenoszone przez krew
W wyższej temperaturze - rozszerzenie podskórnych
naczyń krwionośnych – przyspiesza dostarczanie ciepła z
organów wewnętrznych
Wzrasta obwodowy przepływ krwi, przepływ wewnętrzny
osłabiony – niedokrwienie i omdlenie.
Zbyt szybkie parowanie – odwodnienie organizmu
Niebezpieczne odwodnienie 7-8% ciężaru ciała – wzrasta
gęstość krwi, zakłócona praca nerek, wydzielania śliny.
Z potem wydzielana jest sól – zmiany w dystrubucji płynów
ustrojowych.
Bardzo niskie temperatury
• zmniejszenie strat ciepła - kurczenie powierzchniowych
naczyń krwionośnych,
• zwiększenie szybkości wytwarzania ciepła (drżenie mięśni,
wzrost szybkości metabolizmu)
Ośrodek termoregulacji – w części mózgu – podwzgórzu
podwzgórze przednie – reaguje na temperaturę krwi i
uruchamia mechanizm usuwania ciepła,
podwzgórze tylne – reaguje na obniżenie temperatury
przez receptory w skórze i uruchamia procesy zachowania
ciepła
Krioterapia (-160ºC) – powoduje przyspieszenie
wypromieniowywanie ciepła z organizmu – zwiększa się
wydzielanie hormonów, np. adrenaliny – ustaje uczucie bólu,
można zwiększyć intensywność rehabilitacji.
Wpływ temperatury wewnętrznej na
funkcjonowanie organizmu
Temperatura człowieka – 36ºC - 38 ºC
większe zmiany – zakłócenie w funkcjonowaniu
organizmu
niebezpieczne – powyżej 41 ºC lub poniżej 33 ºC –
zakłócenie funkcjonowania mechanizmu termoregulacji
powyżej 42 ºC lub poniżej 30 ºC – mechanizm może być
wyłączony
Wzrost temperatury do 44 ºC - 45 ºC – upłynnienie błon
komórkowych, denaturacja niektórych białek – są to zmiany
nieodwracalne,
Obniżenie temperatury poniżej 28 ºC – zakłócenie pracy
serca, zmniejszenie aktywności enzymów regulujących
przemianę materii
Temperatura wewnętrzna najszybciej obniża się na
powierzchni organizmu – odmrożenia stóp, dłoni, twarzy.
Temperatura poniżej 27 ºC – może doprowadzić do ustania
funkcji organizmu