Powtórzenie – termodynamika
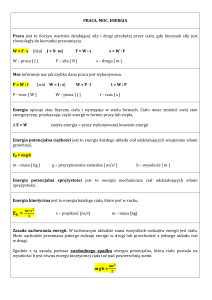
I.
Energia wewnętrzna
Wszystkie ciała zbudowane są z cząsteczek. Cząsteczki te mogą oddziaływać między sobą, poruszać
się z różnymi prędkościami, obracać wokół swojej osi, a tym samym posiadają różne rodzaje energii.
Suma wszystkich rodzajów energii cząsteczek danego ciała nosi nazwę energii wewnętrznej.
I zasada termodynamiki: zmiana energii wewnętrznej ciała lub układu ciał jest równa sumie
dostarczonego ciepła i pracy wykonanej nad ciałem przez siły zewnętrzne.
E = Q + W gdzie: E – zmiana energii, Q – ciepło wymienione z otoczeniem, W – praca
II.
Transport energii
Energia cieplna może być przekazywana przez przewodnictwo, konwekcję i promieniowanie.
Przewodnictwo polega na przekazywaniu energii wewnętrznej poprzez zderzenia cząsteczek o różnej
temperaturze. Dobrymi przewodnikami ciepła są wszystkie metale.
Konwekcja polega na unoszeniu się do góry cząsteczek ogrzanych ciał. Ciała o wyższej temperaturze
mają mniejszą gęstość i jako lżejsze unoszą się do góry. Przekazywanie energii przez konwekcję
zachodzi w cieczach i gazach. Ma ono zastosowanie przy ogrzewaniu mieszkań.
Promieniowaniem nazywamy przekazywanie energii od ciała o wyższej temperaturze do ciała
zimniejszego, do którego nie jest potrzebny żaden ośrodek materialny. Przekazywanie energii
następuje poprzez wysyłanie fal elektromagnetycznych. Ciała o różnych temperaturach wysyłają fale
różnej długości. Ciała cieplejsze wysyłają krótsze fale. Promieniowaniem cieplnym nazwano fale
elektromagnetyczne podczerwone.
III.
Ciepło właściwe
Ciepło może być dostarczone lub odebrane z układu. Ilość ciepła możemy obliczyć ze wzoru:
Q = m cw t gdzie: m – masa ciała, cw - ciepło właściwe, t – przyrost temperatury
Ciepło właściwe ciała to ilość ciepła, która jest potrzebna do zmiany
temperatury ciała o masie 1 kg o 1 C lub 1 K. Jest to cecha
charakterystyczna danej substancji. Wyznaczamy go ze wzoru:
Jednostką ciepła właściwego jest
Ciepło topnienia jest to ilość ciepła pobrana z otoczenia do zamiany 1 kg ciała stałego w ciecz w
temperaturze topnienia.
Ciepło krzepnięcia jest to ilość ciepła oddana do otoczenia podczas zamiany 1 kg cieczy w ciało
stałe w temperaturze krzepnięcia.
Ciepło parowania jest to ilość ciepła pobrana z otoczenia do zamiany 1 kg cieczy w parę bez
zmiany temperatury. Mierzy się go zazwyczaj w temperaturze wrzenia substancji.
Ciepło skraplania jest to ilość ciepła oddana do otoczenia podczas zamiany 1 kg pary w ciecz w
temperaturze wrzenia.
Aby obliczyć ciepło potrzebne na zmianę stanu skupienia korzystamy ze wzoru: Q = c m
IV.
Bilans cieplny
Gdy zetkniemy ze sobą ciała o różnych
temperaturach t1 i t2 to zachodzi między nimi
wymiana ciepła Q tak długo, aż temperatury
wszystkich ciał się wyrównają.
Przyrządem do badania bilansu cieplnego jest
kalorymetr.
Zadania:
Informacje do zadania 16.
Ciepło właściwe substancji to ilość energii, którą należy dostarczyć, aby ogrzać 1 kg
substancji o 1°C. W tabeli podano ciepła właściwe wybranych cieczy o temperaturze 20°C.
Zadanie 16. (0-1)
Do czterech jednakowych naczyń wlano po 200 gramów: kwasu octowego, oleju
lnianego, oleju parafinowego i wody (do każdego naczynia inną ciecz). Temperatura
początkowa każdej cieczy wynosiła 20°C. Do wszystkich naczyń dostarczono taką samą
ilość energii. Najbardziej wzrosła temperatura
A. kwasu octowego.
B. oleju lnianego.
C. oleju parafinowego.
D. wody.
Zadanie 34. (0-2)
Często słyszymy, że domy powinny być zbudowane z materiałów zapewniających dobrą
izolację cieplną. Wybierz spośród poniższych odpowiedzi uczniowskich dwa różne
argumenty potwierdzające tezę, że takie domy służą ochronie środowiska. Napisz
numery wybranych zdań.
1. Mniej płaci się za energię elektryczną i gaz.
2. Takie domy emitują mniej ciepła, więc zmniejsza się efekt cieplarniany.
3. Oszczędza się paliwa kopalne, bo na ogrzanie domów zużywa się mniej energii.
4. Do atmosfery przedostaje się mniej zanieczyszczeń, bo można produkować mniej
energii.
5. Do atmosfery przedostaje się mniej freonu i zmniejsza się dziura ozonowa.
6. Potrzeba mniej energii, więc jej produkcja mniej zanieczyszcza środowisko
naturalne.
7. Mieszkańcy takich domów są lepiej chronieni przed zanieczyszczeniami.
8. Ściany takich domów nie przepuszczają substancji chemicznych mogących
zaszkodzić środowisku.
Odpowiedź: ...................................................................................
Zadanie 18. (0-1)
Woda w basenie jest podgrzewana. Aby obliczyć energię potrzebną do jej ogrzania,
należy znaleźć w tablicach gęstość i ciepło właściwe wody oraz znać
A. objętość i temperaturę końcową wody.
B. objętość, temperaturę początkową i końcową wody.
C. głębokość i szerokość basenu oraz różnicę temperatur wody.
D. powierzchnię basenu oraz temperaturę początkową i końcową wody.
1. Cztery prostopadłościany: aluminiowy, mosiężny, srebrny i ołowiany, wszystkie o
jednakowych masach, wyjęto z wrzącej wody i położono równocześnie najmniejszą
płaszczyzną na jednakowych płytkach parafiny.
Ciepło właściwe ołowiu wynosi: 128 J/kg oC
Ciepło właściwe srebra wynosi: 236 J/kg oC
Ciepło właściwe mosiądzu wynosi: 377 J/kg oC
Ciepło właściwe aluminium wynosi: 902 J/kg oC
Największą ilość parafiny stopi prostopadłościan:
a) aluminiowy,
b) mosiężny,
c) srebrny,
d) ołowiany.
Zadanie 32. (0-3)
Przez kaloryfer przepływa w ciągu doby 300 kg wody, zmieniając swoją temperaturę
z 80°C na 60°C. 1 kg wody ochładzając się o 1°C oddaje 4,2 kJ ciepła. Ile ciepła oddaje
woda w tym kaloryferze w ciągu doby? Zapisz obliczenia.
2. Do 2 kg wody o temperaturze 20 oC wlano 2 kg wody o temperaturze 40oC. Po wymieszaniu
temperatura końcowa wody wynosiła:
a) 20 oC,
b) 40 oC
c) 30 oC
d) 60 oC.
3. Jaka ilość ciepła jest potrzebna, aby doprowadzić do wrzenia 1 kg wody o temperaturze 10
oC? Ciepło właściwe wody wynosi 4200 J / kg oC.
4. O ile stopni ogrzeje się woda o masie 2 kg, jeżeli dostarczono jej 84 kJ ciepła?
5. Oblicz ciepło potrzebne do całkowitego zamarznięcia l kg wody o temp. 20 C.
cw= 4200 J/kgC,
ct = 340000 J/kg