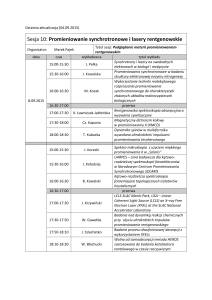
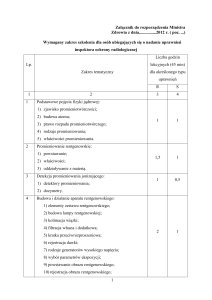
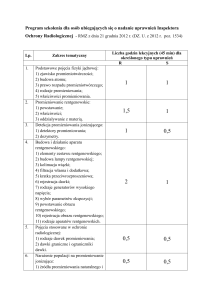
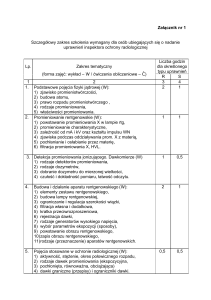
POSTĘPY BIOLOGII KOMÓRKI
TOM 42 2015 NR 3 (491–504)
DOZYMETRIA PROMIENIOWANIA JONIZUJĄCEGO
W BADANIACH CYTOGENETYCZNYCH
KOMÓREK LUDZKICH
IONIZING RADIATION DOSIMETRY IN HUMAN
CELLS CYTOGENETIC STUDIES
Tomasz MRÓZ, Andrzej KORNAŚ
Zakład Biologii Komórki i Genetyki, Wydział Geograficzno-Biologiczny,
Uniwersytet Pedagogiczny im. Komisji Edukacji Narodowej w Krakowie
Streszczenie: Wzrastające wykorzystanie technik jądrowych w przemyśle, technice czy służbie zdrowia
prowadzi do coraz większego zainteresowania nowymi technikami dozymetrycznymi. Można wśród
nich wyróżnić metody dozymetrii biologicznej, w których obliczenie dawki promieniowania jonizującego oparte jest o analizy cytogenetyczne. Zalicza się tu m.in. analizę częstości występowania chromosomów dicentrycznych, translokacji chromosomowych, badanie przedwczesnej kondensacji chromatyny
(ang. Premature Chromatin Condensation, PCC) czy też ocenę częstości występowania mikrojąder (ang.
Cytokinesis Block Micronucleus Assay, CBMN). Metody te różnią się zakresem dawek promieniowania jonizującego w jakich mogą być stosowane. Natomiast ich wspólne cechy to prowadzenie analiz na
limfocytach ludzkiej krwi obwodowej, ocena dawki promieniowania odbywa się na podstawie krzywej
wzorcowej opracowywanej przez każde laboratorium, to gwarantuje, reprezentatywność próbek. Metody
te są ciągle doskonalone i rozwijane, a także trwają poszukiwania nowych technik analitycznych jak na
przykład z wykorzystaniem histonu H2AX.
Słowa kluczowe: dozymetria biologiczna, promieniowanie jonizujące, uszkodzenia DNA
Summary: The usage of the nuclear techniques in industry, technology and medicine leads to the increase of interest in new dosimetry techniques. We can distinguish among them the biological dosimetry
methods, in which the assessment of the dose of ionizing radiation is based on cytogenetic analysis.
These techniques can be divided into analysis of the frequency of dicentric chromosome, chromosomal
translocations, study of premature chromatin condensation (PCC) or the evaluation of the frequency of
micronuclei presence in the cell (CBMN). These methods differ in scope doses of ionizing radiation that
may be used. However, their common features include analyzes of peripheral human blood lymphocytes
and the assessment of radiation dose is based on a standard curve developed by each laboratory. That
ensures that the samples are representative. These methods are constantly being improved and developed.
We also continue to seek new analytical techniques like those wich use the histone H2AX.
Key words: biological dosimetry, ionizing radiation, DNA damages
492
T. MRÓZ, A. KORNAŚ
WSTĘP
Promieniowanie jonizujące jako stale i nieprzerwanie oddziaływujący na
człowieka czynnik środowiska naturalnego, najczęściej kojarzone jest bądź to
z funkcjonowaniem instalacji przemysłu jądrowego, czy też wykorzystaniem militarnym. Ten popularny pogląd sprawia, iż promieniotwórczość wydaje się być
zjawiskiem odległym i dla wielu z nas dość zagadkowym. Jednakże z zastosowaniami zjawiska promieniotwórczości spotykamy się na co dzień, w takich dziedzinach życia jak ochrona zdrowia i diagnostyka medyczna [27], ochrona przeciwpożarowa, czy różne gałęzie przemysłu pozornie niezwiązane z wykorzystaniem
promieniowania jonizującego [34].
Ponieważ organizm człowieka nie posiada narządów zmysłów pozwalających
na detekcję promieniowania jonizującego, niezbędne okazało się opracowanie
technik pozwalających na oszacowanie dawek, jakie otrzymują osoby narażone
z racji wykonywanego zawodu, bądź przypadkowego z nim kontaktu. Dozymetria, jako gałąź fizyki jądrowej zajmująca się pomiarami dawek promieniowania
jonizującego, posługuje się trzema podstawowymi pojęciami:
• dawka pochłonięta – wyrażona jest ona w grejach [Gy]. Definiowana jest ona
jako ilość energii pochłoniętej przez jednostkę masy:
Ponieważ energię emitowanych cząstek lub kwantów promieniowania jonizującego
opisuje się w kiloelektronowoltach należy przeliczyć ją na energię w dżulach.
• dawka równoważna – jest to wielkość uwzględniająca nie tylko energię zdeponowaną w jednostce masy ale również rodzaj promieniowania. Obliczana jest
ona przez pomnożenie dawki pochłoniętej przez współczynnik wagowy promieniowania (WR). Wartości współczynnika WR wahają się w zakresie od 1 do 20
i zostały zawarte w tab. 1.
Jednostką dawki równoważnej jest siwert [Sv].
• dawka skuteczna – parametr uwzględniający oprócz rodzaju promieniowania
jonizującego także radiowrażliwość różnych tkanek i narządów. Wielkość ta obliczana jest jako iloczyn dawki równoważnej oraz współczynnika wagowego tkanki
(WT). Wartości współczynnika WT wahają się w zakresie od 0,01 dla skóry do 0,2
dla gonad. Wartości współczynnika wagowego tkanki podano w tab. 2. Jednostką
dawki skutecznej podobnie jak w przypadku dawki równoważnej jest siwert [Sv].
Do oszacowania powyżej zdefiniowanych wielkości można posłużyć się różnymi metodami. Najprostszą metodą obliczenia dawek promieniowania jest ich obliczenie na podstawie rodzaju źródła promieniotwórczego, jego aktywności oraz
czasu i odległości przebywania w zasięgu promieniowania przez to źródło wysy-
DOZYMETRIA PROMIENIOWANIA JONIZUJĄCEGO W BADANIACH...
493
łanego. Innym sposobem jest określenie otrzymanej dawki przy użyciu filmów radiochromowych lub dawkomierzy termoluminescencyjnych1. Wszystkie te metody
nie dają jednak bezpośredniego obrazu zmian, jakie powodować może promieniowanie jonizujące w organizmie człowieka. Taką możliwość oferują natomiast metody dozymetrii biologicznej.
TABLELA 1. Wartości współczynników wagowych promieniowania jonizującego [28]
TABLE 1. Values of Radiation Weighting Factors [28]
Rodzaj promieniowania
Współczynnik wagowy
fotony
1
elektrony, pozytony, miony
1
neutrony
protony
<10 keV
5
10-100 keV
10
100 keV-2MeV
20
2-20 MeV
10
>20 MeV
5
>2MeV
5
cząstki alfa, fragmenty rozszczepienia
20
TABELA 2. Wartości współczynników wagowych tkanki [28]
TABLE 2. Values of Tissue Weighting Factors [28]
narząd/tkanka
współczynnik wagowy
gonady
0,2
szpik kostny
0,12
jelito grube
0,12
płuca
0,12
żołądek
0,12
pęcherz moczowy
0,05
gruczoły piersiowe
0,05
wątroba
0,05
przełyk
0,05
tarczyca
0,05
skóra
0,01
kości (na powierzchni)
0,01
pozostałe
0,05
1
Dawkomierze termoluminescencyjne produkowane przez Instytut Fizyki Jądrowej PAN w Krakowie
biorą udział w eksperymencie MATROSHKA prowadzonym na pokładzie Międzynarodowej Stacji Kosmicznej, mającym na celu oszacowanie dawek jakie astronauci otrzymują podczas misji załogowych
494
T. MRÓZ, A. KORNAŚ
ODDZIAŁYWANIE PROMIENIOWANIA
JONIZUJĄCEGO NA KOMÓRKI
Działanie promieniowania jonizującego na komórki organizmów żywych można podzielić na dwa podstawowe typy [8]. Pierwszym z nich jest oddziaływanie
bezpośrednie charakterystyczne dla cząstek promieniowania jonizującego charakteryzujących się wysoką wartością LET (ang. Linear Energy Transfer) czyli ilością
energii przekazywanej przez cząstkę promieniowania do ośrodka w jakim się porusza (np. komórki, tkanki) na jednostkę długości toru ruchu cząstki np. keV∙μm-1. Ten
typ oddziaływania promieniowania jonizującego polega na bezpośredniej jonizacji
atomów tarczy (np. cząsteczki DNA) na skutek oddziaływań kulombowskich co
w konsekwencji prowadzić może do biologicznych uszkodzeń komórki takich jak:
• przerwanie pojedynczej nici DNA (ang. Single Strand Break, SSB),
• przerwanie dwóch nici DNA (ang. Double Strand Breaks, DSB),
• szkodzenia pojedynczych zasad,
• sunięcie zasady azotowej,
• łączenie się zasad azotowych na jednej nici DNA (ang. Intrastrand Cross-Links) [29].
Oddziaływanie na drodze pośredniej polega natomiast na jonizacji innych
atomów lub cząsteczek z wytworzeniem wolnych rodników. Oddziaływanie pośrednie jest procesem złożonym, na który składa się kilka etapów. W pierwszej
kolejności foton promieniowania gamma oddziaływuje z ośrodkiem na który pada
(zjawisko fotoelektryczne, efekt Comptona czy kreacja par), w wyniku czego
wyemitowany zostaje elektron o wysokiej energii [32]. Elektron poruszając się
w uwodnionej tkance powoduje powstanie w niej reaktywnych form tlenu (RTF)
[21]. Są to głównie wolne rodniki o charakterze tlenowym takie jak anionorodnik
ponadtlenkowy (O2∙-), wodoronadtlenkowy (HO2∙), hydroksylowy (∙OH) lub nadtlenek wodoru (H2O2) stanowiące produkty radiolizy wody. Proces ten przebiega
w sposób następujący: wstępna jonizacja cząsteczki wody powoduje wytworzenie
pary HOH+ + e-, następnie w czasie rzędu 10-6 sekundy dochodzi do reakcji jonów
z pozostałymi cząsteczkami wody z wytworzeniem jonorodników wody (H2O*)
dysocjujących do wolnych rodników. Część z nich następnie rekombinuje wg.
reakcji [29]:
DOZYMETRIA PROMIENIOWANIA JONIZUJĄCEGO W BADANIACH...
495
Ponieważ wolne rodniki posiadają niesparowany elektron na powłoce walencyjnej są cząsteczkami silnie reaktywnymi. Wskutek tego mogą one zrywać
wiązania fosfodiestrowe oraz wodorowe w cząstecze DNA. W celu minimalizacji
skutków wpływu wolnych rodników organizmy żywe wytworzyły szereg mechanizmów enzymatycznych takich jak dysmutazy ponadtlenkowe (SOD), katalazy
(CAT) czy peroksydaza glutiationowa (GPX). Do czynników nieenzymatycznych
można zaliczyć jony metali przejściowych (np. jony Zn2+ konkurują z jonami Fe3+
oraz Cu2+ w wiązaniu przez związki chelatujące, uniemożliwiając zajście reakcji Fentona), kwas askorbinowy, retinol, neopteryna, karnozyna, melaniny lub α-tokoferol.
Ponadto stwierdzono właściwości antyoksydacyjne żeńskich hormonów płciowych (estronu oraz estradiolu) [3, 21]. Oddziaływanie RTF pociągające za sobą
zmianę struktury chemicznej ważnych biologicznie cząsteczek skutkuje dokładnie zdefiniowanymi efektami biologicznymi. Opracowany przez Międzynarodową Agencję Energii Atomowej (ang. International Atomic Energy Agency, IAEA)
podręcznik „Radiation Oncology Physics” podaje możliwe skutki, jakie może za
sobą nieść napromieniowanie żywych komórek:
• brak widocznych efektów,
• opóźnienie podziału komórkowego,
• apoptoza,
• mutacje – mogą prowadzić do ujawnienia się nowych cech fenotypowych lub
kancerogenezy,
• zwiększenie odporności na dalsze dawki napromieniowania [32].
W skali całego organizmu skutki oddziaływania promieniowania jonizującego można podzielić na deterministyczne oraz stochastyczne (przypadkowe) [24].
Skutki deterministyczne manifestują się po przekroczeniu pewnej progowej dawki promieniowania jonizującego, stanowią przejściowe lub trwałe uszkodzenia
tkanek. Duża zmienność osobnicza sprawia, że w przypadku skutków deterministycznych bardzo ciężko jest jednoznacznie oszacować dawkę progową ich wystąpienia oraz zależność efektu od dawki. Do skutków deterministycznych można zaliczyć rumień, zaćmę lub bezpłodność. Skutki stochastyczne różnią się od
deterministycznych brakiem progowej wartości dawki warunkującej ich wystąpienie [12, 38]. Stochastyczne skutki promieniowania mają charakter probabilistyczny, mogą występować wiele lat po ekspozycji na promieniowanie. Przyjmuje
się, że wysokie dawki promieniowania (~1Gy) powodują głównie wystąpienie
objawów deterministycznych, natomiast niskie objawiają się skutkami stochastycznymi [27]. Przykłady występowania obydwu rodzajów efektów, obserwowano podczas uwolnienia radionuklidów w wyniku awarii w elektrowni jądrowej
w Fukushimie. W przypadku wchłonięcia izotopu 131I emitującego promieniowanie β- skutki deterministyczne obejmowały depresję szpiku kostnego (1-10 Gy),
496
T. MRÓZ, A. KORNAŚ
niedoczynność tarczycy (10-100 Gy) oraz ablację tarczycy (100-1000 Gy). Skutki
stochastyczne obserwowano przy narażeniu rzędu 10-100 mSv. Oszacowano, że
dawka 100 mSv spowoduje u dzieci narażonych na wchłonięcie promieniotwórczego jodu skutek stochastyczny w postaci zwiększenia ryzyka zachorowania na
nowotwory tarczycy o 0,3% [16].
WYBRANE METODY CYTOGENETYCZNEJ OCENY DAWEK
PROMIENIOWANIA JONIZUJĄCEGO
Wśród podstawowych metod oceny dawek promieniowania jonizującego
z wykorzystaniem technik cytogenetycznych można m. in. wyróżnić analizę:
• chromosomów dicentrycznych,
• translokacji,
• przedwczesnej kondensacji chromatyny,
• test mikrojądrowy.
Wyżej wymienione testy wykonywane są na limfocytach krwi obwodowej [4,
10]. Czynnikami przemawiającymi za wyborem właśnie tego typu komórek są
przede wszystkim:
• łatwość hodowli z wykorzystaniem komercyjnie produkowanych mediów
hodowlanych,
• możliwość pobudzenia do licznych podziałów mitotycznych z wykorzystaniem fitohemaglutyniny (PHA),
• ze względu na migrację do innych tkanek i narządów we krwi obwodowej
obecne są także komórki, które noszą ślady uszkodzeń DNA, powstałe w wyniku
napromieniowania dowolnego miejsca w organizmie człowieka,
• pobranie krwi jest zabiegiem małoinwazyjnym i prostym. Ma to znaczenie
w przypadku konieczności pobrania dużej liczby próbek w krótkim czasie (np.
wypadek jądrowy, atak terrorystyczny z użyciem tzw. brudnej bomby),
• zmiany cytogenetyczne są uniwersalnym markerem wpływu wielu czynników
środowiskowych [20].
TEST CHROMOSOMÓW DICENTRYCZNYCH
Jest to najbardziej rozpowszechniony test pozwalający na oszacowanie dawek
w zakresie od 0,2 do około 5 Gy [9, 11, 19]. Górną granicą zastosowania tej metody jest dawka promieniowania, po otrzymaniu której limfocyty będą zdolne do
DOZYMETRIA PROMIENIOWANIA JONIZUJĄCEGO W BADANIACH...
497
indukowanego podziału komórkowego. Metoda ta polega na zliczeniu częstości
występowania chromosomów dicentrycznych powstających w wyniku napromieniowania żywych komórek [13]. Do oceny otrzymanej dawki promieniowania jonizującego służą krzywe wzorcowe wykonywane w laboratoriach radiobiologicznych. Sporządzenie takiej krzywej polega na naświetlaniu próbek krwi znanymi
dawkami promieniowania np. przy zastosowaniu źródła 60Co. W czasie naświetlania, próbki umieszcza się w wodzie o temperaturze 37°C. W tak naświetlonych
próbkach zlicza się następnie liczbę aberracji chromosomowych, odpowiadających określonej dawce i na tej podstawie wykreśla się krzywą przedstawiającą zależność liczby powstających chromosomów dicentrycznych do otrzymanej dawki
promieniowania jonizującego. W przypadku bardzo wysokich dawek promieniowania oprócz chromosomów dicentrycznych może również dojść do powstawania
struktur tricentrycznych lub nawet kwadricentrycznych [1, 5, 6].
Hodowlę limfocytów prowadzi się w komercyjnie dostępnych mediach z dodatkiem L-glutaminianu, heparyny oraz antybiotyków (najczęściej penicyliny
lub streptomycyny). Do założenia hodowli limfocytów można zastosować dwa
rodzaje inoculum. W pierwszym przypadku stosuje się krew bezpośrednio po
pobraniu. Ten rodzaj inoculum pozwala na zmniejszenie ilości pobieranej krwi
(1-2 ml), jednak skutkuje mniejszą ilością jąder metafazowych w otrzymanym
obrazie mikroskopowym. Istotną zaletą jest również szybkość otrzymania dużej
liczby komórek. Drugą możliwością jest wykonanie inoculum wzbogaconego np.
metodą wirowania w gradiencie fikolu. Kultury limfocytów znajdujące się w fazie G0 cyklu komórkowego stymuluje się do podziałów poprzez dodanie do inoculum fitochemaglutyniny (PHA). Inkubacje prowadzi się zazwyczaj około 48
godz.. W celu zahamowania podziałów do hodowli dodaje się roztwór kolchicyny
lub Colcemidu w soli fizjologicznej. Po zakończeniu procesu inkubacji izoluje
się limfocyty z medium hodowlanego. Preparaty następnie przygotowuje się do
obserwacji mikroskopowych poprzez barwienie Giemsą lub barwnikami fluorescencyjnymi z Giemsą [1, 5, 6]. Obserwacje prowadzi się tradycyjnymi metodami
mikroskopowymi, które jednak często wypierane są przez automatyczne systemy
detekcji jąder metafazowych. Metoda ta znalazła szerokie zastosowanie na świecie z uwagi na dużą powtarzalność wyników, a także bardzo niski poziom spontanicznego powstawania w organizmie ludzkim chromosomów dicentrycznych,
bez ekspozycji na działanie promieniowania jonizującego. Do głównych wad tej
metody należy zaliczyć dużą pracochłonność oraz konieczność posiadania dużego doświadczenia przez osobę przeprowadzającą daną analizę [35]. Ponadto ze
względu na niestabilność badanych aberracji [18], wykorzystanie tej metody do
oddalonej w czasie retrospektywnej oceny dawek promieniowania jonizującego
może być bardzo utrudnione.
498
T. MRÓZ, A. KORNAŚ
ANALIZA TRANSLOKACJI
Ponieważ powstawanie chromosomów dicentrycznych jest aberracją nietrwałą (prowadzącą do śmierci mitotycznej komórki, przez co liczba tego typu aberracji
w populacji dzielących się komórek spada w czasie [18]), ważne jest jak najszybsze
pobranie próbek krwi do analizy. Zastosowanie w celu oszacowania dawek promieniowania jonizującego stabilnych translokacji chromosomowych (np. zrównoważonych i wzajemnych, które w przypadku braku zmian w morfologii chromosomów nie
powodują zaburzeń podziału komórkowego [2, 18]) pozwala uniknąć trudności jakie
można napotkać przy retrospektywnej ocenie dawek. W praktyce metoda ta polega na
przeprowadzeniu kariotypowania [6] z wykorzystaniem metody fluorescencyjnej hybrydyzacji in situ (ang. Fluorescence In Situ Hybridization, FISH). Metoda ta polega
na wykorzystaniu fluorescencyjnych sond DNA wiążących się do określonych miejsc
chromosomu. Metoda FISH [1] znalazła zastosowanie w wielu badaniach z zakresu
medycyny oraz cytogenetyki, dzięki czemu staje się ona coraz popularniejszą techniką w wielu laboratoriach. Szczególnie przydatną odmianą metody FISH jest wielokolorowa metoda FISH (ang. multicolorFISH, mFISH) [5] [6]. Dzięki użyciu sond DNA
wyznakowanych różnymi fluorochromami można określać różne miejsca na chromosomach przy pomocy wielu barw. Obserwację tak wyznakowanych chromosomów
prowadzi się pod mikroskopem fluorescencyjnym. Zastosowanie barwienia mFISH
może jednak prowadzić do pewnej istotnej trudności w interpretacji wyników barwienia, bowiem różnice w odcieniach poszczególnych kolorów mogą być niewidoczne
dla przeprowadzającego analizę. Trudność ta jest obecnie eliminowana poprzez wprowadzenie cyfrowej analizy obrazu komputerowego. Analiza taka polega na konwersji
kolorów z przestrzeni RGB na pseudokolory lub kolory fałszywe [31].
Procedura poboru próbki krwi i prowadzenia hodowli limfocytów jest w tym
przypadku podobna do stosowanej przy analizie chromosomów dicentrycznych. O ile
translokacje są aberracjami stabilnymi (oznacza to, że dojrzewające w śledzionie
i szpiku limfocyty będą posiadały taką samą liczbę translokacji, co zastępowane przez
nie limfocyty krwi obwodowej [32]), zaleca się jednak, aby analizę prowadzić w metafazie pierwszego podziału komórkowego, ponieważ utrata aberracji niestabilnych
w kolejnych podziałach mitotycznych może skutkować zakłóceniem częstości występowania translokacji. Po dokonaniu statystycznej obróbki danych, dawkę oblicza
się na podstawie wykonanej wcześniej krzywej wzorcowej, podobnie jak w przypadku analizy dicentryków. Metody obróbki statystycznej danych dla barwienia FISH/
mFISH zostały dokładnie przedstawione w publikacjach IAEA [5, 6].
Metoda analizy translokacji chromosomowych posiada wiele zalet. Opiera się
na analizie limfocytów krwi obwodowej oraz pozwala na analizę retrospektywną
w większym przedziale czasu niż test chromosomów dicentrycznych. Do wad tej
metody należy zaliczyć pracochłonność oraz duże koszty związane z barwieniem
metodą FISH/mFISH.
DOZYMETRIA PROMIENIOWANIA JONIZUJĄCEGO W BADANIACH...
499
ANALIZA PRZEDWCZESNEJ KONDENSACJI CHROMATYNY
Do oceny dawek promieniowania jonizującego z wykorzystaniem chromosomów dicentrycznych, lub translokacji materiałem do analizy są chromosomy metafazowe z pobudzonych do podziału limfocytów krwi obwodowej. Jednakże, kiedy
dochodzi do napromieniowania dużymi dawkami mamy do czynienia z szeregiem
trudności, które mogłyby uniemożliwiać ocenę dawki standardowymi metodami dozymetrii biologicznej. Do głównych czynników można zaliczyć tu zmiany
w obrazie krwi, wśród których występuje limfopenia, duża indukcja chromosomów
dicentrycznych utrudniająca dokładne oszacowanie dawki, a także spadek indeksu
mitotycznego w napromieniowanych komórkach [5] [6]. W przypadku incydentu w zakładach przeróbki paliwa jądrowego w Tokaimura [14] część z personelu
otrzymała dawki promieniowania gamma oraz neutronowego sięgające w skrajnych
przypadkach 16-25 Gy [17]. W tym przypadku konieczne okazało się zastosowanie techniki analizy przedwczesnej kondensacji chromatyny (ang. Premature
Chromatine Condensation, PCC) [22]. Metoda PCC której skuteczność została
wykazana w zakresie dawek 5-25 Gy wykorzystywana jest obecnie w dozymetrii
biologicznej wysokich dawek promieniowania. Procedura przygotowania materiału
badawczego przebiega podobnie jak w opisanych wyżej metodach biodozymetrycznych. Inoculum z limfocytami przenosi się na medium hodowlane, gdzie kultura
podlega inkubacji. Po upływie doby dodaje się do prowadzonej kultury kolchicynę
w celu zatrzymania podziałów komórkowych. Następnie na godzinę przed zakończeniem inkubacji wprowadza się do hodowli czynnik chemiczny indukujący kondensację chromatyny, powszechnie stosowanymi do tego celu substancjami są kwas
oka jadowy lub kalikulina A. Następnie preparaty barwi się Giemsą, fluorescencją
z Giemsą (ang. Fluorescence Plus Giemsa, FPG) lub metodą FISH. Dobór sposobu
barwienia zależy od poszukiwanej aberracji. W celu poszukiwania chromosomów
kolistych (ang. Ring-PCC R-PCC) u poszkodowanych w wypadku w Tokaimura
stosowano barwienie Giemsą. W celu poszukiwania translokacji bądź chromosomów dicentrycznych można zastosować barwienie metodą FISH.
TEST MIKROJĄDER
W wyniku oddziaływania promieniowania jonizującego na komórki, dochodzić
może do zaburzeń segregacji chromatyd siostrzanych podczas anafazy podziału mitotycznego. Przyczyną może być na przykład powstanie acentrycznego fragmentu
do którego nie może przyłączyć się wrzeciono kariokinetyczne. Na skutek tego,
struktury które nie uległy segregacji do komórek potomnych pozostają w komórce macierzystej i tworzą mikrojądra. Test mikrojąder różni się od wymienionych
wcześniej scharakteryzowanych metod dozymetrii tym, że nie uwzględnia on bez-
500
T. MRÓZ, A. KORNAŚ
pośrednio aberracji chromosomowych. W przeciwieństwie do testu chromosomów
dicentrycznych, częstość występowania spontanicznie utworzonych mikrojąder jest
wyższa, jednakże na poziomie dokładności pozwalającym stosować tą metodę [33].
Co więcej, mikrojądra powstałe spontanicznie często charakteryzują się obecnością
centromeru, co można stwierdzić stosując barwienie metodą FISH [30].
Prowadzenie kultury wyizolowanej z krwi obwodowej limfocytów jest bardzo
zbliżone do uprzednio opisanych metod. Głównymi różnicami jest brak stosowania
Colcemidu bądź kolchicyny, natomiast zwykle po 24 godz. do kultury limfocytów
wprowadza się cytochalazynę B (Cyt-B). Zastosowanie tej mykotoksyny pozwala uzyskać komórki dwujądrzaste poprzez zahamowanie polimeryzacji mikrotubul
[23, 25, 36]. W celu wykrycia ewentualnej obecności centromerów, świadczących
o spontanicznym wytworzeniu mikrojądra, bez udziału czynnika cytotoksycznego stosuje się barwienie Giemsą oraz metodę FISH. Ponieważ metoda ta w dużej
mierze związana jest z zahamowaniem procesu cytokinezy, jej angielska nazwa
brzmi Cytokinesis Block Micronucleus Assay (CBMN). Podobnie jak w przypadku poprzednich metod, końcowe oszacowanie dawki promieniowania jonizującego
prowadzi się w oparciu o przygotowane wcześniej krzywe wzorcowe. Istotną zaletą metody CBMN jest jej prostota. Nie wymaga ona tak dużego doświadczenia
w interpretacji obrazu mikroskopowego, jak na przykład analiza chromosomów dicentrycznych. Co więcej, niektórzy autorzy sugerują możliwość przeprowadzenia
barwienia mikrojąder metodą Feulgena. Z racji swojej prostoty, metoda ta jest obecnie szeroko optymalizowana pod kątem zastosowania w niej automatycznych systemów pomiarowych opartych na analizie otrzymanego obrazu komputerowego [7].
ANALIZA OGNISK HISTONU H2AX
Jest to jedna z najnowszych metod immunocytochemicznych wykorzystywana
do oceny dawki promieniowania jonizującego. Oparta jest na wykorzystaniu białka
histonowego typu H2AX, stanowiącego około 10% całości histonów H2A. Białko
to posiada C-terminalny koniec, na którym znajduje się seryna [38]. W przypadku
narażenia na promieniowanie jonizujące i powstania uszkodzenia DNA typu DSB,
histony H2AX otaczające DSB zostają ufosforylowane do formy γ-H2AX [26, 37].
Fosforylacja C-terminalnej seryny przez PI-3 kinazę jest konieczna, aby możliwa
była naprawa DNA na drodze scalania niehomologicznych końców DNA [37]. Tak
zmodyfikowane białka histonowe można wybarwić metodami immunofluorescencyjnymi za pomocą specyficznych przeciwciał. Wizualizację przeprowadza się poprzez zastosowanie drugorzędowych przeciwciał wyznakowanych izotiocyjanianem fluoresceiny [39, 40]. Na tej podstawie, z wykorzystaniem krzywej wzorcowej
można ocenić dawkę promieniowania jonizującego.
DOZYMETRIA PROMIENIOWANIA JONIZUJĄCEGO W BADANIACH...
501
PODSUMOWANIE
Metody oceny dawek promieniowania jonizującego oparte na technikach cytogenetycznych znalazły szerokie zastosowanie. Ich niewątpliwą zaletą jest fakt,
iż oceny dawki dokonuje się na podstawie rzeczywistych zmian w makrostrukturze materiału genetycznego, co pozwala na szybsze przewidywanie ewentualnych
skutków biologicznych ekspozycji na daną dawkę promieniowania. Dalszy rozwój tych szeroko stosowanych metod dozymetrycznych polega głównie na wprowadzaniu i doskonaleniu automatycznych systemów przygotowania próbek [14]
oraz analizy uzyskanych obrazów. Dzięki temu, możliwa będzie eliminacja źródła
błędu w oszacowaniu dawki, wynikającego na przykład z braku doświadczenia
osoby przeprowadzającej daną analizę. W dalszej kolejności automatyzacja procesu analizy obrazu mikroskopowego pozwoli na zwiększenie szybkości oceny
dawki, może to być niezwykle ważne w różnych przypadkach masowego narażenia ludności na napromieniowane. Istotnym Procedury dla poszczególnych metod
są do siebie podobne, dzięki czemu jedno laboratorium może przeprowadzać analizy kilkoma uzupełniającymi się metodami (na przykład analiza chromosomów
dicentrycznych oraz PCC). Oprócz doskonalenia metod już wykorzystywanych
[15] prowadzi się poszukiwania nowych technik dozymetrii biologicznej, jedną
z nich jest analiza struktury histonu H2AX.
PODZIĘKOWANIA
Artykuł finansowany z Środkió Instytutu Biologii UP Kraków
LITERATURA
[1]
Bhavani M, Tamizh Selvan G. Harpeet K. Adhikari JS, Vijayalakshmi J, Venkatachalam P, ChaudhuNK. Dicentric chromosome aberration analysis using giemsa and centromere specific fluorescence
in situ hybridization for biological dosimetry: An inter- and intra-laboratory comparison in Indian
laboratories. Applied Radiation and Isotopes 2014; 92: 85-90.
Bala J. Badania molekularne i cytogenetyczne w medycynie. 1998; Springer PWN, Warszawa.
Bartosz G. Druga twarz tlenu. Wolne rodniki w przyrodzie. 2003; PWN Warszawa.
Cavalcanti MB, Fernandes TS, Amaral A, Melo JA, Neves MAB, Machado CGF. Study of p53
protein expression levels from irradiated peripheral blood lymphocytes for dosimetry. RADIO 2005
Conference, 2005.
Cytogenetic analysis for radiation dose assessement – a manual. 2001; International Atomic Energy
Agency – Vienna.
Cytogenic dosimetry: applications in preparedness for and response to radiation emergencies. 2011;
International Atomic Energy Agency, Vienna.
ry
[2]
[3]
[4]
[5]
[6]
502
[7]
[8]
[9]
[10]
[11]
[12]
[13]
[14]
[15]
[16]
[17]
[18]
[19]
[20]
[21]
[22]
[23]
[24]
[25]
[26]
T. MRÓZ, A. KORNAŚ
Decordier I, Papine A, Plas G, Roesems S, Loock KV, Moreno-Palormo J, Cemeli E, Anderson
D, Fucic A, Marcos R, Soussaline F, Kirsch-Volders M. Automated image analysis of cytokinesis-blocked micronuclei: an adapted protocol and a validated scoring procedure for biomonitoring. Mutagenesis 2009; 24: 85-93.
Desoucky O, Ding N, Zhou G. Targeted and non-targeted effects of ionizing radiation. Journal of
Radiation Research and Applied Sciences 2015; 30: 1-8
Effectts of ionizing radiation on blood and blood components: A survey. 1997; International Atomic
Energy Agency – Vienna.
Giovanetti A, Sgura A, Aversa G. Biological dosimetry. How to measure the absorbed dose in different scenarios. Italian national agency for new technologies, energy and sustainable economic development 2012. Rome.
Gonzales JA, Guimaraes MIC, da Silva MA, Okazaki K, Yoriyaz H, Bartolini P, Buchpiguel CA.
Dosimetry for patients with differentiated thyroid cancer in therapy with 131I (NaI) preceded by rechTSH and estabilished of a correlation between absorbed dose and cytogenetic effects of radiation
in humans. IX Latin American IRPA Regional Congress on Radiation Protection and Safety – IRPA
2013, Rio de Janeiro.
Gori T, Münzel T. Biological effects of low-dose radiation: of harm and hormesis. European Heart
Journal 2012; 33: 292-295.
Haber JE, Thorburn PC, Rogers D. Meiotic and mitotic behavior of dicentric chromosomes in Saccharomyces cerevisiae. Genetics 1984; 106: 185-205
Hayata I, Kanda R, Minamihisamatsu M, Furukawa A, Sasaki MS. Cytogenetical dose estimation for
3 severly expose patients in the JCO criticality accident in Tokai-mura. Journal of Radiation Research
2001; 42: 149-155.
Hayata I, Tabuchi H. Furukawa A, Okabe N, Yamamoto M, Sato K. Robot system for preparing lymphocyte chromosome. Journal of Radiation Research 1992; 33: 231-241.
von Hippel FN. The radiological and psychological consequences of the Fukushima Daiichi accident.
Bulletin of the Atomic Scientist 2011; 67: 27-36
Igaki H, Nakagawa K, Uozaki H, Akahane M, Hosoi Y, Fukayama M, Miyagawa K, Akashi M, Ohtomo K, Maekawa K. Pathological changes in the gastrointestinal tract of a heavily radiation-exposed
worker at the Tokai-mura critically accident. Journal of Radiation Research 2008; 49: 55-62.
Janiak M, Wójcik A. Medycyna zagrożeń i urazów radiacyjnych; 2005, PZWL Warszawa.
Kanda R. Improvement of accurancy of chromosome aberration analysis for biological radiation dosimetry. Journal of Radiation Research 2000; 41: 1-8.
Kapka-Skrzypczak L, Cyranka M, Kruszewski M, Turski WA. Środki ochrony roślin a zdrowie rolników – biomarkery oraz możliwości ich wykorzystania do oceny ekspozycji na pestycydy. Medycyna
Ogólna i Nauki o Zdrowiu 2011; 17: 28-32.
Kulbacka J, Saczko J, Chwiłkowska A. Stres oksydacyjny w procesach uszkodzenia komórek. Polski
Merkuriusz Lekarski 2009; 157: 44-47.
Lamadrid AI, Garcia O, Delbos M, Voisin P, Roy L. PCC-ring induction in human lymphocytes exposed to gamma and neutron irradiation. Journal of Radiation Research 2007; 48: 1-6.
Lindholm C, Norppa H, Hayashi M, Sorsa M. Induction of micronuclei and anaphase aberrations by
cytochalasin B in human lymphocyte cultures. Mutation Research 1991; 260: 369-375.
Martin CJ, Sutton DG. Practical radiation protection in health care – second edition. Oxford University
Press 2015.
Ocampo IZ, Okazaki K, Vieira DP. An improved in vitro micronucleus assay to biological dosimetry.
2013; International Nuclear Atlantic Conference INAC-2013.
Pope IA, Barber PR, Horn S, Ainsbury E, Rothkamm K, Vojnovic B. A portable microfluoric fluorescence spectrometer device for γ-H2AX-based biological dosimetry. Radiation Measurement 2011;
46: 907-911.
DOZYMETRIA PROMIENIOWANIA JONIZUJĄCEGO W BADANIACH...
503
[27] Radiation Biology: A handbook for teachers and students. 2010; International Atomic Energy Agency
– Vienna.
[28] Recommendations of the International Commission on Radiological Protection. ICRP Publication
60 1990.
[29] Seńczuk W. Toksykologia. Podręcznik dla studentów farmacji 1994. Wydawnictwo Lekarskie PZWL,
Warszawa.
[30] Sommer S, Wojewódzka M, Buraczewska I, Kobiałko G, Pontek J, Szumiel I, Wójcik A. Malowanie
chromosomów i przedwczesna kondensacja chromatyny-nowe metody dozymetrii biologicznej. Raporty IChTJ 2002: 333-340.
[31] Strzelecki M. Metody przetwarzania i analizy obrazów biomedycznych. Wykład, Politechnika Łódzka,
Instytut Elektroniki.
[32] Suntharalingam N, Podgorask EB, Hendry JH. Radiation oncology physics: a handbook for teachers
and students; chapter 14: basic radiobiology. 2005; International Atomic Energy Agency – Vienna.
[33] Tucker JD, Vadapalli M, Joiner MC, Ceppi M, Fenech M, Bonassi S. Estimating the lowest detectable dose of ionizing radiation by the Cytokinesis-Block Micronucleus Assay. Radiation Research
2013; 180: 284-291.
[34] van Riper KA, Mashnik SG, Wilson WB. A computer study of radionuclide production in high power
accelerators for medical and industrial applications. Nuclear Instruments and Methods in Physics
Research Section A: Accelerators, Spectrometers, Detectors and Associated Equipment 2001; 463:
576-585.
[35] Vaurijoux A, Gruel G, Gregoire E, Roch-Lefevre S, Voisin P, Martin C, Voisin P, Roy L, Barquinero JF. Automatic dicentric scoring a real option to be used in biological dosimetry. Radiation Emergency Medicine 2015; 4: 16-21.
[36] Wojewódzka M. Indukcja odpowiedzi adaptacyjnej i naprawa w napromienionych ludzkich limfocytach krwi obwodowej. Raporty Instytutu Chemii i Techniki Jądrowej 1996.
[37] Woolf DK, Wiliams NR, Bakshi R, Madani S, Fawcitt S, Eaton D, Pigott K, Short S, Keshtgar M.
Biological dosimetry with γ-H2AX foci using radiation therapy for breast cancer as a model. International Journal of Radiation Oncology Biology Physics 2014; 90: 230.
[38] WHO Health risk assessment from the nuclear accident after the 2011 Great East Japan Earthquake
and Tsunami based on preliminary dose estimation. World Health Organization 2013. Geneva. ISBN
978 92 4 150513 0.
[39] Yoshida K, Yoshida SH, Shimoda C, Morita T. Expression and radiation induced phosphorylation of
histone H2AX in mammalian cells. Journal of Radiation Research 2003; 44: 47-51.
[40] Zwicker F, Swartman B, Sterzing F, Major G, Weber KJ, Huber PE, Theike C, Debus J, Herfrath
K. Biological in-vivo measurements of dose distribution in patients lymphocytes by hamma-H2AX immunofluorescence staining: 3D conformal vs. step-and-shoot IMRT of the prostate gland. Radiation
Oncology 2011; 62-70.
Redaktor prowadzący – Michał Nowicki
Otrzymano: 21.03.2015
Przyjęto: 13.04.2015
Tomasz Mróz
Marcinkowice 338
33-393 Marcinkowice
tel.: 886 630 466
e-mail: [email protected]