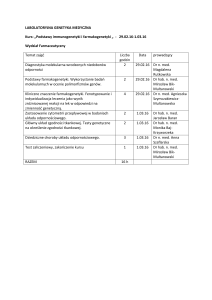
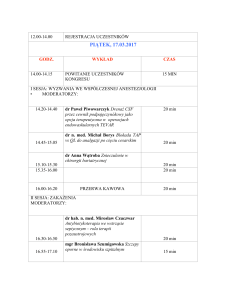
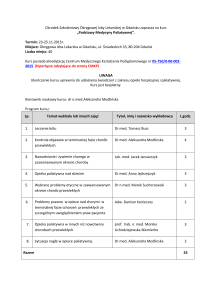
Domowe leczenie tlenem (DLT) w opiece paliatywnej.
profesor dr hab. med. Paweł Śliwiński
Przewlekła niewydolność oddychania (hipoksemiczna lub hiperkapniczna) może
wystąpić w przebiegu każdej przewlekłej choroby układu oddechowego, a także z wielu
innych przyczyn (Tabela 1).
Tabela 1. Najczęstsze przyczyny przewlekłej niewydolności oddychania
1. choroby przebiegające z obturacją oskrzeli
2. choroby śródmiąższowe płuc
3. deformacje klatki piersiowej
4. otyłość
5. choroby układu nerwowego i mięśni
6. choroby serca i naczyń
7. nowotwory układu oddechowego
Bezwzględnym wskazaniem do rozpoczęcia przewlekłego leczenia tlenem jest stałe
obniżenie się ciśnienia parcjalnego tlenu we krwi tętniczej (PaO2) <60 mmHg, co odpowiada
zmniejszeniu wysycenia oksyhemoglobiny tlenem (SaO2) <90%, mierzone w stabilnym stanie
chorego przy optymalnym wykorzystaniu leczenia farmakologicznego. Z tego względu przed
rozpoczęciem tlenoterapii konieczne jest wykonanie badania gazów krwi tętniczej. Na
podstawie jego wyników ustala się potrzebę i zasady podawania tlenu. U chorego z
hipoksemią bez hiperkapnii należy tak dobrać wielkość przepływu tlenu aby uzyskać
poprawę PaO2 powyżej 60 mmHg lub SaO2 powyżej 90%. Uzyskanie i utrzymanie
utlenowania organizmu na co najmniej takim poziomie zapewnia prawidłową czynność
wszystkich istotnych dla życia narządów. Szczególną ostrożność w leczeniu tlenem należy
zachować u chorych z hiperkapnią, zwłaszcza przy wartościach ciśnienia parcjalnego
dwutlenku węgla we krwi tętniczej (PaCO2) powyżej 55 mmHg. U takiego chorego podanie
nawet niewielkich ilości tlenu może spowodować znaczną retencję CO 2, a nawet śpiączkę
hiperkapniczną. Narastająca w wyniku prowadzonej tlenoterapii hiperkapnia może być
przyczyną, dla której podwyższenie PaO2 do 60 mmHg będzie niemożliwe. Wówczas należy
zaakceptować niższe wartości PaO2 (nawet około 50 mmHg), przy których groźba nasilania
się hiperkapnii jest niewielka.
Do DLT kwalifikują się chorzy, u których w okresie wyrównania choroby i przy
optymalnym wykorzystaniu leczenia farmakologicznego utrzymuje się znaczna hipoksemia.
Kryteria kwalifikacji do DLT:
1
1.
PaO2 55 mmHg
2.
PaO2 = 56-60 mmHg, jeśli obecny jest jeden z następujących objawów:
radiologiczne cechy nadciśnienia płucnego,
ultrasonograficzne cechy nadciśnienia płucnego,
cechy przerostu prawej komory serca w EKG,
poliglobulia (Ht > 55%).
POChP jest jedyną przewlekłą chorobą płuc, w której potwierdzono korzystne efekty
DLT: stabilizację nadciśnienia płucnego (1), redukcję poliglobulii, poprawę tolerancji wysiłku,
parametrów mechaniki oddychania, stanu emocjonalnego oraz wydłużenie życia (2,3). Te
korzystne efekty ujawniają się, jeśli chory oddycha tlenem przez co najmniej 15 godzin na
dobę. Dlatego też należy chorego stale zachęcać do oddychania tlenem jak najdłużej w
ciągu doby, w tym koniecznie przez całą noc. W nocy hipoksemia może się znacznie
pogłębiać (4). Stwierdzono, że znaczne spadki utlenowania krwi w czasie snu są przyczyną
licznych zaburzeń rytmu serca, które mogą być niebezpieczne dla życia (5). Podobnie
znaczne spadki utlenowania obserwuje się podczas wysiłku, a nawet w czasie wykonywania
codziennych czynności życiowych. Wykazano, że u ciężko chorych wykonywanie
podstawowych czynności jest przyczyną desaturacji, nawet gdy oddychają tlenem przy
przepływie zapewniającym dobre utlenowanie w spoczynku (6).
W związku z tym w okresie aktywności fizycznej chorego i podczas snu zaleca się
zwiększanie przepływu tlenu o 1 L/min. w stosunku do przepływu ustalonego w spoczynku.
Udowodniono, że okresowe zwiększenie przepływu tlenu o 1L/min. nawet u chorych ze
znaczną hiperkapnią, ale będących w stabilnym okresie choroby nie powoduje istotnej
retencji CO2 (7).
W
Polsce
podstawowym
źródłem
tlenu
wykorzystywanym
do
prowadzenia
przewlekłego leczenia tlenem jest koncentrator tlenu. Jest to jednak system stacjonarny,
który ogranicza oddychanie tlenem podczas wysiłków fizycznych do obszaru mieszkania
chorego. Z tego powodu chorzy, którzy chcą korzystać z tlenoterapii poza domem (spacer,
zakupy itp.) aby unikać desaturacji wysiłkowej powinni być zaopatrywani w przenośne źródła
tlenu (pojemnik z tlenenem ciekłym, przenośny koncentrator). Wykazano, że oddychanie
tlenem podczas wysiłku może poprawić tolerancję wysiłku i/lub złagodzić poziom duszności
odczuwanej na szczycie wysiłku (8,9). Efekty te obserwowano u chorych z i bez hipoksemii
spoczynkowej. Aktualnie nie ma jednak badań na reprezentatywnej populacji chorych
potwierdzających korzyści ze stosowania przenośnych źródeł tlenu tylko podczas wysiłku.
Jak wspomniano opisane powyżej korzyści płynące ze stosowania przewlekłej
tlenoterapii i zasady jej stosowania pochodzą w ogromnej większości z wyników badań
prowadzonych u chorych na przewlekłą obturacyjną chorobę płuc (POChP). Ponieważ
2
leczenie tlenem przynosi ewidentne korzyści kliniczne i rokownicze u znacznej większości
chorych na POChP trudno je nazwać leczeniem paliatywnym. Wydaje się, że dopiero u
chorych ze skrajnie ciężką postacią choroby, z wartościami FEV1 poniżej 10-15% wartości
należnej DLT ma charakter wyłącznie paliatywny. W innych niż POChP schorzeniach płuc
prowadzących do niewydolności oddychania leczenie tlenem nie wpływa na zmianę
rokowania. W tych przypadkach (np. włóknienie płuc, rak płuca) tlenoterapia ma jedynie
łagodzić objawy choroby i powinna być ordynowana wg zasad opisanych dla chorych na
POChP.
Wykazano, że zmniejszenie wentylacji minutowej i/lub gęstości powietrza, którym
pacjent oddycha może wpływać na złagodzenie duszności, poprawę tolerancji wysiłku oraz
poprawę jakości życia (10). Hipoksja jako taka nie prowadzi do pojawienia się uczucia
duszności, ale wyzwala duszność poprzez stymulowanie wentylacji minutowej. Podawanie
tlenu zmniejsza duszność i może poprawiać wydolność wysiłkową u chorych z hipoksemią
poprzez różne mechanizmy: zmniejszenie stymulacji kłębków zatoki szyjnej przez hipoksję,
rozszerzenie naczyń płucnych, zwiększenie ciśnienia parcjalnego tlenu we krwi tętniczej.
Dwa ostatnie z wymienionych mechanizmów potencjalnie mogą redukować stymulację
kłębków zatoki szyjnej podczas ciężkiego wysiłku poprzez zwiększenie podaży tlenu do
mięśni lokomocyjnych biorących udział w wysiłku i redukcję stymulacji kłębków zatoki szyjnej
w wyniku kwasicy metabolicznej (zwiększone stężenie mleczanów). Wyniki innych badań
wskazują, że również zmniejszenie hiperinflacji (czyli zmniejszenie elastycznej pracy
oddychania) w wyniku podawania tlenu ma istotne znaczenie dla złagodzenia duszności
(10,11).
Innym sposobem na złagodzenie duszności i ewentualną poprawę tolerancji wysiłku
może być zmiana gęstości powietrza (gazu), którym chory oddycha poprzez podanie do
oddychania mieszanki tlenu z helem (heliox). Wykazano, że oddychanie helioxem zmniejsza
ograniczenie przepływu powietrza przez drogi oddechowe w czasie wydechu i zmniejsza
dynamiczne rozdęcie płuc, zmniejszając tym samym obciążenie elastyczne układu
oddechowego (10,12-14).
Wsparciem dla przewlekle prowadzonej tlenoterapii może być nieinwazyjne
wspomaganie wentylacji (NWW). NWW jest coraz częściej stosowaną metodą jako
alternatywa dla wentylacji inwazyjnej u chorych z zaleceniem „nie intubowania”. Wyniki
niedawno opublikowanych badań (15-17) pokazały, że NWW z dodatnim ciśnieniem w
drogach oddechowych może być skuteczną alternatywą dla intubacji, szczególnie u tych
chorych, u których zastosowanie bardziej inwazyjnych metod terapii stoi pod znakiem
zapytania z powodu obecności zaawansowanego, przewlekłego stanu chorobowego lub
złego rokowania co do długości przeżycia. Co ciekawe, u 40% chorych, wskazaniem do
3
zastosowania NWW było tylko i wyłącznie leczenie paliatywne. Okazuje się bowiem, że
zastosowanie NWW z dodatnim ciśnieniem może w krótkim czasie zmniejszyć uczucie
duszności nie tylko w przebiegu epizodu hiperkapnicznej niewydolności oddychania (18), ale
również u terminalnie chorych z chorobą nowotworową (19).
4
Piśmiennictwo
1. Zieliński J, Tobiasz M, Hawryłkiewicz I, Śliwiński P, Pałasiewicz G.: Effects of longterm oxygen therapy on pulmonary hemodynamics in COPD patients. Chest 1998;
113: 65-70.
2. Nocturnal Oxygen Therapy Trial Group. Continuous or nocturnal oxygen therapy m
hypoxemic chronic obstructive lung disease: a clinical trial. Ann Intern Med 1980;
93:391-8.
3. Report of the Medical Research Council Working Party. Long term domiciliary oxygen
therapy in chronic hypoxic cor pulmonale complicating chronic bronchitis and
emphysema. Lancet 1981,1 (8222):681-686.
4. Pływaczewski R, Śliwiński P, Nowiński A i wsp.: Incidence of nocturnal desaturation
while breathing oxygen in COPD patients undergoing long-term oxygen therapy.
Chest 2000; 117: 679-683.
5. Skwarski K.: Nocna hipoksemia i zaburzenia rytmu serca u chorych z przewlekłą
obturacyjną chorobą płuc. Pol Arch Med Wewn 1989; 81: 283-94.
6. Śliwiński P, Łagosz M, Górecka D, Zieliński J: The adequacy of oxygenation in COPD
patients undergoing long-term oxygen therapy assessed by pulse oximetry at home.
Eur Respir J 1994; 7: 274-278.
7. Goldstein RS, Ramcharan C, Bowes G, i wsp.: Effect of supplemental oxygen on gas
exchange in patients with severe obstructive lung disease. N Engl J Med
1984;310:425-429.
8. O'Donnell DE, Sain DJ, Webb KA. Factors contributing to relief of exertional
breathlessness during hyperoxia in chronic airflow limitation. Am J Respir Crit Care
Med 1997; 155:530-5.
9. Somfay A, Porszasz J, Lee SM, Casaburi R. Dose-response effect of oxygen on
hyperinflation and exercise endurance in nonhypoxaemic COPD patents. Eur Respir J
2001:18(1):77-84.
10. Palange P, Crimi E, Pellegrino R, Brusasco V. Supplemental oxygen and heliox:
‘new’ tools for exercise training in chronic obstructive pulmonary disease. Curr Opin
Pulm Med 2005; 11:145-8.
11. O’Donnell DE, D’Arsigny C, Webb KA. Effects of hyperoxia on ventilatory limitation
during exercise in advanced chronic obstructive pulmonary disease. Am J Respir Crit
Care Med 2001;163:892-8.
5
12. Palange P, Valli G, Onorati P, Antonucci R, Paoletti P, Rosato A, et al. Effect of heliox
on lung dynamic hyperinflation, dyspnea, and exercise endurance capacity in COPD
patients. J Appl Physiol 2004;97:1637-42.
13. Laude EA, Duffy NC, Baveystock C, et al. The effect of helium and oxygen on
exercise performance in chronic obstructive pulmonary disease. A randomized
crossover trial. Am J Respir Crit Care Med 2006;173:865–70.
14. Eves ND, Petersen SR, Haykowsky MJ, Wong EY, Jones RL. Helium-hyperoxia,
exercise, and respiratory mechanics in chronic obstructive pulmonary disease. Am J
Respir Crit Care Med 2006;174:763–71.
15. Levy M, Tanios MA, Nelson D, Short K, Senechia A, Vespia J, et al. Outcomes of
patients with do-not-intubate orders treated with noninvasive ventilation. Crit Care
Med 2004;32:2002–7.
16. Schettino G, Altobelli N, Kacmarek RM. Noninvasive positive pressure ventilation
reverses acute respiratory failure in selected ‘‘do-not-intubate’’ patients. Crit Care
Med 2005;33:1976–82.
17. Chu C- M, Chan VL, Wong IWY, Leung W, Lin AWN, Cheung K-F. Noninvasive
ventilation in patients with acute hypercapnic exacerbation of chronic obstructive
pulmonary disease who refused endotracheal intubation. Crit Care Med 2004;32:
372–7.
18. Bott J, Carrol MP, Conway JH, Keity SEJ, Ward EM, Brown AM, et al. Randomised
controlled trial of nasal ventilation in acute ventilatory failure due to chronic
obstructive airways disease. Lancet 1993;341:1555–7.
19. Cuomo A, Conti G, Delmastro M, Nava S, Antonelli M, Ceriana P, et al. Noninvasive
mechanical ventilation as a palliative treatment of acute respiratory failure in patients
with endstage solid cancer. Palliat Med 2004;18:602–10.
6