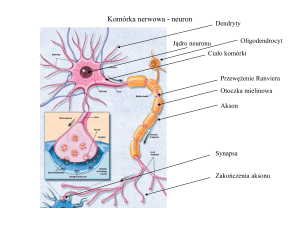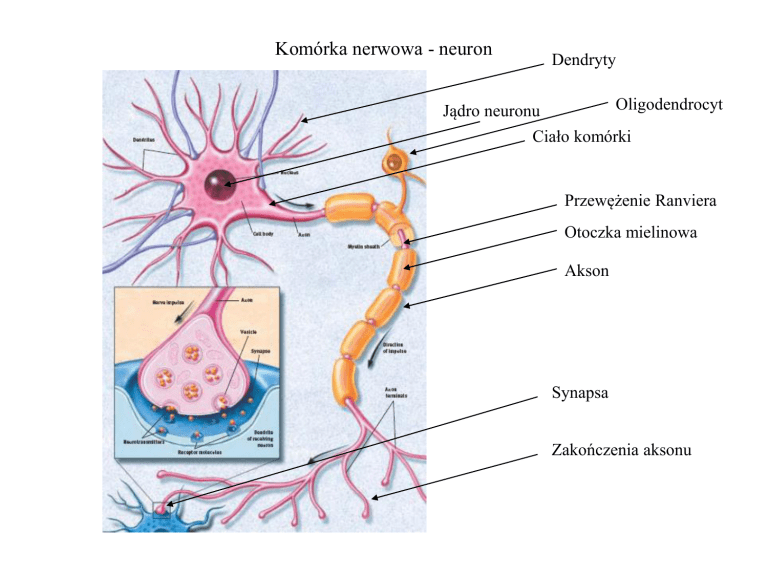
Komórka nerwowa - neuron
Dendryty
Oligodendrocyt
Jądro neuronu
Ciało komórki
Przewężenie Ranviera
Otoczka mielinowa
Akson
Synapsa
Zakończenia aksonu
Komórki glejowe
Komórki glejowe są drugim
głównym składnikiem układu
nerwowego. W niektórych
obszarach są 10 razy liczniejsze niż
neurony.
Najważniejszą rolą komórek
glejowych jest kontrolowanie
otoczenia neuronów. Są one
zaangażowane w wiele różnych
funkcji
Rodzaje i funkcje gleju
•Astrocyty: największe i najliczniejsze. Ich funkcja to
podtrzymywanie fizyczne i odżywianie neuronów,
regulacja zawartości przestrzeni zewnątrzkomórkowej
- buforowanie jonów, regulacja neuroprzekaźnictwa
(pochłanianie neurotransmitera i zapobieganie dyfuzji
poza szczelinę synaptyczną), bariera krew – mózg (?).
•Microglia: składniki układu odpornościowego,
aktywne podczas stanów zapalnych, usuwają ‘zmarłe’
neurony.
•Oligodendrocyty: wytwarzają mielinę w neuronach
centralnego układu nerwowego.
•Komórki satelitarne (Satellite Cells):
podtrzymywanie fizyczne neuronów w obwodowym
układzie nerwowym
•Komórki Schwanna: wytwarzają mielinę w
neuronach obwodowego układu nerwowego.
Stwardnienie rozsiane (łac. sclerosis multiplex, SM) - demielinizacja włókien
nerwowych w obrębie mózgu i rdzenia kręgowego
Potencjał błonowy
Potencjał błonowy – różnica potencjałów
w poprzek błony komórkowej
Potencjał błonowy bierze się z
rozdzielenia dodatnich i ujemnych
ładunków przez błonę komórkową. W
neuronach na zewnątrz występuje
przewaga jonów dodatnich, a wewnątrz
– ujemnych.
Potencjał błonowy jest podstawową własnością wszystkich żywych komórek
Techniki pomiarowe mikropiptety
Mikropipety służą do pomiarów
potencjału zewnątrzkomórkowego,
wewnątrzkomórkowego, patch,
stymulacji elektrycznej,
dostarczania substancji do
przestrzeni zewnątrz/
wewnątrzkomórkowej
Pomiary wewnątrzkomórkowe in vivo. Grupa prof. Amzici, Universite Laval, Quebec, Kanada
Techniki pomiarowe – patch clamp
(E. Neher, B. Sakmann, Nobel 1991)
Pipeta do patch calmp. Zakończenie pipety
może być większe (średnica~3mm) niż
mikropipety do pomiarów
wewnątrzkomórkowych (średnica ~1 mm)
Mikropipety do patch clamp są przygotowywane jak
zwykłe mikropipety lecz ich zakończenia są gładkie i
przyklejają się do błony zamiast ją przekłuwać. Patch
clamp umożliwia pomiar z pojedynczych kanałów
jonowych (indside-out) oraz potencjału błonowego
Układ pomiarowy patch clamp
Techniki pomiarowe – patch clamp
(E. Neher, B. Sakmann, Nobel 1991)
Pomiar potencjału błonowego (whole cell recording) komórki hipokampa metodą patch calmp. Pipeta jest
zaznaczona kolorem niebieskim.
Siły chemiczne i elektryczne
C1
WC 2.3RT log
C2
R – stała gazowa
T - temperatura
WE qV zFV
F – stała Faradaya
V – różnica potencjałów
z - walencyjność
Potencjał Nernsta
Stan równowagi:
WE WC
C1
zFV 2.3RT log
C2
RT
C1
V 2. 3
log
zF
C2
Równanie Nernsta
Walter Hermann Nernst (ur. 25 czerwca 1864 w
Wąbrzeźnie, zm. 18 listopada 1941w Zibelle), laureat
Nagrody Nobla z chemii w 1920r.
V - Potencjał Nernsta, potencjał równowagi,
potencjał dyfuzji
Potencjał Nernsta
RT
[ K ]out
VK 2.3
log
F
[ K ]in
[ K ]out
VK 58 log
mV
[ K ]in
58 log
VNa
5
mV 81mV
125
[ Na ]out
58 log
mV
[ Na ]in
58 log
120
mV 58mV
12
[Cl ]in
VCl 58 log
mV
[Cl ]out
58 log
5
mV 81mV
125
Potencjał błonowy - równanie Goldmana
P K [ K ]out P Na [ Na ]out PCl [Cl ]in
Vm 58 log
mV
P K [ K ]in P Na [ Na ]in PCl [Cl ]out
Równanie Goldmana
Równanie Goldmana-Hodgkina-Katza (GHK)
Dla PNa = 0.04*PK, zaniedbując Cl-:
Vm = -60 mV
Obwód zastępczy
Obwód zastępczy błony komórkowej neuronu. Potencjał równowagowy
jest reprezentowany przez baterię o odpowiedniej polaryzacji i napięciu
odpowiednim dla danego jonu. Bateria jest połączona szeregowo z
opornością (R) odpowiadającą przepuszczalności błony. Zazwyczaj,
zamiast oporności podaje się przewodnictwo G = 1/R, związane z
przepuszczalnością (P) i stężeniami jonów ([K]) następująco:
[ K ]out
GK PK
[ K ]in
Dodatkowo, podwójna warstwa lipidowa tworząca błonę może gromadzić
ładunki i zachowuje się jak kondensator o pojemności Cm.
Potencjał czynnościowy
Potencjał czynnościowy polega na krótkotrwałej
depolaryzacji błony komórkowej. Wczesne doświadczenia
(K.C. Cole i H. J. Curtis, 1939) pokazały, że błona
komórkowa staje się spolaryzowana dodatnio (ok. +50
mV) podczas maksimum potencjału czynnościowego.
Kalmar Atlantycki Loligo pealei
Potencjał czynnościowy – impuls sodowy
Zależność potencjału
czynnościowego od stężenia sodu. A
i B: Maksimum potencjału
czynnościowego maleje wraz
maleniem stężenia Na w płynie
zewnątrzkomórkowym. Silna
zależność wartości maksimum od
stężenia Na wskazuje na duża
przepuszczalność błony dla tych
jonów w trakcie impulsu.
Alan Hodgkin i Bernard Katz odkryli, że amplituda potencjału czynnościowego
zależy od koncentracji Na na zewnątrz komórki. Postawili hipotezę, że chwilowa
zmiana przepuszczalności i wpływ jonów Na do wnętrza komórki powoduje
potencjał czynnościowy. Potwierdzeniem tej hipotezy była obserwacja, że
maksimum potencjału czynnościowego wynosi +55mV, co jest bliskie wartości
potencjału równowagi dla sodu. Ich eksperymenty wskazały również, że zanik
potencjału czynnościowego może być związany ze wzrostem przepuszczalności dla
jonów K i ich wypływem z komórki.
Potencjał czynnościowy – wszystko albo nic!
wzrost gNa
depolaryza
-cja błony
napływ
Na+
‘Wybuchowa’ natura impulsu jest związana z kanałami sodowymi o przepuszczalności zależnej od
napięcia i sprzężeniem zwrotnym dodatnim z depolaryzacją błony.
Skąd się bierze próg?
Depolaryzacja podprogowa jest kompensowana pasywnym wypływem jonów potasu i nie
wywołuje potencjału czynnościowego. Jeśli wypływ jonów potasu nie może zrównoważyć
wpływu jonów sodu, błona osiąga próg na generację impulsu i generowany jest potencjał
czynnościowy.
Okresy refrakcji
Po wystąpieniu potencjału czynnościowego występuje okres refrakcji. W fazie refrakcji
absolutnej komórka nie może wygenerować kolejnego impulsu bez względu na pobudzenie. W
fazie refrakcji względnej, komórka może wygenerować impuls ale wymaga to silniejszego
pobudzenia niż w stanie spoczynku.
Voltage clamp
Technika voltage clamp była opracowana przez Kenneth’a Cole’a w 1949 r. Alan Hodgkin i
Andrew Huxley wykorzystał ją w serii eksperymentów (1952) nad mechanizmem generacji
potencjału czynnościowego. Voltage clamp pozwala mierzyć wpływ zmian potencjału
czynnościowego na przewodnictwa jonowe.
Voltage clamp działa na zasadzie ujemnego sprzężenia zwrotnego. Potencjał błonowy jest mierzony przez
wzmacniacz podłączony do elektrod zewnątrz i wewnątrzkomórkowej. Jest on przekazywany do wzmacniacza
(feedback amplifier). Drugie wejście do wzmacniacza stanowi potencjał z generatora ustalany przez
eksperymentatora (command potential). Wzmacniacz oblicza różnicę napięć i przekazuje sygnał na elektrodę
biegnącą wewnątrz komórki. Prąd potrzebny do utrzymania napięcia na zadanym poziomie jest miarą prądu
błonowego płynącego przez kanały jonowe.
Eksperyment Hodgkina i Huxleya - wyniki
Mała depolaryzacja wywołuje prąd
kondensatora Ic = C dV/dt oraz leak Il.
Większa depolaryzacja wywołuje większy
prąd kondensatora Ic oraz Il oraz
dodatkowo prąd dokomórkowy a następnie
odkomórkowy.
Depolaryzacja w obecności tetrodoxyny
(TTX) blokującej kanały Na a następnie w
obecności tetraethyloammonium (TEA)
blokującej kanał K pozwala zobaczyć
‘czysty’ prąd IK i INa, po odjęciu Ic oraz Il.
•Fugu (puffer fish) specjał sushi zawierający TTX
•Szkolenie na mistrza fugu trwa 3 lata, test zdaje ok. 30%.
•Mimo wszystko, w Japonii, 5-10 osób rocznie umiera w wyniku spożycia fugu
Eksperyment Hodgkina i Huxleya - wyniki
Prawo Ohma
g K (V , t )
I K (V , t )
(V VK )
g Na (V , t )
I Na (V , t )
(V VNa )
Znając IK, INa, VK, VNa, oraz V można obliczyć gK i gNa. IK, INa można wyliczyć z pomiarów voltage clamp, VK,
VNa- stałe, V – ustala eksperymentator.
Andrew Huxley, Alan Hodgkin (Nobel 1963)
dV
I m Cm
I K I Na I L
dt
dV
I m Cm
g K (V , t )(V VK ) g Na (V , t )(V VNa ) g L (V VL )
dt