Genetyka nowotworzenia
Magdalena Badura
Katedra i Zakład Genetyki Medycznej UM w Poznaniu
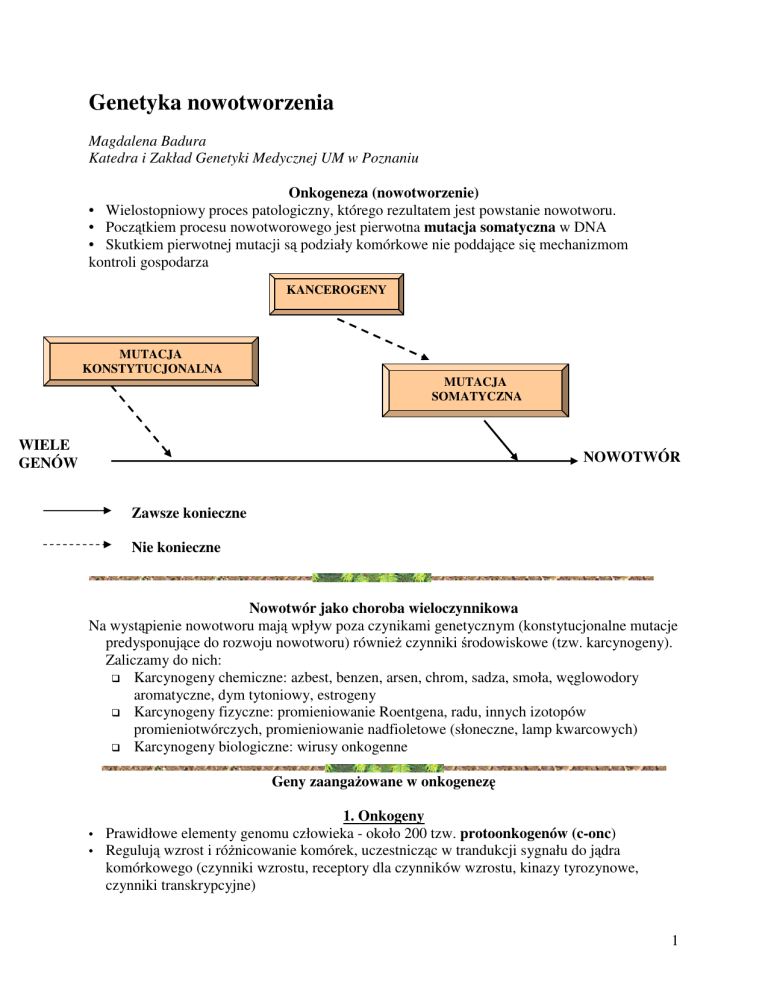
Onkogeneza (nowotworzenie)
• Wielostopniowy proces patologiczny, którego rezultatem jest powstanie nowotworu.
• Początkiem procesu nowotworowego jest pierwotna mutacja somatyczna w DNA
• Skutkiem pierwotnej mutacji są podziały komórkowe nie poddające się mechanizmom
kontroli gospodarza
KANCEROGENY
MUTACJA
KONSTYTUCJONALNA
MUTACJA
SOMATYCZNA
WIELE
GENÓW
NOWOTWÓR
Zawsze konieczne
Nie konieczne
Nowotwór jako choroba wieloczynnikowa
Na wystąpienie nowotworu mają wpływ poza czynikami genetycznym (konstytucjonalne mutacje
predysponujące do rozwoju nowotworu) również czynniki środowiskowe (tzw. karcynogeny).
Zaliczamy do nich:
Karcynogeny chemiczne: azbest, benzen, arsen, chrom, sadza, smoła, węglowodory
aromatyczne, dym tytoniowy, estrogeny
Karcynogeny fizyczne: promieniowanie Roentgena, radu, innych izotopów
promieniotwórczych, promieniowanie nadfioletowe (słoneczne, lamp kwarcowych)
Karcynogeny biologiczne: wirusy onkogenne
Geny zaangażowane w onkogenezę
1. Onkogeny
• Prawidłowe elementy genomu człowieka - około 200 tzw. protoonkogenów (c-onc)
• Regulują wzrost i różnicowanie komórek, uczestnicząc w trandukcji sygnału do jądra
komórkowego (czynniki wzrostu, receptory dla czynników wzrostu, kinazy tyrozynowe,
czynniki transkrypcyjne)
1
Doprowadzają do transformacji nowotworowej, jeżeli nastąpi ich nadmierna ekspresja.
Mutacje aktywujące protoonkogeny zachodzą w jednym allelu protoonkogenu – są dominujące
na poziomie komórkowym.
Aktywacja potencjału onkogennego onkogenu:
• Mutacje punktowe (RAS)
• Translokacja (ABL, MYC)
• Amplifikacja (zwiększenie ilości kopii protoonkogenu) ERBB2
• Poddanie onkogenu kontroli aktywniejszego promotora (np. retrowirusowego)
Wirusy onkogenne
• Niektóre wirusy zawierają w swojej strukturze onkogeny (v-onc) przejęte z genomu
kręgowców na drodze ewolucji
• Onkogeny wirusowe (v-onc) są aktywniejsze od protoonkogenów komórkowych (c-onc)
• Po zakażeniu komórki genom wirusa integruje się z genomem jądrowym i może spowodować
transformację nowotworową komórki (np. poddając onkogen komórkowy kontroli
silniejszego promotora)
Przykłady: HPV, HBV, EBV, HIV1, HTLV
2. Geny supresorowe
• Geny, których zadaniem jest zapobieganie nowotworom
• Utrata lub inaktywacja obu alleli genu supresorowego prowadzi do rozwoju guza
Geny supresorowe wykazują efekt recesywny na poziomie komórkowym!
•
Siatkówczak (retinoblastoma)
Najczęstszy nowotwór wewnątrzgałkowy u dzieci (1:25000 urodzeń żywych)
Objawy: leucokoria (biała źrenica, „kocie oko”), zez, wytrzeszcz
90% przypadków <5rż
Występuje sporadycznie (60%, zwykle jednostronny) lub dziedziczona jest autosomalna
dominująca predyspozycja do rozwoju nowotworu (40%, w 80% obustronny)
Osoba predysponowana do rozwoju nowotworu odziedziczyła 1 zmutowany allel genu
supresorowego Rb na chromosomie 13q14 (wszystkie komórki siatkówki mają tylko jeden
prawidłowy allel genu Rb)
Drugi allel traci w wyniku mutacji somatycznej (zjawisko utraty heterozygotyczności –
LoH)
90% osób z mutacją konstytucjonalną 1 allelu genu Rb zachoruje!
•
•
•
•
Białko P53
Produkt genu supresorowego
Zwane „strażnikiem genomu”
Uszkodzenie DNA powoduje zwiększenie ilości P53 w komórce
P53 wpływa na nasilenie procesu apoptozy i eliminację komórki z uszkodzonym DNA
•
•
•
•
•
•
2
TP53
• Mutacja somatyczna genu TP53 jest najczęstsza zmianą genetyczną, występującą w procesie
powstawania nowotworów u człowieka
• Leży u podłoża raka jelita grubego, sutka, płuca, mózgu i in.
3. Geny mutatorowe
• Mogą naprawiać mutacje prowadzące do aktywacji protoonkogenu lub inaktywacji genu
supresorowego
• Mutacje w genach mutatorowych mogą prowadzić do rozwoju nowotworów!
•
•
•
•
Zespoły dziedzicznej predyspozycji do powstawania nowotworów
Powodowane mutacjami w komórkach rozrodczych
Mutacje dotyczą onkogenów, genów supresorowych, mutatorowych
Dziedziczą się zgodnie z prawami Mendla
Nowotwory występują w młodszym wieku, mogą występować obustronnie lub
wieloogniskowo.
Nerwiakowłókniakowatość ( NF1, NF2)
Gruczolakowatość mnoga wewnątrzwydzielnicza (MEN1, MEN2)
Zespół Li-Fraumeni
Zespół Gardnera
Zespół Lyncha
Zespół Peutz-Jeghers
Autosomalny dominujący typ dziedziczenia
•
•
•
•
•
•
•
•
•
Nerwiakowłókniakowatość typu 1
Choroba von Recklinghausena, Neurofibromatosis, NF1
Mutacje w genie supresorowym NF1
Nowa mutacja odojcowska 50% przypadków
Częstość 30/100000 urodzeń
NF 1 – objawy kliniczne
plamy café au lait
nerwiakowłókniaki skóry
guzki Lischa na tęczówkach (hamartoma z melanocytów)
piegi pod pachami i w pachwinach
niekiedy wielkogłowie, asymetria twarzy, nadciśnienie (zwężenie tętnicy nerkowej),
niepełnosprawność intelektualna (10%), padaczka
NF 1- nowotwory
• Glejaki nerwu wzrokowego
• Barwiaki chromochłonne
• Rhabdomiosarcoma
3
• Zezłośliwienie nerwiakowłókniaka – 5-10%
Gruczolakowatość mnoga wewnątrzwydzielnicza (MEN)
MEN1powodowana mutacją konstytucjonalną w genie MEN1, MEN2 – w onkogenie RET
MEN1:
• Gruczolaki przytarczyc, wysp trzustkowych, przysadki, powodujące nadczynność gruczołów
• Zagrożenie wystąpieniem raka tarczycy, raka nerki, rhabdomiosarcoma
MEN2:
• Rak rdzeniasty tarczycy, pheochromocytoma, gruczolaki przytarczyc
• Niekiedy sylwetka marfanoidalna
Zespół Li Fraumeni
• Spowodowany konstytucjonalnymi mutacjami w genie supresorowym TP53
• Tendencja do występowanie od dzieciństwa mnogich nowotworów :mięsaków, raka sutka,
raka nadnerczy, guza Wilmsa, nowotworów CUN, białaczek
• Częstość raka jelita grubego, płuc, pęcherza, jajnika podobna jak w populacji ogólnej
•
•
•
•
•
•
•
FAP
Rodzinna polipowatość gruczolakowata jelit, FAP, zespół Gardnera jest jednym z
podtypów
Mutacje w genie supresorowym APC
Częstość 1/8000 urodzeń
Od wczesnego dzieciństwa bardzo liczne polipy jelita grubego
Ryzyko zezłośliwienia polipów przed 40 rż wynosi 100%!
1% raków jelita grubego powstaje na podłożu FAP
Wymaga profilaktycznego postępowania chirurgicznego
HNPCC
• Niepolipowaty rak jelita grubego (HNPCC/zespół Lyncha)
• Dziedziczony jest defekt naprawy nieprawidłowo sparowanych nukleotydów DNA (mutacja
w genach mutatorowych MSH2, MSH6, MLH1, PMS1, PMS2)
•
•
•
Rak jelita grubego – 75% w wieku 75 lat (średni wiek diagnozy 45 lat)
Rak trzonu macicy – 40% kobiet z HNPCC
Rak jajnika <10% kobiet z HNPCC
HNPCC – kryteria amsterdamskie (1999 r)
• U co najmniej 3 członków rodziny wykryto nowotwór związany z HNPCC (rak jelita grubego,
rak endometrium, rak jelita cienkiego, rak dróg moczowych)
• Jeden z nich jest krewnym I stopnia dwóch pozostałych
• Chorują 2 kolejne pokolenia
• Przynajmniej u jednej osoby nowotwór był zdiagnozowany <50 rż
• Wykluczono FAP
4
• Nowotwory zostały zweryfikowane histopatologicznie
Zespół Peutz-Jeghers
• 1/2-1/3 to nowe mutacje w genie STK11
Objawy:
• polipy przewodu pokarmowego (każdy odcinek)
• przebarwienia na błonach śluzowych jamy ustnej, odbytu, narządów płciowych, na skórze
dłoni, stóp
Zespół Peutz-Jeghers - nowotworzenie
• Rak jelita cienkiego – ryzyko 500x większe niż w populacji ogólnej
• Rak żołądka – ryzyko 200x większe niż w populacji ogólnej
• Rak trzustki (100x)
• Rak jelita grubego (85x)
• Rak przełyku (60x)
• Rak jajnika (30x)
• Rak trzonu macicy, sutka, płuc (15-20x)
2. Zespoły związane z nieprawidłową naprawą DNA i łamliwością chromosomową
•
•
•
•
•
•
Tendencja do spontanicznych pęknięć chromosomów
Defekty mechanizmów naprawy DNA
xeroderma pigmentosum
ataksja-teleangiektazja
zespół Nijmegen
Xeroderma pigmentosum
Inaczej: Skóra pergaminowata i barwnikowa
Częstość 1/70.000 urodzeń
Upośledzona naprawa DNA po uszkodzeniu promieniowaniem UV
Występują liczne raki skóry (kolczysto- podstawnokomórkowe oraz czerniak) i
bliznowacenie rogówki
Ataksja-teleangiektazja (zespół Louis-Bar)
• Mutacja w genie ATM, którego produkt jest zaangażowany w inicjację naprawy podwójnej
nici DNA
• 1-2,5/105 żywo urodzonych, heterozygoty 1% populacji ogólnej
• W kariotypie rearanżacje chromosomowe, zwłaszcza w obrębie 7 i 14 pary
• Łamliwość chromosomów nasila ekspozycja pacjenta na promieniowanie X
• Objawy: ataksja móżdżkowa, niedobór odporności, teleangiektazje, hipogonadyzm, 100 x
wyższe ryzyko nt układu chłonnego (!), rak skóry, żołądka, sutka, jajnika
5
Zespół Nijmegen
gen NBS1
Białko nibrin uczestniczy w naprawie uszkodzeń podwójnej nici DNA
Większość pacjentów pochodzenia słowiańskiego (Polacy, Czesi) – efekt założyciela
Cytogenetyka – aberracje struktury w 10-30% metafaz, zwykle w obrębie 7 i 14 pary
chromosomów
• Łamliwość chromosomów nasila ekspozycja pacjenta na promieniowanie X
Objawy:
• Małogłowie
• Niskorosłość
• W 30% prawidłowy rozwój intelektualny
• Ptasi profil (cofnięte czoło, małożuchwie)
• Podatność na infekcje
• Nowotworzenie – częste chłoniaki z limfocytów B, medulloblastoma, glioma,
rhabdomiosarcoma
•
•
•
•
3. Zespoły dysmorficzne z predyspozycją do nowotworów
• Zespół Beckwith-Wiedemann (guz Wilmsa, gonadoblastoma, rak nadnerczy, hepatoblastoma,
ogółem 7,5%)
• Zespół Rubinstein-Taybi (oponiaki, ALL, pheochromocytoma, rhabdomiosarcoma, ogółem
5%)
• Zespół Sotosa (guz Wilmsa)
• Zespół Noonan (schwannoma)
• Stwardnienie guzowate (guzy serca, gwiaździaki, wyściółczaki, angiomiolipoma nerki- 75%
pacjentów, rak nerki)
• Zespół Costello (rhabdomiosarcoma, schwannoma, rak pęcherza moczowego, ogółem 15%)
•
•
•
•
•
•
•
•
•
Nabyte aberracje chromosomowe
Powstają w przebiegu większości nowotworów złośliwych
Zmiany w kariotypie następują w komórkach guza w miarę rozwoju choroby
Niekiedy każda komórka guza ma inny kariotyp!
Nasilenie i jakość zmian w kariotypie może być wskazówką prognostyczną
Nie są dziedziczone
Przykład - chromosom Philadelphia w przewlekłej białaczce szpikowej
Chromosom Philadelphia
Translokacja włącza protoonkogen c-ABL chromosomu 9 w region BCR chromosomu 22
Powoduje to aktywację protoonkogenu
Charakterystyczny dla przewlekłej białaczki szpikowej (CML)
6
Nowotwory sutka i jajnika
• 5% nowotworów sutka jest spowodowane dziedziczeniem mutacji w jednym z genów
podatności:
BRCA1 (30-40%)
BRCA2 (10-30%)
TP53 (<1%)
PTEN (<1%)
1/3 przypadków rodzinnego występowania raka sutka spowodowana mutacją nieznanego
genu
BRCA1 i BRCA2
• Biorą udział w regulacji procesów
proliferacji komórkowej oraz
replikacji i naprawy DNA.
• Hamują wzrost komórek raka jajnika i sutka in vitro
Lokalizacja chromosomowa:
BRCA1:
17q21
BRCA2:
13q12-13
•
•
•
•
•
•
•
•
•
•
•
•
Cechy raków zależnych od BRCA1
Średni wiek w momencie diagnozy raka sutka 40 lat.
Średni wiek w momencie diagnozy raka jajnika 51 lata.
W 32% przypadków obustronne raki sutka.
Szybkie tempo wzrostu guza.
Grupa wysokiego ryzyka zachorowania na raka piersi i/lub jajnika
3 krewnych dotkniętych rakiem piersi i/lub jajnika (włączając w to pacjentkę)
Jednoczesny rak sutka i jajnika u pacjentki lub u jej krewnej I lub II stopnia
Wcześniej stwierdzona u pacjentki mutacja genu BRCA1
2 raki piersi i/lub jajnika wśród krewnych I lub II stopnia (włączając w to pacjentkę) – w
tym jedno zachorowanie<50 rż
Pacjentka lub jedna z jej krewnych I stopnia zachorowała na raka piersi lub jajnika< 40 rż
Postępowanie diagnostyczne
Pacjentki z rodzin odpowiadających kryteriom 1 i 2 powinny być w celach diagnostycznych
kierowane do genetycznej poradni onkologicznej oraz włączone do badań nosicielstwa mutacji
genu BRCA1 i ewentualnej mutacji innych genów rozwoju raka piersi i jajnika
Kobiety z w.w. rodzin, z wyjątkiem pacjentek z rodzin, w których stwierdzono mutację genu
BRCA1 a nie są nosicielkami tej mutacji, powinny być objęte programem profilaktycznym.
Badanie nosicielstwa należy rozpocząć od pacjentki z już rozpoznanym nowotworem
7
• Jeśli przy silnie obciążonym wywiadzie rodzinnym nie stwierdza się nosicielstwa mutacji
genu BRCA1 wówczas cała rodzina pozostaje w grupie wysokiego ryzyka!
• W Polsce testowanie BRCA1 jest niezwykle efektywne (90% stanowią 3 mutacje: 5382insC,
C61G i 4153delA) – cena około 400 PLN
WARUNKI:
• Osoba testowana musi być pełnoletnia!
• Przed i po teście obowiązuje przeprowadzenie specjalistycznej konsultacji przez genetykaonkologa.
• Wynik testu jest poufny
Postępowanie profilaktyczne
• Od 20-25 rż badanie palpacyjne i obrazowe piersi (<35 rż - USG, 35-50rż – mammografia i
USG, >50rż – mammografia); najkorzystniejsza opcja: coroczne badanie MRI)
• Od 30 rż coroczne badanie ginekologiczne+USG przezpochwowe z dopplerem
• Ca-125 w surowicy
Profilaktyczne usunięcie przydatków
Nosicielkom mutacji w BRCA1 z rodzin, w których wystąpiły zachorowania na raka jajnika
<50 rż lub u jednej krewnej wystąpiły kolejne zachorowania na raka piersi i jajnika proponuje
się profilaktyczne usunięcie przydatków.
BRCA2
• Częstość występowania mutacji jest zwiększona w rodzinach z rakiem piersi u mężczyzny
(15%)
• U nosicielki mutacji BRCA2 ryzyko wystąpienia raka piersi sięga 31-56% (średni wiek 52
lata)
• Ryzyko wystąpienia raka jajnika sięga
11-27% (średni wiek 62 lata)
Aktualizacja 2006-02-22
8