Rok akademicki:
Grupa przedmiotów: podstawowe
2012/2013
Numer katalogowy:
ECTS 2)
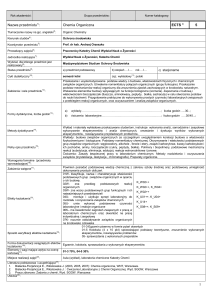
Nazwa przedmiotu1):
Chemia
Tłumaczenie nazwy na jęz. angielski3):
Kierunek studiów4):
Koordynator przedmiotu5):
Prowadzący zajęcia6):
Jednostka realizująca7):
Wydział, dla którego przedmiot jest
realizowany8):
Chemistry
Ogrodnictwo
Dr inż. Katarzyna Dobrosz-Teperek, doktor nauk chemicznych
Pracownicy Katedry Chemii WNoŻ
Wydział Nauk o Żywności, Katedra Chemii
Status przedmiotu9):
10)
Cykl dydaktyczny :
Założenia i cele przedmiotu12):
Formy dydaktyczne, liczba godzin13):
6,0
Wydział Ogrodnictwa i Architektury Krajobrazu
a) przedmiot podstawowy –
obowiązkowy
Semestr zimowy
b) stopień I, rok I
c) stacjonarne
Jęz. wykładowy : polski
11)
Celem przedmiotu jest opanowanie przez studenta podstawowej wiedzy z chemii ogólnej, nieorganicznej i organicznej, będącej
punktem wyjścia do prawidłowej analizy i interpretacji jakościowej i ilościowej procesów zachodzących w przyrodzie oraz oceny
ich wpływu na środowisko naturalne, niezbędnej do dalszego studiowania przedmiotów kierunkowych. Wybrane metody analizy
chemicznej związków nieorganicznych i organicznych mają na celu zapoznanie studenta z podstawowym sprzętem
laboratoryjnym i pracą w laboratorium. Istotnym celem przedmiotu jest kształtowanie umiejętności wykonywania obliczeń
analitycznych, samodzielnej pracy laboratoryjnej, opracowywania i interpretacji wyników eksperymentów.
a)
Wykład
liczba godzin
30
b)
Ćwiczenia laboratoryjne
liczba godzin
30
Metody dydaktyczne14):
Wykład z prezentacją multimedialną; ćwiczenia laboratoryjne – doświadczenia/eksperymenty; prace pisemne – rozwiązywanie
problemu, studium przypadku; konsultacje
Pełny opis przedmiotu15):
Wykłady: Przypomnienie podstawowych pojęć i praw chemicznych. Klasyfikacja związków nieorganicznych i ich nazewnictwo. Typy reakcji
chemicznych. Charakterystyka cząstek elementarnych. Budowa atomu – jądro atomowe. Izotopy, trwałość jąder atomowych i rozpad
promieniotwórczy. Zagrożenia środowiska naturalnego wynikające z rozwoju energetyki jądrowej (odpady radioaktywne, awarie jądrowe, katastrofy
ekologiczne) i zastosowanie izotopów promieniotwórczych. Budowa pozajądrowa atomu – elektrony. Klasyfikacja pierwiastków chemicznych.
Charakterystyka układu okresowego Mendelejewa. Prawo okresowości w chemii. Konfiguracje elektronowe pierwiastków chemicznych. Wiązania
chemiczne i oddziaływania międzycząsteczkowe. Wpływ typu wiązania na budowę i właściwości związków chemicznych. Roztwory i koloidy. Sposoby
wyrażania składu ilościowego roztworu (stężenie procentowe i molowe, miano roztworu). Elektrolity, dysocjacja elektrolityczna. Wartość pH.
Mieszaniny buforowe. Podstawy chemii koordynacyjnej. Związki kompleksowe – budowa, podział, trwałość. Chelatoterapia i jej znaczenie w
ogrodnictwie. Sposoby wyrażania twardości wody i metody jej oznaczania. Wybrane metale i niemetale oraz ich związki – charakterystyka ogólna,
znaczenie w przyrodzie i w nauce, chemiczne zanieczyszczenia środowiska – metale ciężkie, gazy cieplarniane, chemizacja rolnictwa. Struktura i
właściwości związków organicznych. Przegląd podstawowych klas związków organicznych. Zasady nomenklatury systematycznej. Izomeria – jej
rodzaje i przykłady występujące w przyrodzie. Metody otrzymywania i właściwości fizykochemiczne wybranych klas związków organicznych.
Węglowodory i ich fluorowcopochodne, chemiczne zagrożenia środowiska naturalnego – wielopierścieniowe węglowodory aromatyczne, freony,
pestycydy i dioksyny, tworzywa sztuczne. Alkohole, fenole, aldehydy, ketony. Kwasy karboksylowe i ich pochodne (estry, tłuszcze, mydła). Związki
azotu – aminy, amidy (mocznik), aminokwasy, białka. Chemia cukrów – podstawowy podział, przykłady występowania i znaczenia w przyrodzie.
Współczesne metody analityczne oznaczania substancji chemicznych zawartych w materiale pochodzenia naturalnego.
Ćwiczenia: Zasady BHP w laboratorium chemicznym, organizacja i sposób zaliczenia ćwiczeń. Reakcje chemiczne związków nieorganicznych
zachodzące w roztworach wodnych: wytrącanie i rozpuszczanie osadów (reakcje kwasów z zasadami, kwasów i zasad z solami, soli z solami,
wodorotlenków amfoterycznych), hydroliza soli i badanie odczynu roztworu wodnego, reakcje utleniania i redukcji (red-ox) - dobieranie
współczynników stechiometrycznych w reakcjach red-ox, doświadczenia chemiczne z manganianem(VII) potasu w różnych środowiskach reakcji.
Podstawy analizy jakościowej. Wykrywanie anionów szczawianowych w mrożonym szpinaku. Podstawy analizy ilościowej. Wybrane czynności
laboratoryjne - nauka posługiwania się szkłem miarowym, nauka ważenia, pipetowania, sporządzania roztworów i prawidłowej techniki
miareczkowania. Obliczenia analityczne z wykorzystaniem: masy molowej, liczby moli, stężenia procentowego i molowego oraz miana roztworu.
Przygotowanie mianowanego roztworu kwasu L-askorbinowego na podstawie odważki. Sporządzenie i zmianowanie roztworu jodu w jodku potasu.
Ilościowe oznaczenie zawartości witaminy C w soku cytrynowym metodą miareczkowania jodometrycznego. Podstawowe metody izolacji i
identyfikacji związków organicznych. Teoria krystalizacji. Krystalizacja acetanilidu lub kwasu sulfanilowego z wody. Teoria destylacji. Wyodrębnianie
olejków eterycznych z nasion kminku lub liści mięty. Teoria ekstrakcji. Ekstrakcja (S)- lub (R)-karwonu z destylatów. Reakcje charakterystyczne
związków nienasyconych i karbonylowych. Test rozpuszczalności. Identyfikacja związku organicznego na podstawie testu rozpuszczalności.
Wykrywanie aminokwasów, białek i cukrów w materiale biologicznym. Reakcje enzymatyczne – brązowienie enzymatyczne, hydroliza sacharozy w
obecności inwertazy.
Wymagania formalne (przedmioty
wprowadzające)16):
Student rozpoczynający I semestr powinien znać zagadnienia z chemii na poziomie programu w liceum ogólnokształcącym w
stopniu podstawowym, a szczególności: znać symbole pierwiastków chemicznych, wzory i nazewnictwo związków chemicznych,
posiadać umiejętność zapisywania i uzupełniania równań reakcji chemicznych, wykonywać podstawowe obliczenia
Założenia wstępne17):
stechiometryczne. Ponadto powinien znać podstawowe pojęcia i działania matematyczne oraz posługiwać się biegle
kalkulatorem.
01 – ma podstawową wiedzę na temat budowy materii, pojęć,
05 – potrafi wykonać proste obliczenia analityczne z zakresu:
praw i zjawisk zachodzących w przyrodzie, właściwości
stechiometrii reakcji, sporządzania roztworów o żądanym
związków chemicznych występujących w roślinach
stężeniu, pH roztworu
02 – wykonuje czynności laboratoryjne, niezbędne do badania
06 – potrafi przygotować pracę pisemną dotyczącą zagadnień
właściwości i oceny jakości materiałów pochodzenia
związanych z ogrodnictwem (pH i wpływ kwasowości na
naturalnego
18)
produkcję roślinną, chemiczne środki ochrony roślin, nawozy
Efekty kształcenia :
03 – posiada ogólną wiedzę na temat podstawowych metod i
sztuczne, chemia atmosfery, wody i gleby)
technik analizy chemicznej związków nieorganicznych i
07 – posiada umiejętność obserwacji prowadzonych
organicznych w produktach pochodzenia naturalnego
eksperymentów i interpretacji uzyskanych wyników
04 – ma ogólną wiedzę na temat zagrożeń środowiska
08 – posiada umiejętność pracy samodzielnej i zespołowej, i
naturalnego wynikających z używania pestycydów i nawozów
jest odpowiedzialny za bezpieczeństwo własne i innych
sztucznych, z rozwoju energetyki jądrowej
Efekt 01, 03, 04, 05 – egzamin pisemny
Efekt 01, 03, 05 – kolokwia pisemne na ćwiczeniach laboratoryjnych
Sposób weryfikacji efektów kształcenia19): Efekt 01, 03, 04, 06 – prace pisemne
Efekt 02, 03, 05, 07, 08 – ocena praktycznych zadań kontrolnych wykonywanych w trakcie trwania zajęć/sprawozdania pisemne
Forma dokumentacji osiągniętych efektów Treść pytań z kolokwiów pisemnych na ćwiczeniach laboratoryjnych oraz listy ocen studentów z kolokwiów i sprawozdań
pisemnych, treści pytań egzaminacyjnych oraz lista ocen studentów, treści pytań prac pisemnych oraz lista ocen studentów,
kształcenia 20):
protokoły z końcowymi ocenami z przedmiotu
Ocena z praktycznych zadań kontrolnych wykonywanych w trakcie zajęć/sprawozdania pisemne – 10% (10 pkt)
Ocena z kolokwiów pisemnych przeprowadzanych podczas ćwiczeń laboratoryjnych – 40% (40 pkt)
Elementy i wagi mające wpływ na ocenę
Ocena z egzaminu – 40% (40 pkt)
końcową21):
Ocena z prac pisemnych – 10% (10 pkt)
Student, który z każdego elementu uzyska co najmniej 51%, zalicza przedmiot.
Miejsce realizacji zajęć22):
Wykład – aula wykładowa, ćwiczenia laboratoryjne – laboratoria dydaktyczne Katedry Chemii WNoŻ
Literatura podstawowa i uzupełniająca23):
Praca zbiorowa: Ćwiczenia z chemii nieorganicznej i analitycznej , Wyd. SGGW, Warszawa 2011.
E. Białecka-Florjańczyk, J. Włostowska, Ćwiczenia laboratoryjne z chemii organicznej, Wyd. SGGW, Warszawa 2007.
T. Drapała, Chemia ogólna nieorganiczna z zadaniami, Wyd. SGGW, Warszawa 2002.
E. Białecka-Florjańczyk, J. Włostowska: Podstawy chemii organicznej, Wyd. SGGW, Warszawa 1999.
A. Bielański, Podstawy chemii nieorganicznej, PWN, Warszawa 2005.
R.T. Morrison, R.N. Boyd: Chemia organiczna, PWN, Warszawa 2008.
UWAGI24): skala ocen: 51-60 pkt – ocena 3,0; 61-70 pkt – ocena 3,5; 71-80 pkt– ocena 4,0; 81-90 pkt – ocena 4,5; 91-100 pkt – ocena 5,0.
1.
2.
3.
4.
5.
6.
Wskaźniki ilościowe charakteryzujące moduł/przedmiot25) : Chemia
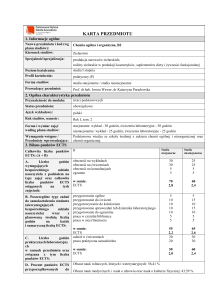
Szacunkowa sumaryczna liczba godzin pracy studenta (kontaktowych i pracy własnej) niezbędna dla osiągnięcia
zakładanych efektów kształcenia18) – na tej podstawie należy wypełnić pole ECTS2):
Łączna liczba punktów ECTS, którą student uzyskuje na zajęciach wymagających bezpośredniego udziału nauczycieli
akademickich:
Łączna liczba punktów ECTS, którą student uzyskuje w ramach zajęć o charakterze praktycznym, takich jak zajęcia
laboratoryjne, projektowe, itp.:
144 h
6,0 ECTS
72 h
3,0 ECTS
68 h
2,5 ECTS
Wskaźniki ilościowe charakteryzujące moduł/przedmiot25) : Chemia
Szacunkowa sumaryczna liczba godzin pracy studenta (kontaktowych i pracy własnej) niezbędna dla osiągnięcia
zakładanych efektów kształcenia18)
Wykłady
Ćwiczenia laboratoryjne
Dokończenie sprawozdań z zadań prowadzonych w trakcie ćwiczeń laboratoryjnych
Przygotowanie do kolokwiów
Udział w konsultacjach (1/3 wszystkich konsultacji)
Przygotowanie prac pisemnych
Przygotowanie do egzaminu
Obecność na egzaminie
Razem
Łączna liczba punktów ECTS, którą student uzyskuje na zajęciach wymagających bezpośredniego udziału nauczycieli
akademickich:
Wykłady
Ćwiczenia laboratoryjne
Udział w konsultacjach (1/3 wszystkich konsultacji)
Obecność na egzaminie
Razem
Łączna liczba punktów ECTS, którą student uzyskuje w ramach zajęć o charakterze praktycznym, takich jak zajęcia
laboratoryjne, projektowe, itp.:
Ćwiczenia laboratoryjne
Dokończenie sprawozdań z zadań prowadzonych w trakcie ćwiczeń laboratoryjnych
Udział w konsultacjach (1/3 wszystkich konsultacji)
Przygotowanie prac pisemnych
Razem
30 h
30 h
10 h
22 h
10 h
18 h
22 h
2h
144 h
6,0 ECTS
30 h
30 h
10 h
2h
72 h
3,0 ECTS
30 h
10 h
10 h
18 h
68 h
2,5 ECTS
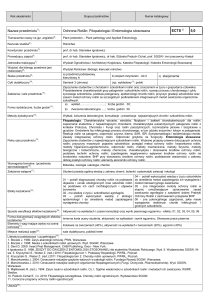
Tabela zgodności kierunkowych efektów kształcenia z efektami przedmiotu26) Chemia
Nr /symbol
efektu
01
02
03
04
05
06
07
08
Wymienione w wierszu efekty kształcenia:
ma podstawową wiedzę na temat budowy materii, pojęć, praw i zjawisk zachodzących w
przyrodzie, właściwości związków chemicznych występujących w roślinach
wykonuje czynności laboratoryjne, niezbędne do badania właściwości i oceny jakości
materiałów pochodzenia naturalnego
posiada ogólną wiedzę na temat podstawowych metod i technik analizy chemicznej
związków nieorganicznych i organicznych w produktach pochodzenia naturalnego
ma ogólną wiedzę na temat zagrożeń środowiska naturalnego wynikających z używania
pestycydów i nawozów sztucznych, z rozwoju energetyki jądrowej
potrafi wykonać proste obliczenia analityczne z zakresu stechiometrii reakcji, sporządzania
roztworów o żądanym stężeniu, pH roztworu
potrafi przygotować pracę pisemną dotyczącą zagadnień związanych z ogrodnictwem (pH
i wpływ kwasowości na produkcję roślinną, chemiczne środki ochrony roślin, nawozy
sztuczne, chemia atmosfery, wody i gleby)
posiada umiejętność obserwacji prowadzonych eksperymentów i interpretacji uzyskanych
wyników
posiada umiejętność pracy samodzielnej i zespołowej oraz jest odpowiedzialny za
bezpieczeństwo własne i innych
Odniesienie do efektów dla programu
kształcenia na kierunku
K_W01+++, K_W03++
K_W10++, K_U09++
K_W11+, K_U09++
K_W03++, K_W14+, K_K04++, K_K07+
K_W01+++
K_U11++, K_U15+++, K_K01++, K_K02++
K_U13+++
K_K06++