MED. DOŚW. MIKROBIOL., 2009, 61: 175 - 182
Waldemar Rastawicki, Natalia Rokosz, Marek Jagielski
OCENA PRZYDATNOŚCI WYBRANYCH ANTYGENÓW
MYCOPLASMA PNEUMONIAE DO SERODIAGNOSTYKI
MYKOPLAZMOZY
Zakład Bakteriologii NIZP-PZH w Warszawie
Kierownik: prof. dr hab. M. Jagielski
Oceniono przydatność wybranych antygenów białkowych, lipoproteinowych
i glikolipidowych M. pneumoniae do serodiagnostyki mykoplazmozy. Wykazano, że najczęściej w próbkach surowicy osób z mykoplazmozą wykrywane
są przeciwciała dla białka P1 i P90 oraz dla glikolipidowej frakcji antygenu
M. pneumoniae.
Za antygenową aktywność Mycoplasma pneumoniae odpowiedzialne są lipidy, białka
oraz lipopolisacharydy znajdujące się w błonie otaczającej komórkę bakteryjną (5, 8, 16).
Hapten lipidowy jest chemicznie niejednorodny a jedną z jego głównych frakcji stanowi
trójgalaktozydwugliceryd, glikolipid wykazujący pokrewieństwo z lipidami wyekstrahowanymi z różnych tkanek człowieka, z komórek paciorkowca MG, z błony komórkowej M.
genitalium a nawet z liści szpinaku (1, 10, 11, 12). Warstwa białkowa błony komórkowej
składa się z szeregu białek o zróżnicowanej masie cząsteczkowej, odpowiedzialnych nie
tylko za antygenową aktywność tego drobnoustroju ale także za przyleganie M. pneumoniae
do komórek nabłonka układu oddechowego człowieka. Niewątpliwie najlepiej poznanymi
adhezynami M. pneumoniae są: białko o masie 160-180 kDa, oznaczone symbolem P1,
białko o masie 119 kDa, białko 89-90 kDa oraz białko o masie 30-32 kDa. Podobną funkcję
adhezyn bakteryjnych pełni również 5 białek oznaczanych odpowiednio symbolami HMW
1 do HMW 5 (high-molecular-weight proteins) o masie cząsteczkowej od 140 do ponad
340 kDa, oraz białek oznaczanych literami A, B, C, o masie odpowiednio 72, 85 i 37 kDa
(6, 18 ).
Występujące w rutynowej, prowadzonej odczynem wiązania dopełniacza czy też testem
ELISA, serologicznej diagnostyce mykoplazmozy, fałszywie dodatnie wyniki spowodowane
są obecnością autoimmunoglobulin reagujących krzyżowo z glikolipidową frakcją antygenu
M. pneumoniae oraz podobieństwem budowy antygenowej komórek mykoplazmowych do
różnych, często nie spokrewnionych patogenów bakteryjnych. Również pomimo tego, że
aktualnie w serologicznej diagnostyce mykoplazmozy coraz częściej jako antygeny wykorzystuje się rekombinowane białka M. pneumoniae, wskazane jest potwierdzanie dodatnich
wyników odczynem western-immunoblotting, który pozwala na ocenę immunologicznej odpowiedzi dla elektroforetycznie rozdzielonych poszczególnych antygenów bakteryjnych.
176
W. Rastawicki, N. Rokosz, M. Jagielski
Nr 2
Celem zaplanowanych badań była ocena przydatności wybranych antygenów M. pneumoniae w badaniu humoralnej odpowiedzi w przebiegu mykoplazmozy u ludzi.
MATERIAŁ I METODY
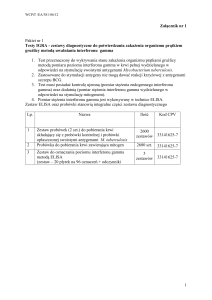
P r ó b k i s u r o w i c y. Do badań użyto ogółem 201 próbek surowicy, z czego:
- 97 próbek uzyskano od osób z objawami infekcji układu oddechowego. W próbkach tych,
w uprzednio wykonanych rutynowych badaniach odczynem wiązania dopełniacza, wykryto
obecność mykoplazmowych przeciwciał w mianie diagnostycznie znamiennym (≥ 60 )
- 82 próbki surowicy uzyskano od osób chorych, z innymi niż mykoplazmoza zakażeniami
bakteryjnymi, takimi jak: borelioza, chlamydioza, bartoneloza, legioneloza, krztusiec,
jersinioza, tularemia.
- 22 próbki surowicy uzyskano od klinicznie zdrowych osób - krwiodawców
Odczyny serologiczne.
O d c z y n E L I S A . Do badań wykorzystano komercyjny zestaw ELISA firmy Virotech:
Mycoplasma pneumoniae ELISA IgG/IgM Testkit (EC114.00) i IgA Set (nr kat. 114.08).
Jako antygen w zestawie ELISA producent zastosował rekombinowane białka. Odczyn
wykonano według wskazówek producenta.
O d c z y n w i ą z a n i a d o p e ł n i a c z a ( O W D ) . Odczyn przeprowadzono zgodnie
z metodyką podaną uprzednio (9). Jako antygenu użyto homogenną zawiesinę fragmentów błon komórkowych uzyskanych po rozbiciu ultradźwiękami komórek szczepu FH M.
pneumoniae.
O d c z y n w e s t e r n - i m m u n o b l o t t i n g . Użyto zestawu komercyjnego firmy Virotech
Mycoplasma pneumoniae WB (IgG/IgA/IgM western Blot) nr kat. WE114X30, WE114K80.
W zestawie znajdują się następujące antygeny uzyskane ze szczepu M129 M. pneumoniae:
HMW 1, HMW 2, HMW 2-CR, HMW 3, białko P1, Leucine Zipper, ABC transp., P10,
P12, P20, P30, P40, P44, P47, P50, P65, P65` C, P88, P90, P100, DNA J, DNA K, FTSH
Dimer, Gro EL, Fts H monome,r, ABC transp. Int., Fts Z, E-FG, Repet. Prot., HMW 2` C,
ATP-ase Sub. B, lipoproteidy, glikolipidy.
Za wynik dodatni testu, zgodnie z danymi producenta, przyjęto:
- w przypadku badania przeciwciał jednocześnie w klasie immunoglobulin A, G i M reakcję z białkiem P1,
- w przypadku badania przeciwciał jednocześnie w klasie immunoglobulin A i G – reakcję z >24 antygenami. Za wynik wątpliwy testu przyjęto wystąpienie reakcji z 22-24
antygenami lub wystąpienie reakcji z lipoproteidami lub glikolipidem
- w przypadku badania przeciwciał wyłącznie w klasie immunoglobulin M – reakcję
z co najmniej 9 antygenami. Za wynik wątpliwy testu przyjęto wystąpienie reakcji z 7-8
antygenami lub wystąpienie reakcji z lipoproteidami lub glikolipidem
Odczyn przeprowadzono według wskazówek producenta, z tym że interpretację
wyników dodatnich rozszerzono poprzez wprowadzenie dodatkowej, 3-stopniowej skali
intensywności reakcji ocenianej jako: +, ++ lub +++.
S t a t y s t y c z n e o p r a c o w a n i e w y n i k ó w. Istotność różnic w częstości wykrywania
przeciwciał w próbkach surowicy osób chorych i osób z grupy kontrolnej oceniano testem
niezależności chi-kwadrat z zastosowaniem poprawki Yatesa. Za znamienne statystycznie
przyjęto różnice, gdzie poziomy istotności p były mniejsze od 0,05 (p<0,05).
Nr 2
Antygeny M. pneumoniae w serodiagnostyce mykoplazmozy
177
WYNIKI
W prezentowanej pracy oceniono przydatność do serodiagnostyki mykoplazmozy 33
różnych antygenów M. pneumoniae przeniesionych na paski nitrocelulozy przez producenta
zestawu western-blotting. Dodatkowo, oceniono przydatność w serodiagnostyce mykoplazmozy zestawu ELISA firmy Virotech, w którym jako antygen zastosowano preparat
rekombinowanych białek M. pneumoniae. Wyniki uzyskane odczynem ELISA porównano
z wynikami wcześniej przeprowadzonych badań odczynem wiązania dopełniacza, w którym
jako antygenu użyto antygenu lipidowo-białkowego.
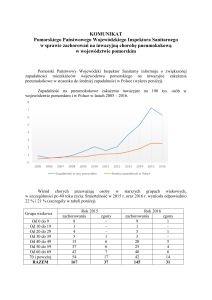
Wyniki odczynu ELISA przedstawiono w tabeli I. Wśród 97 próbek surowicy uzyskanych
od osób z mykoplazmozą, z dodatnim wynikiem w odczynie wiązania dopełniacza (miano ≥
60), przeciwciała klasy IgM wykryto odczynem ELISA we wszystkich próbkach, przeciwciała klasy IgA w 90,7% i przeciwciała klasy IgG w 85,6% próbek. W próbkach surowicy
uzyskanych od osób chorych z innymi niż mykoplazmoza zakażeniami bakteryjnymi oraz
od krwiodawców przeciwciała dla antygenów M. pneumoniae wykrywano statystycznie
istotnie rzadziej (p<0,05) niż w próbkach surowicy osób z mykoplazmozą.
Tabela I. Porównanie wyników badania próbek surowicy odczynem ELISA i OWD
Liczba i odsetek
ELISA Virotech
Liczba
wyników
Liczba
i
odsetek
wyników dodatnich
Grupa badanych osób
badanych
dodatnich
osób
IgA
IgG
IgM
w OWD
97
88
83
97
Osoby z mykoplazmozą
97
100%
90,7%
85,6%
100%
Osoby z innymi
4
28
28
11
82
bakteryjnymi zakażeniami
4,9%
34,1%
34,1%
13,4%
1
6
8
2
Krwiodawcy
22
4,5%
27,3%
36,4%
9,1%
Dokładne zestawienie wyników wykazało, że reakcje dodatnie w odczynie ELISA stwierdzono w przypadku badania próbek surowicy uzyskanych od osób chorych na wszystkie
zakażenia bakteryjne ujęte w badaniach (Tabela II). Generalnie, odsetek wyników dodatnich
z preparatem rekombinowanych białek M. pneumoniae w przypadku poszukiwania przeciwciał klasy IgM był niższy niż w przypadku poszukiwania przeciwciał klasy IgA i IgG. Nie
mniej jednak, o ile odczynem wiązania dopełniacza przeciwciała w mianie diagnostycznie
znamiennym wykrywano sporadycznie, to odczynem ELISA odsetek wyników dodatnich
w klasie IgA i IgG sięgał w niektórych przypadkach nawet powyżej 50%.
W tabeli III porównano wyniki badania 50 próbek surowicy odczynem western-immunoblotting i odczynem ELISA. Do badań przeznaczono próbki surowicy, zarówno od osób
z mykoplazmozą (44 próbki) jak i z innymi zakażeniami bakteryjnymi (6 próbek), w których
wykazano odczynem ELISA podwyższony poziom przeciwciał w co najmniej dwóch klasach
immunoglobulin. Przeprowadzone badania wykazały zgodność wyników obydwu testów
na poziomie 72,0% - 84,0%. Odczynem western-immunoblotting nie potwierdzono aż 14
wyników dodatnich w klasie IgA i po 8 wyników dodatnich w klasie IgG i IgM uzyskanych
w odczynie ELISA. Na uwagę zasługuje fakt, że na 6 próbek surowicy uzyskanych od osób
178
Nr 2
W. Rastawicki, N. Rokosz, M. Jagielski
Tabela II. Wyniki badania odczynem ELISA próbek surowicy uzyskanych od osób
chorych z innymi niż mykoplazmoza zakażeniami bakteryjnymi
Osoby z boreliozą
Osoby z chlamydiozą
Liczba
badanych
osób
24
9
Osoby z bartonelozą
11
Osoby z legionelozą
10
Osoby z krztuścem
Osoby z jersiniozą
10
10
Osoby z tularemią
8
Grupa badanych osób
Ogółem
82
Liczba wyników
dodatnich
w OWD
1
1
1
1
4
ELISA Virotech
Liczba wyników dodatnich
IgA
IgG
IgM
12
7
1
5
5
3
4
5
3
3
1
1
3
28
3
5
2
28
3
1
11
Tabela III. Porównanie wyników badania 50 próbek surowicy odczynem western- immunoblotting
i odczynem ELISA
Klasa przeciwciał
IgA
IgG
IgM
Liczba i odsetek próbek z wynikiem:
Western +
ELISA +
35
70,0%
41
82,0%
38
76,0%
Western +
ELISA -
Western ELISA +
14
28,0%
8
16,0%
8
16,0%
Western ELISA 1
2,0%
1
2,0%
4
8,0%
Liczba i odsetek
wyników
zgodnych
36
72,0%
42
84,0%
42
84,0%
z innymi niż mykoplazmoza zakażeniami bakteryjnymi, dodatni wynik w odczynie ELISA
został potwierdzony odczynem western-immunobliting tylko w jednym przypadku.
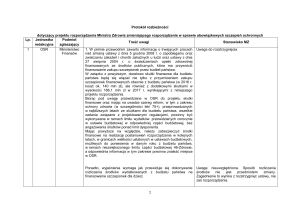
Przeprowadzone badania odczynem western-immunoblotting wykazały, że najczęściej
z surowicami osób z mykoplazmozą reagowało białko P1 oraz białko P90 (Tabela IV). Reakcje serologiczne z tymi białkami były szczególnie intensywne, najczęściej oceniane na
trzy plusy, w przypadku poszukiwania przeciwciał klasy IgG. Rzadsze i mniej intensywne
reakcje obserwowano z glikolipidami oraz z białkami P50, P47 i Fts monomer. Reakcje
surowic uzyskanych od osób z mykoplazmozą z pozostałymi antygenami były sporadyczne
i z reguły bardzo słabe. W przypadku niektórych antygenów, takich jak białka P88, Repet.
Prot. czy P20, nie wykryto widocznej reakcji w odczynie western-immunoblotting z użytymi surowicami.
Nr 2
Antygeny M. pneumoniae w serodiagnostyce mykoplazmozy
179
Tabela IV Wyniki badania odczynem western-immunoblotting 45 próbek surowicy uzyskanych od
osób z mykoplazmozą
Liczba wyników dodatnich w klasie :
Antygen
IgA
IgG
IgM
+
++
+++
+
++
+++
+
++
+++
HMW 1
1
1
4
1
1
6
1
HMW 2
1
1
1
7
1
Białko P1
14
15
6
9
12
23
18
11
9
Leucine zipper
2
1
3
3
HMW 3
3
3
7
HMW 2-CR
3
4
P100
2
1
5
1
ABC transp.
4
1
1
5
1
P 88
P 90
11
9
7
8
6
22
11
12
8
FTSH Dimer
4
1
1
5
1
8
5
P 65
2
1
6
2
7
2
DNA K
1
1
1
2
3
1
3
4
P 65` C
1
1
Gro EL
1
1
1
P 50
1
2
1
4
10
3
3
P 47
8
3
2
7
7
3
15
7
3
DNA J
5
1
4
2
8
1
P 44
4
5
1
1
1
1
Fts H monomer
4
6
8
1
6
4
2
ABC transp. Int.
2
1
1
2
1
6
1
1
P 40
2
6
1
8
Fts Z
3
1
1
4
3
P 30
1
2
2
2
4
3
E-FG
3
1
2
1
2
4
2
Repet. Prot.
HMW 2` C
1
1
1
ATP-ase Sub. B
3
2
2
2
1
P20
lipoproteiny
3
1
9
5
1
P12
2
P10
4
2
glikolipidy
13
3
1
8
20
10
4
Objaśnienia: intensywność reakcji barwnej:
+ - prążki barwy jasno – brązowej,
++ - prążki barwy ciemno – brązowej,
+++ - prążki barwy brązowo - granatowej
DYSKUSJA
W przeprowadzonych badaniach wykazano 100% zgodność wyników uzyskanych
w odczynie wiązania dopełniacza i odczynie ELISA, w którym oznaczano przeciwciała
klasy IgM. Biorąc pod uwagę fakt, iż w obydwu odczynach zastosowano różne preparaty
antygenowe, wyniki te świadczą o tym, iż w mykoplazmozie przebiegającej z intensywną
odpowiedzią immunologiczną obydwa rodzaje antygenu są równocenne.
180
W. Rastawicki, N. Rokosz, M. Jagielski
Nr 2
Nieco odmiennie wyglądała sytuacja gdy do badań porównawczych wybrano próbki
surowicy uzyskane od osób chorych, z innymi niż mykoplazmoza zakażeniami bakteryjnymi
oraz od krwiodawców. Odsetek wyników dodatnich w odczynie ELISA, zwłaszcza przy
poszukiwaniu przeciwciał w klasie IgA i IgG był dużo wyższy niż w odczynie wiązania
dopełniacza. Wydaje się, że było to spowodowane przyjęciem przez producenta zestawu
ELISA znacznie niższego punktu odcięcia (cut-off) niż w OWD. Tak więc, rozbieżności te
dotyczyły głównie próbek surowicy, o nieznacznie podwyższonym poziomie miana w OWD,
niższym jednak niż diagnostycznie znamienne. Na uwagę zasługuje bardzo zbliżony odsetek wyników dodatnich stwierdzonych w grupie osób chorych na inne niż mykoplazmoza
zakażenia bakteryjne oraz w grupie osób zdrowych. Szczegółowa analiza wyników badania
próbek surowicy uzyskanych od osób chorych na poszczególne jednostki chorobowe również
nie wykazała statystycznie istotnych różnic. Może to świadczyć o tym, że obydwa rodzaje
antygenów są wystarczająco swoiste i że nie reagują silnie z przeciwciałami dla innych
drobnoustrojów. Nie mniej jednak bardzo wysoki odsetek wyników dodatnich w klasie
IgA i IgG w tych grupach badanych osób świadczy o pewnej nadczułości odczynu ELISA
firmy Virotech, co może mieć istotny wpływ na poprawność interpretacji badań próbek
uzyskanych od osób z podejrzeniem mykoplazmozy.
O nadczułości odczynu ELISA firmy Virotech, w którym zastosowano jako antygen
preparat rekombinowanych białek, w poszukiwaniu mykoplazmowych przeciwciał, świadczy również porównanie wyników badania odczynu ELISA i western-immunoblotting.
Stwierdzono, że odczynem ELISA wykrywano przeciwciała klasy IgA, IgG i IgM znacznie
częściej niż testem referencyjnym, jakim jest odczyn western-immunoblotting.
Głównym tematem pracy była ocena przydatności 33 różnych antygenów, przeniesionych elektroforetycznie na nitrocelulozę przez producenta testu Mycoplasma pneumoniae
WB, do serodiagnostyki mykoplazmozy. Producent wykorzystał w swoim zestawie zarówno
białka, lipoproteiny jak i glikolipidy. Uzyskane przez nas wyniki jednoznacznie świadczą
o tym, że najlepszymi antygenami M. pneumoniae są białka o masie cząsteczkowej 170-180
kDa, oznaczone symbolem P1, oraz o masie 89-90 kDa. Wyniki te są zbieżne z wynikami
uzyskanymi w badaniach przeprowadzonych uprzednio w naszym laboratorium, w których
wykazano, że najczęściej i najsilniej reagowały surowice osób z mykoplazmozą z białkami
o masie cząsteczkowej: 170 kDa (białko P1), 120, 110, 89, 66, 55, 43, 38 i 33 kDa (14).
Szczególnie silną reakcję, we wszystkich klasach immunoglobulin, obserwowano w przypadku białka P1.
Varshney i wsp. (19) sklonowali i oczyścili białko o masie 30 kDa biorące aktywny
udział w przyleganiu komórek M. pneumoniae do komórek nabłonkowych. Przeprowadzone przez tych autorów badania wykazały, że odczyn ELISA, w którym wykorzystano
rekombinowane białko P30 jako antygen, charakteryzował się w stosunku do komercyjnego
odczynu ELISA wysoką czułością i swoistością (odpowiednio 78,57% i 89, 47%). Zdaniem
Varshney i wsp. białko to, obok białka P1 i białka P116 może być wykorzystane jako swoisty
antygen w serologicznej diagnostyce mykoplazmozy. W naszych badaniach przeciwciała
dla białka P30 wykrywaliśmy jednak w zdecydowanie mniejszym odsetku próbek surowicy
osób z mykoplazmozą niż przeciwciała dla białka P1 i białka P90.
Duffy i wsp. (4) wykorzystali z powodzeniem jako antygen w odczynie ELISA rekombinowane białko powierzchniowe M. pneumoniae o masie 116 kDa. Ponieważ producent
testu western-blotting użytego w prezentowanej pracy nie zastosował tego białka jako
Nr 2
Antygeny M. pneumoniae w serodiagnostyce mykoplazmozy
181
antygenu nie możemy potwierdzić jego przydatności w serologicznej diagnostyce zakażeń
wywoływanych przez M. pneumoniae.
Dallo i wsp. (3) oraz Hu i wsp. (7) wykazali antygenowe podobieństwo pomiędzy białkiem
P1 M. pneumoniae o masie cząsteczkowej 170 kDa a białkiem M. genitalium o masie cząsteczkowej 135-140 kDa. We wcześniej przeprowadzonych badaniach wykazaliśmy jednak, że
białka o masie cząsteczkowej 170 i 89 kDa nie reagowały w odczynie western-immunoblotting
z surowicą dla M. genitalium i były wysoce swoiste dla M. pneumoniae (15).
Istotnym antygenem M. pneumoniae silnie stymulującym układ immunologiczny
człowieka są glikolipidy (2). Wykazanie obecności w surowicy osób chorych swoistych
przeciwciał klasy IgM dla tego antygenu świadczy o początkowym, ostrym stadium zakażenia mykoplazmowego (17). W prezentowanej pracy również stwierdzono wyjątkowo
częste występowanie przeciwciał klasy IgM dla glikolipidów. Według Pönka i wsp. (13)
odpowiedź immunologiczna na antygen glikolipidowy nie musi być związana z aktywnym
zakażeniem mykoplazmowym, może natomiast być następstwem przebytego uprzednio
zakażenia mykoplazmowego w przypadku występowania niektórych objawów chorobowych zlokalizowanych poza układem oddechowym. Udowodniono również występowanie
nieswoistych reakcji krzyżowych pomiędzy glikolipidowym antygenem M. pneumoniae
i przeciwciałami skierowanymi dla M. genitalium (12, 15).
Wyniki przeprowadzonych badań potwierdziły wcześniejsze obserwacje, że najlepszymi
antygenami M. pneumoniae, które można wykorzystać w serologicznej diagnostyce mykoplazmozy, są białka o masie cząsteczkowej 170-180 kDa (białko P1) i 89-90 kDa.
W. Rastawicki, N. Rokosz, M. Jagielski
EVALUATION OF THE USEFULNESS OF SELECTED ANTIGENS OF MYCOPLASMA
PNEUMONIAE FOR THE SERODIAGNOSIS OF MYCOPLASMOSIS
SUMMARY
A panel of 33 different antigens, among them lipoproteins, glicolipids and proteins, of Mycoplasma
pneumoniae used in commercial western-blotting (Virotech) were assessed for reactivity with sera
of patients with mycoplasmosis and other bacterial infections of variable etiology. In addition, commercial ELISA (Virotech) with recombinant proteins as antigen and complement fixation test (CFT)
with in-house prepared glicolipid-protein antigen were also assessed for comparison. The proteins
with molecular weight of 170 kDa (P1) and 90 kDa (P90) were most recognized by the serum samples
of patients with mycoplasmosis. The reactions of proteins P50, P47 and Fts monomer with positive
sera were not such often and the response was usually weak. The other proteins of M. pneumoniae,
particularly P88, Repet.Prot. or P20, were recognized occasionally or at all. We observed also the
often reactions of glicolipids of M. pneumoniae with IgM antibodies. The result of the study showed
that the commercial ELISA (Virotech) was equivalent in sensitivity and specificity to the CFT in the
case of sera obtained in the acute phase of mycoplasmosis (90,7% of agreement of results in the class
IgA, 85,6% in the class IgG and 100% in the class IgM). Analytical specificity studied by screening
serum samples from patients with different bacterial infections and blood donors have shown lower
specificity of ELISA in compared to western-blotting. The present study confirmed the earlier observations of the high usefulness of P1 protein and P90 protein for reliable serologic diagnosis of acute
M. pneumoniae infection.
182
W. Rastawicki, N. Rokosz, M. Jagielski
Nr 2
PIŚMIENNICTWO
1. Biberfeld G. Antibodies to brain and other tissues in cases of Mycoplasma pneumoniae infection.
Clin Exp Immunol 1971; 8: 319-33.
2. Chandler DK, Olson LD, Kenimer JG i inni. Biological activities of monoclonal antibodies to
Mycoplasma pneumoniae membrane glycolipids. Infect Immun 1989; 57: 1131-6.
3. Dallo SF, Chavoya A, Su CJ, Baseman JB. DNA and protein sequence homologies between the adhesins of Mycoplasma genitalium and Mycoplasma pneumoniae. Infect Immun 1989; 57: 1059-65.
4. Duffy MF, Whithear KG, Noormohammadi AH i inni. Indirect enzyme-linked immunosorbent assay for
detection of immunoglobulin G reactive with a recombinant protein expressed from the gene encoding
the 116-kilodalton protein of Mycoplasma pneumoniae. J Clin Microbiol 1999; 37: 1024-9.
5. Ellison JS, Olson LD, Barile MF. Immunity and vaccine development. (w:) Mycoplasmas. Molecular Biology and Pathogenesis, red. Maniloff J.i inni. A.S.M., Washington, 1992, str. 491.
6. Hu PC, Cole RM, Huang YS i inni. Mycoplasma pneumoniae infection: role of a surface protein
in the attachment organelle. Science 1982; 216: 313-5.
7. Hu PC, Schaper U, Colier AM i inni. A Mycoplasma genitalium protein resembling the Mycoplasma pneumoniae attachment protein. Infect Immun 1987; 55: 1126-31.
8. Jacobs E., BuchholzA, Kleinmann B, Bredt W. Use of adherence protein of Mycoplasma pneumoniae
as antigen for enzyme-linked immunosorbent assay (ELISA). Isr J Med Sci, 1987; 23: 709-12.
9. Kałużewski S. Ocena przydatności wybranych testów serologicznych w diagnostyce zakażeń
wywołanych przez Mycoplasma pneumoniae. I. Antygen do odczynu wiązania dopełniacza. Med
Dośw Mikrobiol 1972; 24: 333-42.
10. Kenny GE, Newton RM. Close serological relationship between glycolipids of Mycoplasma
pneumoniae and glycolipids of spinach. Ann NY Acad Sci, 1973; 225: 54.
11. Lind K. Immunological relationships between Mycoplasma pneumoniae and Streptococcus MG.
Acta Path. Microbiol Scand 1968; 73: 237-44.
12. Lind K, Lindhardt BO, Schutten HJ i inni. Serological cross-reactions between Mycoplasma
genitalium and Mycoplasma pneumoniae. J Clin Microbiol 1984; 20: 1036-43.
13. Pönka A, Pönka T, Sarna S, Penttinen K. Questionable specificity of lipid antigen in the Mycoplasma pneumoniae complement fixation test in patients with extrapulmonary manifestations. J
Infect 1981; 3: 332-8.
14. Rastawicki W. Ocena przydatności odczynu western-immunoblotting do badania humoralnej
odpowiedzi na antygeny Mycoplasma pneumoniae w przebiegu naturalnego zakażenia u ludzi.
Med Dośw Mikrobiol 1996; 48: 39-48.
15. Rastawicki W, Jagielski M. Elektroforetyczna i immunologiczna analiza porównawcza komórkowych białek Mycoplasma pneumoniae i Mycoplasma genitalium. Med Dośw Mikrobiol 1998;
50: 259-67.
16. Razin S, Prescott B, James WD i inni. Production and properties of antisera to membrane glycolipids of Mycoplasma pneumoniae. Infect Immun 1971; 3: 420-3.
17. Rosen Klement ML, Öjemyr L, Tagscherer KE i inni. A processive lipid glycosyltransferase in the
small human pathogen Mycoplasma pneumoniae: involvement in host immune response. Mol
Microbiol 2007; 65: 1444-57.
18. Stevens MK, Krause DC. Disulfide-linked protein associated with Mycoplasma pneumoniae
cytoadherence. Infect Immun 1990; 58: 3430-3.
19. Varshney AK, Chaudhry R, Kabra SK, Malhotra P. Cloning, expression and immunological characterization of the P30 protein of Mycoplasma pneumoniae. Clin Vac Immunol 2008; 15: 215-20.
Otrzymano: 6 V 2009 r.
Adres Autora: 00-791 Warszawa, ul. Chocimska 24, Zakład Bakteriologii Narodowego Instytutu
Zdrowia Publicznego-Państwowego Zakładu Higieny