W NUMERZE
AKTUALNOŚCI
4–5
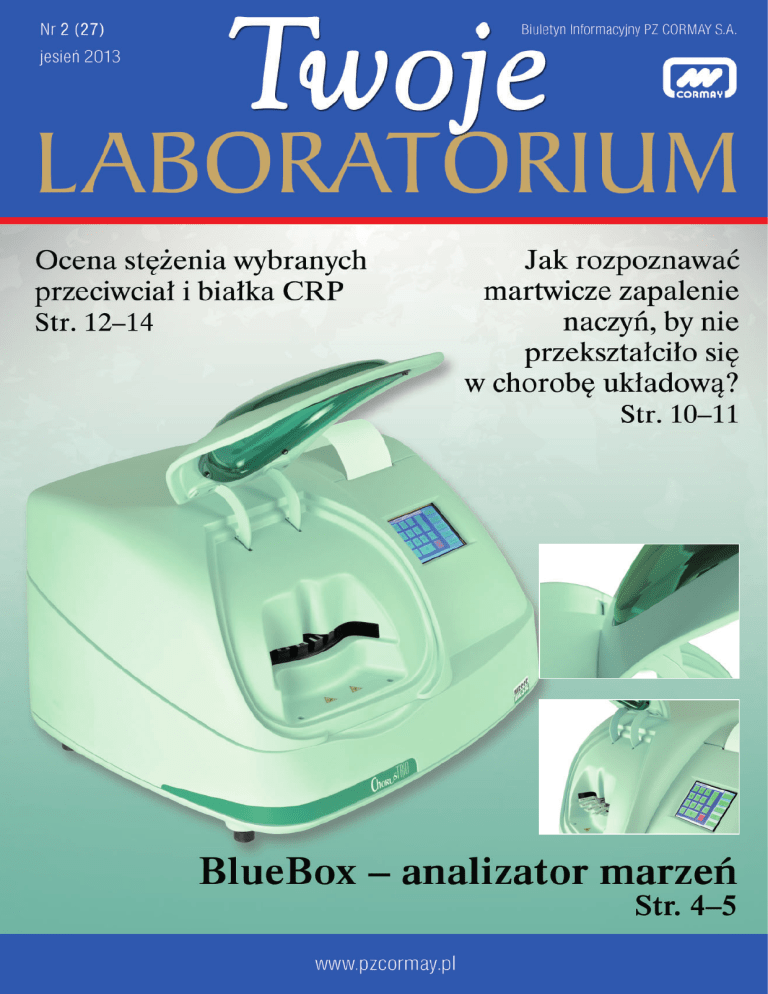
BlueBox – analizator marzeń
DIAGNOSTYKA NA ŚWIECIE
6–9
ANA – przeciwciała przeciwjądrowe
ANCA – przeciwciała przeciw cytoplazmie
10–11
granulocytów obojętnochłonnych
DIAGNOSTYKA POD LUPĄ
Ocena stężenia wybranych przeciwciał
12–14
i białka CRP
PRZYPADKI KLINICZNE
15
Postać skórna liszaja twardzinowego
Wydawca:
PZ Cormay SA
ul. Wiosenna 22
05-092 Łomianki
tel.: 22 751 79 10
faks: 22 751 79 11
e-mail: [email protected]
www.cormay.pl
2
Redakcja:
Redaktor naczelna
– Monika Dziachan – PZ Cormay SA
Redakcja i korekta – Agape
Współpraca:
Prof. dr n. med. Grażyna Sypniewska
Prof. nadzw. dr n. med. Helena Rotsztejn
Cała prawda w jednej kropli
Przygotowanie i produkcja:
Agape. Agencja doradcza i wydawnicza
ul. Lazurowa 183 lok. 3, 01-479 Warszawa
tel./faks: 22 886 62 26
e-mail: [email protected], www.agape.com.pl
Redakcja zastrzega sobie prawo do skracania
i redagowania publikowanych tekstów
Numer zamknięto: 9 września 2013 r.
Biuletyn Informacyjny PZ CORMAY
NA WSTĘPIE
Szanowni Pañstwo,
z wielk¹ przyjemnoœci¹ chcielibyœmy Pañstwa poinformowaæ
o naszych nowych rozwi¹zaniach w dziedzinie immunologii.
Dziêki innowacyjnemu analizatorowi immunochemicznemu
Chorus Trio mo¿emy Pañstwu zaoferowaæ kompleksowe rozwi¹zania dla niemal ka¿dego laboratorium analitycznego i mikrobiologicznego.
Chorus Trio to modu³owy analizator immunochemiczny, wykorzystuj¹cy metody immunoenzymatyczne do identyfikacji
przeciwcia³, antygenów i kompleksów immunologicznych w surowicy ludzkiej. Cechy wyró¿niaj¹ce nasz nowy analizator to:
Od teraz
oznaczenia przeciwciał
autoimmunologicznych mogą
w sposób pełni automatyczny
być wykonywane w każdym
laboratorium
diagnostyki laboratoryjnej, gdy¿ choroby autoimmunizacyjne
nale¿¹ do pierwszej trójki cywilizacyjnych zagro¿eñ ¿ycia ludzkiego.
pe³na automatyzacja oznaczeñ, mo¿liwoœæ wykonywania pojedynczych badañ, mo¿liwoœæ analizy wielu parametrów w jednym
czasie, dwie wiod¹ce linie produktowe w zakresie chorób autoimmunologicznych oraz infekcyjnych.
Chorus Trio stanowi doskona³¹ platformê, aby zmieniaæ
i podnosiæ rangê Pañstwa laboratoriów. Od teraz, uwa¿ane
za specjalistyczne oznaczenia przeciwcia³ autoimmunologicznych, mog¹ w sposób pe³ni automatyczny byæ wykonywane
w ka¿dym laboratorium. Jest to szczególnie wa¿na dziedzina
Nr 2 (27), jesień 2013
Zapraszam Pañstwa do lektury naszego kwartalnika, który
z uwagi na zawart¹ w nich wiedzê powinien znaleŸæ siê na biurku ka¿dego diagnosty laboratoryjnego i mikrobiologa, korzystaj¹cego z nowoczesnych rozwi¹zañ diagnostycznych. Proszê koniecznie zajrzeæ do dzia³u „Aktualnoœci”, aby dowiedzieæ siê
wiêcej na temat rewolucyjnego aparatu BlueBox.
Cała prawda w jednej kropli
Z wyrazami szacunku,
Dr S³awomir Blachowski
Dyrektor Sprzeda¿y Krajowej
3
AKTUALNOŚCI
BlueBox
– analizator marzeń
„Ośmieliliśmy się zmienić przyszłość. Rewolucja w biochemii”
pod takim hasłem, na zakończonych niedawno targach Clinical Lab
Expo w Houston, zaprezentowany został po raz pierwszy prototyp
rewolucyjnego analizatora krwi BlueBox. Chcieliśmy przybliżyć
podstawowe funkcjonalności sprzętu i pokazać jego innowacyjność.
nalizator BlueBox to w pe³ni automatyczny aparat w rozmiarze
point-of-care. Idealnie nadaje siê
do gabinetu lekarskiego, laboratorium, a nawet pracy mobilnej, bo nie potrzebuje pod³¹czenia do wody. W ci¹gu 8 minut wykonuje 21 testów. Do wykonania analizy potrzebuje tylko jednej kropli krwi (50 μl) i jeszcze
mniejsz¹ objêtoœæ odczynnika. Poza tym nie
wymaga ¿adnych materia³ów zu¿ywalnych
i akcesoriów. Nie generuje równie¿ p³ynnych
odpadów medycznych. Nie ma wiêc w¹tpliwoœci, ¿e to analizator marzeñ. Mo¿e niektórzy nawet o nim œnili. Wymyœlone
przed piêcioma laty has³o „Ca³a prawda
w jednej kropli” dziœ staje siê realne.
– Nasza obecnoœæ na targach AACC mia³a charakter business to business. Chcieliœmy
A
4
Cała prawda w jednej kropli
Biuletyn Informacyjny PZ CORMAY
AKTUALNOŚCI
Wymyślone przed pięcioma laty hasło „Cała
prawda w jednej kropli” dziś staje się realne
Nr 2 (27), jesień 2013
Cała prawda w jednej kropli
zaprezentowaæ innowacyjnoœæ produktow¹
naszego urz¹dzenia, zarówno pod wzglêdem
oferowanych funkcjonalnoœci, jak i interfejsu
u¿ytkownika. Zrealizowaliœmy postawione
cele. Nastêpnym krokiem bêdzie zorganizowanie warsztatów dla ostatecznych u¿ytkowników – powiedzia³ Tomasz Tuora, prezes
PZ CORMAY S.A.
Do analizatora przygotowane zosta³y zdefiniowane profile badañ. Ka¿dy z nich stanowi
odrêbny segment reakcyjny. Centrum dowodzenia to tablet, dziêki któremu zminimalizowaliœmy przestrzeñ, któr¹ w laboratorium bêdzie zajmowa³ aparat. Je¿eli chodzi o oprogramowanie to, wed³ug setki odwiedzaj¹cych
nasze stoisko, jest ono bardzo przyjazne i intuicyjne. Myœlê, ¿e wp³yw na opinie mia³a jego niebanalna szata graficzna.
– Projekt BlueBox jest obecnie na etapie
prototypu. Poszukujemy partnerów wœród najwiêkszych na œwiecie producentów urz¹dzeñ
medycznych i diagnostycznych. Na targach
American Association for Clinical Chemistry
w Houston spotkaliœmy siê z zainteresowaniem
wszystkich najwiêkszych firm z bran¿y. Z dwoma liderami mamy ju¿ umówione w paŸdzierniku kolejne spotkania w celu zaprezentowania
wszystkich funkcjonalnoœci BlueBoxa – doda³
prezes Tuora. Wspó³praca z globalnym partnerem ma u³atwiæ dotarcie z produktem do jak
najszerszej liczby odbiorów. Chodzi o to, by
BlueBox w krótkim czasie od debiutu znalaz³
siê w jak najwiêkszej liczbie gabinetów lekarskich. Rozpoczêcie produkcji ostatecznej wersji mo¿e ruszyæ, zdaniem prezesa, ju¿ na prze³omie 2014/2015 roku. Cormay jest w trakcie
realizacji inwestycji zwi¹zanej z budow¹ fabryki BlueBoxa, na któr¹ otrzyma³ dofinansowanie 20 mln z³. Wartoœæ ca³ego projektu wynosi
54 mln z³.
5
DIAGNOSTYKA NA ŚWIECIE
ANA – przeciwciała
przeciwjądrowe
Przeciwciała przeciwjądrowe (ANA) są autoprzeciwciałami skierowanymi przeciwko
podstawowym składnikom komórki, występującymi w różnych tkankach wielu gatunków
zwierząt. Z uwagi na fakt, że składniki antygenowe są zlokalizowane głównie w jądrze
komórkowym, reagujące z nimi autoprzeciwciała nazwano przeciwciałami
przeciwjądrowymi, a badanie mające na celu ich wykrycie – „badaniem ANA”.
prof. Gabriella Morozzi – jest profesorem
Reumatologii na Uniwersytecie w Sienie,
wykładowcą na Wydziale Reumatologii
i Immunologii Klinicznej, na studiach
licencjackich na kierunku Technik Laboratorium
Biomedycznego i na studiach magisterskich
na kierunku Medycyna i Chirurgia
oœæ czêsto zdarza siê, ¿e podczas
badania ANA zostaj¹ wykryte autoprzeciwcia³a znajduj¹ce siê w cytoplazmie, które nie mog¹ byæ okreœlone
mianem ANA, ale powinny byæ mimo
wszystko uwzglêdnione w wynikach. W niniejszej publikacji termin ANA zosta³ u¿yty
do okreœlenia przeciwcia³ wykrywalnych
metod¹ immunofluorescencji poœredniej
(IF), podczas gdy terminem anty-ENA
okreœlono ca³¹ grupê autoprzeciwcia³ skierowanych przeciwko antygenom j¹dra komórkowego i cytoplazmy, z wyj¹tkiem przeciwcia³ anty-dsDNA. Obecnoœæ przeciwcia³
ANA, wykrywalnych metod¹ IF, zosta³a
uznana w 1982 roku za jedno z kryteriów
klasyfikacji tocznia rumieniowatego uk³ado-
D
6
wego (SLE), o czu³oœci równej 99 proc.
i swoistoœci równej 49 proc.
Wykrycie przeciwcia³ ANA zaczê³o mieæ
olbrzymie znaczenie w diagnostyce SLE i innych chorób reumatycznych ju¿ w 1948 roku, kiedy to Hargraves i jego wspó³pracownicy opisali komórkê LE. W póŸniejszych latach badacze zdo³ali zidentyfikowaæ wiele
autoantygenów, takich jak dwuniciowe (natywne) DNA – dsDNA, ma³e rybonukleoproteiny, znane jako antygen Smith (Sm),
Scl-70 (topoizomeraza I), antygeny A i B
zespo³u Sjögrena (SSj), czyli SSA (Ro 52
kDa i Ro 60 kDa) i SSB (La-48 kDa),
U1-RNP i bia³ka centromeru, którym przypisywana jest rola markerów w diagnozie autoimmunizacyjnych uk³adowych chorób reumatycznych.
Z powodu niewielkiego wystêpowania
SLE w ogólnej populacji (50/100 000) dodatnia wartoœæ predykcyjna testu jest niska
(11 proc.). Oznacza to, ¿e wiêkszoœæ pacjentów z przeciwcia³ami ANA nie choruje
na SLE, a tym samym, dziêki wysokiej czu³oœci badania ANA, jego negatywny wynik
z du¿ym prawdopodobieñstwem wyklucza
Cała prawda w jednej kropli
chorobê. To samo dotyczy twardziny, poniewa¿ negatywny wynik badania ANA, charakteryzuj¹cego siê wysok¹ czu³oœci¹ (85
proc.), pozwala z du¿ym prawdopodobieñstwem wykluczyæ chorobê. Nie istnieje natomiast ¿adna zale¿noœæ pomiêdzy mianem
ANA i aktywnoœci¹ chorobow¹, jak i nie istnieje zale¿noœæ pomiêdzy mianem specyficznych ENA (Scl70, RNA pol. itp.) i aktywnoœci¹ chorobow¹. Obecnie badanie
ANA nie jest przydatne w diagnozie zapalenia wielomiêœniowego/zapalenia skórno-miêœniowego (PM/DM), ze wzglêdu na odpowiadaj¹ce im wartoœci czu³oœci i swoistoœci (odpowiednio 61 proc. i 63 proc.).
W tym wypadku, uzyskuj¹c negatywny wynik
badania, lekarz powinien wykonaæ dalsze
badania charakterystycznych autoprzeciwcia³. Z tego samego powodu badanie ANA
nie jest przydatne w diagnozie Zespo³u
Sjögrena – czu³oœæ (48 proc.), swoistoœæ
(52 proc.), podczas gdy w tym przypadku
bardziej znacz¹ca jest obecnoœæ pojedynczych ENA. Nie istniej¹ te¿ ¿adne Ÿród³a
zalecaj¹ce badanie ANA w monitorowaniu
choroby.
Biuletyn Informacyjny PZ CORMAY
DIAGNOSTYKA NA ŚWIECIE
Badanie ANA nie ma znaczenia w ustalaniu rozpoznania reumatoidalnego zapalenia
stawów i m³odzieñczego reumatoidalnego
zapalenia stawów (czu³oœæ – 57 proc., swoistoœæ – 39 proc.), ale jego pozytywny wynik
mo¿e byæ pomocny przy m³odzieñczym reumatoidalnym zapaleniu stawów w oszacowaniu ryzyka wyst¹pienia zapalenia b³ony naczyniowej (czu³oœæ – 80 proc., swoistoœæ
– 53 proc.).
Obserwacja szczególnego rozmieszczenia tych autoprzeciwcia³ w konkretnych chorobach tkanki ³¹cznej sprawia, ¿e s¹ one niezwykle wa¿ne dla lekarza, w zwi¹zku z czym
coraz czêœciej wykonuje siê badania na ich
wykrycie w celu ustalenia rozpoznania chorób reumatycznych.
DODATNIA
WARTOή PREDYKCYJNA
Prawdopodobieñstwo wystêpowania choroby u pacjenta, który uzyska³ wynik pozytywny w przeprowadzonym badaniu diagnostycznym, zale¿y od dok³adnoœci badania
(czu³oœæ i swoistoœæ) oraz od czêstoœci wystêpowania choroby.
BADANIE ANA
Z metodologicznego punktu widzenia,
postêpuj¹c zgodnie z w³oskimi i miêdzynarodowymi wytycznymi dotycz¹cymi oznaczania ANA, badanie powinno byæ przeprowadzone na surowicy krwi, zaczynaj¹c
od badania wstêpnego, tzn. korzystaj¹c
z metody immunofluorescencji poœredniej
na liniach komórkowych nab³onka ludzkiego
Hep-2 (linia komórkowa pochodz¹ca z nowotworu krtani), które charakteryzuj¹ siê
wiêksz¹ czu³oœci¹ i ró¿norodnoœci¹ typów
fluorescencji w porównaniu z komórkami
skrawków narz¹dów gryzoni. Komórki Hep2
charakteryzuj¹ siê du¿ymi rozmiarami j¹dra,
a preparaty na szkie³kach zawieraj¹ znaczn¹
liczbê komórek bêd¹cych w fazie podzia³u,
pomocnych w wykryciu antygenów o ró¿nym
poziomie ekspresji w zale¿noœci od fazy cyklu komórkowego.
W celu odró¿nienia autoimmunizacji charakterystycznej dla chorób tkanki ³¹cznej
od tej naturalnej, polispecyficznej, zwi¹zanej
z innymi sytuacjami, niezbêdne jest zastosowanie testów zdolnych do okreœlenia z wiêksz¹ dok³adnoœci¹ swoistoœci autoprzeciwcia³, odpowiedzialnej za pozytywny wynik badania ANA. W zwi¹zku z tym immunofluorescencja poœrednia, mimo i¿ stanowi podstawowe badanie przesiewowe w ustaleniu
obecnoœci ANA, musi zostaæ uzupe³niona innymi badaniami serologicznymi na obecnoœæ
swoistych antygenów, np.: podwójna immunodyfuzja (DID), immunoelektroforeza przeciwbie¿na, ELISA, immunoblot, western
blot, microarray itp.
Prawid³owa procedura metodologiczna, maj¹ca na celu wykrycie przeciwcia³
Nr 2 (27), jesień 2013
PRZECIWCIA£A ANTY-ENA
przeciwj¹drowych, powinna sk³adaæ siê z nastêpuj¹cych etapów:
1. Okreœlenie obecnoœci/braku ANA z wykorzystaniem metody IF na komórkach
Hep-2 na podstawie wyodrêbnionego typu fluorescencji i ewentualne miareczkowanie w punkcie koñcowym.
2. Okreœlenie swoistoœci autoprzeciwcia³ (anti-ENA), ograniczaj¹c siê do przypadków, co
do których uzyskano pozytywny wynik w badaniu przesiewowym ANA metod¹ IF i/lub
do przypadków wyodrêbnionych ze wzglêdu
na kliniczne podejrzenie SLE, tocznia noworodkowego, zespo³u Sjögrena, PM/DM,
MCTD, twardziny uk³adowej, stosuj¹c co
najmniej dwie metody o ró¿nej czu³oœci.
Rozró¿nia siê cztery podstawowe typy
fluorescencji: homogenny, ziarnisty, j¹derkowy i centromerowy, ale istniej¹ te¿ inne typy
fluorescencji j¹drowej i cytoplazmatycznej
oraz typy mieszane.
Niektóre typy fluorescencji j¹drowej odpowiadaj¹ konkretnym antygenom, przeciwko którym skierowane s¹ przeciwcia³a.
Warto wiedzieæ, i¿ na etapie diagnostycznym wykrycie tych autoprzeciwcia³
w niewielkich stê¿eniach (<1:320) nie ma
znaczenia klinicznego, bior¹c pod uwagê
fakt, ¿e ANA mog¹ byæ obecne u osób starszych, kobiet w ci¹¿y lub kobiet stosuj¹cych
doustn¹ antykoncepcjê hormonaln¹, jak
równie¿ w innych sytuacjach chorobowych.
W zwi¹zku z tym zwykle tylko ANA, obec-
ANTY-SSA/RO
Uk³ad SS-A/SS-B jest zazwyczaj okreœlany jako heterogeniczny kompleks antygenowy,
sk³adaj¹cy siê z trzech ró¿nych bia³ek:
SS-A/Ro 52 Da, SS-A/Ro 60 kDa i SS-B/La 48
kDa, skompleksowanych z czterema mo¿liwymi ma³ymi cz¹steczkami rozpuszczalnego
RNA, gatunkowo swoistymi.
W oko³o po³owie surowic krwi, daj¹cych
pozytywny wynik w badaniu na wykrycie
anty-Ro/SS-A, obecne s¹ przeciwcia³a skierowane przeciw obydwu bia³kom. Ich wykrywalnoœæ przy uk³adowych chorobach tkanki
³¹cznej zale¿y po czêœci od zastosowanej
metody badania, poniewa¿ ró¿ne metody
charakteryzuj¹ siê ró¿n¹ czu³oœci¹.
Fluorescencja homogenna, np. natywne DNA (dsDNA)
Fluorescencja cytoplazmatyczna ziarnista, np. Jo-1
Fluorescencja centromerowa
Przeciwciała przeciw centromerom
Fluorescencja jąderkowa
ne w stê¿eniach œrednio-wysokich (>1:320
lub nawet >1:640), w po³¹czeniu z okreœlonymi typami fluorescencji mog¹ wskazywaæ na wystêpowanie konkretnej choroby
i mog¹ byæ podstaw¹ do przeprowadzenia
dalszych badañ na wykrycie swoistych antygenów.
W populacji kontrolnej przeciwcia³a te
wystêpuj¹ u 2 proc. pacjentów zdrowych.
Najczêœciej spotykanymi chorobami zale¿nymi s¹: pierwotny zespó³ Sjögrena (70–80
proc. przypadków), SLE (40–60 proc. przypadków), wtórny zespó³ Sjögrena (9–18
proc. przypadków). Nie wykazano ¿adnego
Cała prawda w jednej kropli
Wiele spoœród autoprzeciwcia³ daj¹cych
fluorescencjê ziarnist¹ w badaniu ANA skierowanych jest przeciwko rozpuszczalnym
antygenom j¹dra komórkowego (ENA). Termin ENA, który by³ pocz¹tkowo stosowany
do okreœlenia dwóch konkretnych antygenów
(Sm i RNP), odnosi siê aktualnie do szerokiej
grupy swoistych przeciwcia³ j¹drowo-cytoplazmatycznych. Niemniej jednak zestaw rutynowych badañ, maj¹cych na celu wykrycie
anty-ENA w uk³adowych chorobach tkanki
³¹cznej, obejmuje zazwyczaj szeœæ specyficznych przeciwcia³: anty-SSA/Ro, anty-SSB/La, anty-Sm, anty-RPN, anty-Scl70,
anty-Jo1.
7
DIAGNOSTYKA NA ŚWIECIE
znaczenia okresowej kontroli stê¿eñ przeciwcia³, poniewa¿ ich wahania nie odzwierciedlaj¹ zmian aktywnoœci chorobowej.
Przeciwcia³a anty-Ro w surowicy krwi
matki u pacjentek z chorobami reumatycznymi, niezale¿nie od stopnia ciê¿koœci choroby,
mog¹ przenikaæ przez ³o¿ysko, powoduj¹c
– pocz¹wszy od 17. tygodnia ci¹¿y – rozwój
tocznia noworodkowego, którego g³ównym
objawem klinicznym jest wrodzony ca³kowity
blok przedsionkowo-komorowy, z czêstoœci¹
wystêpowania równ¹ 2 proc. u pacjentek
z SLE i pozytywnym wynikiem w badaniu
na obecnoϾ SSA/Ro.
Z uwagi na fakt, ¿e tylko u niektórych noworodków matek z pozytywnym wynikiem
w badaniu na obecnoϾ anty-Ro i/lub anty-La
stwierdza siê toczeñ noworodkowy, przyjmuje
siê tezê, ¿e przeciwcia³a te s¹ elementem niezbêdnym, ale niewystarczaj¹cym do rozwoju
choroby. Toczeñ noworodkowy jest chorob¹
rzadko spotykan¹ równie¿ wœród noworodków pacjentek z SLE i z pozytywnym wynikiem w badaniu na obecnoœæ anty-Ro. Niemniej jednak zaleca siê przeprowadzenie badania na obecnoœæ anty-Ro u pacjentek planuj¹cych ci¹¿ê oraz kontrolê w trakcie ci¹¿y.
ANTY-SSB/LA
Antygen La/SSB sk³ada siê z cz¹steczek
RNA zwi¹zanych z fosfoprotein¹ o ciê¿arze
cz¹steczkowym 48 kDa. G³ówn¹ cech¹ charakterystyczn¹ tego antygenu jest niska
trwa³oœæ wi¹zania i wyj¹tkowa sk³onnoœæ
do proteolizy, z produkcj¹ charakterystycz-
Prawdopodobieństwo występowania choroby
u pacjenta, który uzyskał wynik pozytywny
w przeprowadzonym badaniu diagnostycznym,
zależy od dokładności badania
oraz od częstości występowania choroby
nych fragmentów o ciê¿arze cz¹steczkowym 43 kDa i 28 kDa. Równie¿ przeciwcia³a anty-SSB s¹ przeciwcia³ami poliklonalnymi, nale¿¹cymi g³ównie do klasy IgG, które
rozpoznaj¹ ró¿ne epitopy na cz¹steczce
bia³ka, w wiêkszoœci przypadków liniowe,
ale równie¿ konformacyjne. Podczas gdy
anty-Ro mog¹ wystêpowaæ samodzielnie,
anty-SS-B wystêpuj¹ prawie zawsze w po³¹czeniu z cz¹steczk¹ SS-A (75 proc.).
Obecnoœæ anty-SSB ³¹czy siê z wystêpowaniem pierwotnego i wtórnego zespo³u
Sjögrena z czêstoœci¹ 30–60 proc. W SLE
s¹ obecne w 15 proc. przypadków,
a w zdrowej populacji kontrolnej czêstoœæ
wystêpowania jest praktycznie zerowa.
8
ANTY-SM
Ich obecnoœæ u pacjentów z SLE waha siê
od 5 do 30 proc., w zale¿noœci od wybranej
metody badania i pochodzenia etnicznego
populacji. Wystêpuj¹ bowiem czêœciej u pacjentów rasy czarnej i azjatyckiej, a rzadziej
u pacjentów rasy bia³ej. Stanowi¹ jedno
z kryteriów klasyfikacji SLE opracowanej
przez Amerykañskie Towarzystwo Reumatologiczne. Antygen Sm jest czêœci¹ spliceosomu, makrocz¹steczkowego kompleksu odpowiedzialnego za mechanizm, dziêki któremu niekoduj¹ce sekwencje pre-mRNA s¹
wycinane w celu uzyskania funkcjonalnego
mRNA. Antygen sk³ada siê z dziewiêciu ró¿nych polipeptydów o ciê¿arze cz¹steczkoCała prawda w jednej kropli
wym mieszcz¹cym siê w przedziale od 9 do
29,5 kDa (B1, B', B3, D1, D2, D3, E, F i G).
Zazwyczaj polipeptydy B i D stanowi¹ g³ówny cel w odpowiedzi autoimmunizacyjnej
na antygen Sm.
ANTY-RNP
S¹ obecne w znacznym stopniu przy mieszanej chorobie tkanki ³¹cznej (95 proc.) i stanowi¹ kryterium jej rozpoznania, ale spotykane s¹ równie¿ przy SLE (30–40 proc. przypadków) i przy twardzinie. Cech¹ charakterystyczn¹ przy mieszanej chorobie tkanki ³¹cznej
jest wysokie miano przeciwcia³.
Obecnoœæ przeciwcia³ anty-U1-RPN,
wystêpuj¹cych u 60 proc. pacjentów z pozytywnym wynikiem w badaniu na obecnoœæ
anty-RNP i z uk³adowymi chorobami reumatycznymi, oraz charakteryzuj¹cych siê reaktywnoœci¹ na polipeptyd 70 kD i mniejsz¹
czêstotliwoœci¹ wzglêdem bia³ka A, jest zazwyczaj powi¹zana z wystêpowaniem objawu Raynauda.
ANTY-SCL70
Przeciwcia³a przeciw topoizomerazie I lub anty-Scl70 s¹, obok przeciwcia³
przeciw centromerom i anty-RNA przeciw
polimerazie I–III, przeciwcia³ami najczêBiuletyn Informacyjny PZ CORMAY
DIAGNOSTYKA NA ŚWIECIE
œciej wystêpuj¹cymi w surowicy krwi pacjentów z twardzin¹ uk³adow¹ – przeciwcia³a te wykluczaj¹ siê wzajemnie. Anty-Scl70 i przeciwcia³a przeciw polimerazie
³¹cz¹ siê zazwyczaj z rozleg³ymi zmianami
skórnymi, podczas gdy przeciwcia³a przeciw centromerom ³¹cz¹ siê z twardzin¹
w postaci ograniczonej. Funkcj¹ enzymu
topoizomerazy I jest zmiana struktury superhelikalnej natywnego DNA poprzez mo-
PRZECIWCIA£A PRZECIW
CENTROMEROM
W surowicy krwi pacjentów z twardzin¹
uk³adow¹ w postaci ograniczonej czêsto obecne s¹ autoprzeciwcia³a skierowane przeciwko
bia³kom centromeru. G³ównymi autoantygenami s¹: CENP-A (17-19,5 kDa), CENP-B
(80 kDa) i CENP-C (140 kDa). Wyodrêbniono równie¿ inne bia³ka centromeru, takie jak
CENP-D, CENP-E i CENP-F, ale wi¹¿e siê je
Istnieją autoprzeciwciała odkryte dopiero
w ostatnich latach, w odniesieniu do których
nie istnieje żadna międzynarodowa
interpretacja naukowa
dyfikacjê stopnia skrêcenia podwójnej helisy bez wp³ywu na sekwencjê aminokwasów.
Jest on zlokalizowany w nukleoplazmie,
w j¹derku i chromosomach w trakcie mitozy. Takie rozmieszczenie t³umaczy szczególny typ fluorescencji w badaniu ANA:
homogenny i j¹derkowy. Przeciwcia³a anty-Scl70 sk³adaj¹ siê ze wszystkich podklas
IgG, z IgA, i w mniejszym stopniu z IgM.
U pacjentów z pozytywnym wynikiem w badaniu na obecnoœæ przeciwcia³ rokowanie
jest bardziej powa¿ne z uwagi na ich czêste
powi¹zanie z niewydolnoœci¹ serca wtórn¹
do chorób p³uc oraz na ich zwi¹zek z twardzinow¹ kryz¹ nerkow¹, wykryty w odniesieniu do w³oskich pacjentów. Czu³oœæ
i swoistoϾ kliniczna to odpowiednio
20 proc. i 100 proc., przez co przeciwcia³a te odgrywaj¹ wa¿n¹ rolê w rozpoznaniu
twardziny uk³adowej. W œwietle dzisiejszej
wiedzy wydaje siê natomiast, ¿e okresowa
kontrola stê¿eñ przeciwcia³ nie ma ¿adnego
znaczenia.
ANTY-JO1
Przeciwcia³a anty-Jo1 (hitidyl-tRNA synthetase) stanowi¹ swoisty marker dla pacjentów z zapaleniem miêœni o charakterze idiopatycznym. Antygen Jo1 jest enzymem o ciê¿arze cz¹steczkowym równym
55 kDa, znajduj¹cym siê zarówno w j¹drze, jak i w cytoplazmie. Obecnoœæ przeciwcia³ anty-Jo1 i/lub przeciwcia³ przeciw
innym syntetazom (np. -PL-7, -PL-12 itp.)
jest charakterystyczna dla zespo³u antysyntetazowego, rozpoczynaj¹cego siê w sposób ostry i objawiaj¹cego siê zw³óknieniami
œródmi¹¿szowymi p³uc, zapaleniem miêœni,
gor¹czk¹, zapaleniem wielostawowym, objawem Raynauda i wysok¹ odpornoœci¹
na leczenie.
Nr 2 (27), jesień 2013
z innymi jednostkami chorobowymi. Spoœród
tych bia³ek znane jest znaczenie CENP-E
(312 kDa) jako bia³ka motorycznego zwi¹zanego z mikrotubulami oraz CENP-F (367 kDa),
inaczej zwanego mitozyn¹, które prawdopodobnie odgrywa kluczow¹ rolê w regulacji
podzia³u komórkowego, nabieraj¹c znaczenia
markera proliferacji komórek z³oœliwych.
W badaniu ANA anty-CENP-A, -B, -C
powoduj¹ fluorescencjê typu centromerowego, czyli ziarniste œwiecenie j¹der komórek
w interfazie i œwiecenie komórek w metafazie
w okolicy centromerów. Ma³o prawdopodobna jest obecnoœæ przeciwcia³ przeciw
centromerom przy braku objawu Raynauda,
niezale¿nie od wystêpowania chorób tkanki
³¹cznej. Czêstoœæ wystêpowania przeciwcia³
przy pierwotnym objawie Raynauda wynosi
20v, podczas gdy w zdrowej populacji jest
ona praktycznie zerowa.
PRZECIWCIA£A ANTY-DNA
Autoprzeciwcia³a anty-dsDNA i autoprzeciwcia³a przeciw chromatynie s¹ g³ównymi przeciwcia³ami odpowiedzialnymi za homogenn¹/obwodow¹ fluorescencjê j¹der komórkowych, obserwowan¹ na Hep2. Czasami mog¹ jednak powodowaæ równie¿ fluorescencjê ziarnist¹ lub cytoplazmatyczn¹, zwi¹zan¹ prawdopodobnie z przeciwcia³ami anty-DNA reaguj¹cymi krzy¿owo z RNA. Podczas gdy przeciwcia³a przeciw DNA jednoniciowemu wystêpuj¹ przy ró¿nych jednostkach chorobowych, zarówno reumatycznych,
jak i innych, przeciwcia³a anty-nDNA, szczególnie, jeœli maj¹ wysokie miano, wystêpuj¹
prawie wy³¹cznie przy SLE, przez co maj¹
du¿e znaczenie diagnostyczne.
W celu wykrycia przeciwcia³ anty-DNA
stosuje siê zazwyczaj jedn¹ z trzech ró¿ni¹cych siê miêdzy sob¹ metod:
Cała prawda w jednej kropli
1. Immunofluorescencja poœrednia na Crithidia Luciliae, metoda nieiloœciowa, charakteryzuj¹ca siê du¿¹ swoistoœci¹, pozwalaj¹ca na wykrycie przeciwcia³ o niskim lub
wysokim powinowactwie.
2. Metoda immunoenzymatyczna, iloœciowa
i czu³a, pozwalaj¹ca na wykrycie przeciwcia³ o niskim lub wysokim powinowactwie.
3. Technika Farra, opieraj¹ca siê na precypitacji kompleksów immunologicznych
w siarczanie amonu; wykorzystuj¹ca radioaktywne DNA, wysoce czu³a i iloœciowa, pozwalaj¹ca na wykrycie przeciwcia³
o wysokim powinowactwie.
Anty-nDNA mog¹ byæ bez w¹tpienia
uznane za wysoce swoiste markery SLE,
a ich oznaczenie ma du¿e znaczenie kliniczne. Niemniej jednak poprawna ocena wyniku
wymaga dok³adnej znajomoœci ograniczeñ
i w³aœciwoœci metody zastosowanej w celu
ich oznaczenia. Zgodnie z powszechn¹ opini¹ wzrost miana anty-nDNA, przy obni¿onym poziomie dope³niacza, mo¿e wskazywaæ na rozwijaj¹ce siê uszkodzenie nerek.
Reasumuj¹c, pomimo nieswoistoœci ANA/
ENA, obecnoœæ danych autoprzeciwcia³ ma
du¿e znaczenie diagnostyczne w odniesieniu do niektórych chorób. Na przyk³ad
obecnoœæ przeciwcia³ anty-dsDNA i/lub
anty-Sm mo¿e wskazywaæ prawie wy³¹cznie
na SLE. W przypadku SLE indukowanego lekami u ponad 95 proc. pacjentów obserwuje
siê homogenny typ fluorescencji ANA, który
³¹czy siê z obecnoœci¹ przeciwcia³ antyhistonowych, bêd¹cych jedynymi przeciwcia³ami.
Wy³¹czna obecnoœæ przeciwcia³ anty-RNP
o wysokim mianie wskazuje na mieszan¹
chorobê tkanki ³¹cznej. Wiedza na temat poszczególnych profili autoprzeciwcia³, charakterystycznych dla danych chorób reumatycznych zwi¹zanych z ANA, jest wiêc niezwykle
istotna. Z drugiej strony nie mo¿na lekcewa¿yæ faktu, i¿ wiele autoprzeciwcia³ mo¿e byæ
obecnych w surowicy krwi pacjentów kilka lat
przed pojawieniem siê objawów klinicznych
choroby. Z tego wzglêdu laboratoria immunologiczne odgrywaj¹ szczególnie istotn¹
rolê.
Ponadto istniej¹ autoprzeciwcia³a odkryte dopiero w ostatnich latach, w odniesieniu do których nie istnieje, jak dot¹d,
¿adna miêdzynarodowa interpretacja naukowa, a co za tym idzie, nie wchodz¹ one
w sk³ad badañ rutynowych. Prowadzone s¹
na przyk³ad dyskusje na temat roli przeciwcia³ przeciw nukleosomom w rozwoju
i przebiegu SLE, przydatnoœci pomiaru
stê¿enia przeciwcia³ przeciw rybosomom,
które wydaj¹ siê mieæ zwi¹zek z niektórymi objawami klinicznymi tocznia, oraz
na temat przeciwcia³ przeciw sk³adowej
dope³niacza C1q i jej mo¿liwej roli jako
wskaŸnika aktywnoœci procesu chorobowego w nerkach.
9
DIAGNOSTYKA NA ŚWIECIE
ANCA – przeciwciała
przeciw cytoplazmie
granulocytów obojętnochłonnych
Martwicze zapalenie naczyń, obejmujące małe naczynia, jest rzadką chorobą, która
w ostrych przypadkach może zagrażać życiu pacjenta. Z tego powodu bardzo ważne
jest jej wczesne rozpoznanie, zanim zdąży się przekształcić w chorobę układową.
rzeciwcia³a przeciw cytoplazmie granulocytów obojêtnoch³onnych (ANCA)
odgrywaj¹ znacz¹c¹ rolê w procesach
immunozapalnych zachodz¹cych w tkankach, bêd¹cych przyczyn¹ uszkodzenia naczyñ, charakterystycznych dla idiopatycznego zapalenia.
P
JAK
ZBADAÆ ICH OBECNOŒÆ ?
Podstawowym wskazaniem do wykonania badania na obecnoœæ ANCA jest kliniczne podejrzenie zapalenia naczyñ. Dla
celów praktyki klinicznej, podczas Konferencji konsensusu w Chapel Hill w 1992
roku, usystematyzowano nazewnictwo
zwi¹zane z zapaleniami naczyñ, które stosowane jest do dziœ. Zgodnie z przyjêtymi
kryteriami ANCA wystêpuj¹ g³ównie w su-
10
rowicy krwi pacjentów z ziarniniakiem Wegenera, mikroskopowym zapaleniem naczyñ i zespo³em Churga-Strauss, rzadziej
u pacjentów z innymi zapaleniami ma³ych
naczyñ, takimi jak choroba Schönleina-Henocha, krioglobulinemia i leukocytoklastyczne zapalenie naczyñ skóry. Istnienie
swoistych autoprzeciwcia³ skierowanych
przeciwko granulocytom obojêtnoch³on-
nym zosta³o opisane ju¿ pod koniec
lat 50., ale dopiero podczas pierwszej
Miêdzynarodowej konferencji ANCA, zorganizowanej w Kopenhadze w 1988 roku,
zdefiniowano podstawowy antygen ANCA,
wykryty u pacjenta z ziarniniakiem Wegenera, czyli proteinazê 3 (PR3). PR3 jest proteinaz¹ serynow¹ o ciê¿arze cz¹steczkowym
równym 29–30 kDa, znajduj¹c¹ siê w gra-
ANCA odgrywają znaczącą rolę
w procesach immunozapalnych
zachodzących w tkankach
Cała prawda w jednej kropli
Biuletyn Informacyjny PZ CORMAY
DIAGNOSTYKA NA ŚWIECIE
Nie zawsze udaje się zaklasyfikować
obraz uzyskany w badaniu metodą
immunofluorescencji pośredniej do jednej
z dwóch klas, P-ANCA lub C-ANCA
nulocytach azurofilnych. Podczas 2. Miêdzynarodowej Konferencji ANCA, która odby³a siê w Holandii w 1989 roku, okreœlono
charakterystyczne typy fluorescencji C-ANCA
i P-ANCA. Nazwê „C-ANCA” nadano fluorescencji typu cytoplazmatycznego, o charakterze ziarnistym, a nazwê „P-ANCA”
– fluorescencji oko³oj¹drowej. Obrazy uzyskano metod¹ immunofluorescencji poœredniej (IF) na granulocytach/monocytach
utrwalonych etanolem.
A
RÓ¯NICE MIÊDZY P-ANCA
C-ANCA
Fluorescencja P-ANCA jest wynikiem
przemieszczania siê bia³ek kationowych, zawartych w ziarnistoœciach granulocytów
obojêtnoch³onnych, w kierunku struktur
anionowych komórki, takich jak j¹dro, w wyniku utrwalenia komórek etanolem.
W 1988 roku Falk i Jennette opublikowali
pierwsze badania nad mieloperoksydaz¹
ANCA (MPO), wykryt¹ w surowicy krwi pacjentów z uk³adowym martwiczym zapaleniem
naczyñ. Od tamtego czasu w wielu innych badaniach potwierdzono obecnoœæ tych przeciwcia³ w surowicy krwi pacjentów, g³ównie tych
z objawami klinicznymi w obrêbie nerek i p³uc.
Podczas gdy fluorescencja C-ANCA jest
spowodowana g³ównie przez obecnoœæ
przeciwcia³ skierowanych przeciw PR3 (rzadziej równie¿ przeciw BPI i MPO), fluorescencja P-ANCA mo¿e byæ wynikiem obecnoœci wielu ró¿nych hydrofilowych bia³ek
kationowych, takich jak MPO, elastaza, lizozym, azurocydyna, katepsyna G i laktofery-
na. Niekiedy, z niejasnych dot¹d powodów,
MPO-ANCA mo¿e powodowaæ fluorescencjê typu C-ANCA.
Jeœli komórki s¹ utrwalone formalin¹,
a nie etanolem, fluorescencja typu P-ANCA,
spowodowana przemieszczaniem siê bia³ek
kationowych (MPO) w kierunku j¹dra komórkowego, staje siê z powrotem fluorescencj¹ typu C-ANCA, poniewa¿ formalina
blokuje bia³ka, zapobiegaj¹c ich przemieszczaniu siê.
Jeœli w badaniu metod¹ immunofluorescencji poœredniej (IF) wyka¿e siê fluorescencjê typow¹ dla przeciwcia³ przeciw cytoplazmie granulocytów obojêtnoch³onnych
(P-ANCA lub C-ANCA), powinno siê wykonaæ dalsze badanie w celu okreœlenia antygenu, bêd¹cego celem przeciwcia³, najlepiej
za pomoc¹ standaryzowanego testu ELISA
lub podobnej metody.
A-ANCA
PRZECIWCIA£A PRZECIW
PROTEINAZIE 3 (C-ANCA)
Przeciwciała te charakteryzują się swoistością powyżej 95 proc. i czułością ok. 90 proc. przy ziarniniaku
Wegenera. W początkowych stadiach choroby
ok. 2/3 pacjentów uzyskuje wynik pozytywny w badaniu na obecność anty-PR3, a pozytywność ta
wzrasta proporcjonalnie do występujących objawów
układowych. Zazwyczaj poziom autoprzeciwciał
w surowicy pozostaje we współzależności z aktywnością chorobową, przez co oznaczenie anty-PR3
może być pomocne nie tylko w ustaleniu rozpoznania, ale również w monitorowaniu choroby.
PRZECIWCIA£A PRZECIW
MIELOPEROKSYDAZIE (P-ANCA)
Około 80 proc. pacjentów z mikroskopowym zapaleniem naczyń i do 70 proc. pacjentów z zespołem
Churga-Strauss uzyskuje pozytywny wynik w badaniu na obecność anty-MPO. Z uwagi na fakt, że odróżnienie objawów klinicznych mikroskopowego zapalenia naczyń od objawów występujących przy innych autoimmunizacyjnych chorobach dotyczących
nerek i płuc (zespół Goodpasture’a, SLE, ziarniniak
Wegenera) jest zazwyczaj dość trudne, oznaczenie
przeciwciał anty-MPO jest wyjątkowo ważne w rozpoznaniu tej choroby.
ALTERNATYW¥
Nie zawsze jednak udaje siê zaklasyfikowaæ obraz uzyskany w badaniu metod¹ immunofluorescencji poœredniej do jednej
z dwóch klas, P-ANCA lub C-ANCA. Z tego powodu stworzono klasê „A-ANCA” odpowiadaj¹c¹ „atypowym ANCA”. Nietypowe
rodzaje fluorescencji s¹ wynikiem reakcji
przeciwcia³ z ró¿nymi autoantygenami znajduj¹cymi siê w granulocytach obojêtnoch³onnych. Ten rodzaj ANCA wystêpuje
czêsto przy innych przewlek³ych chorobach
zapalnych, takich jak reumatoidalne zapalenie stawów, wrzodziej¹ce zapalenie jelita
grubego, stwardniaj¹ce zapalenie dróg ¿ó³-
ciowych, przewlek³e aktywne zapalenie w¹troby itp., z których wszystkie charakteryzuj¹ siê sta³ym procesem gromadzenia siê
granulocytów obojêtnoch³onnych i monocytów w miejscu zmian chorobowych. W przypadku tych chorób, w badaniu metod¹ immunofluorescencji poœredniej (IF), przeciwcia³a powoduj¹ fluorescencjê podobn¹ do
„P-ANCA”, przy jednoczesnym braku swoistoœci zwi¹zanej z zapaleniami naczyñ
(MPO, PR3). Z tego powodu nale¿y zawsze
przeprowadzaæ jednoczeœnie dwa rodzaje badañ laboratoryjnych na oznaczenie ANCA,
tzn. IF i ELISA.
Tabela nr 1
Autoantygen
Choroba
P-ANCA
MPO
Mikroskopowe zapalenie naczyń, zespół Churga-Strauss
Laktoferyna
Wrzodziejące zapalenie jelita grubego, pierwotne stwardniające zapalenie
dróg żółciowych, reumatoidalne zapalenie naczyń
Lizozym
Wrzodziejące zapalenie jelita grubego, reumatoidalne zapalenie naczyń
Katepsyna G
Toczeń rumieniowaty układowy, zespół Sjögrena
Elastaza
Reumatoidalne zapalenie stawów
C-ANCA
PR3
Nr 2 (27), jesień 2013
Ziarniniak Wegenera
Cała prawda w jednej kropli
11
DIAGNOSTYKA POD LUPĄ
Ocena stężenia wybranych
przeciwciał i białka CRP
u chorych na reumatoidalne zapalenie stawów
w zależności od stopnia zaawansowania choroby
Reumatoidalne zapalenie stawów (RZS) jest najczęstszą chorobą zapalną stawów, w której
dochodzi do postępującej destrukcji struktur stawowych. Dlatego też poszukuje się czułych
i swoistych markerów, które byłyby przydatne w monitorowaniu przebiegu choroby.
Magdalena Kuligowska-Prusińska1, Grażyna
Odrowąż-Sypniewska1, Danuta Grodzka2,
Magdalena Krintus1, Marcin Sawicki1
eumatoidalne zapalenie stawów
(RZS) jest uk³adow¹ chorob¹ autoimmunologiczn¹, któr¹ charakteryzuje
przewlek³y, postêpuj¹cy proces zapalny, wystêpuj¹cy pocz¹tkowo w b³onie maziowej
stawów, a w konsekwencji prowadz¹cy do destrukcji stawów i upoœledzenia ich czynnoœci(1). W przebiegu
choroby
R
12
czêsto dochodzi tak¿e do licznych zmian pozastawowych i powik³añ narz¹dowych. Dlatego u chorych na RZS wa¿ne jest sta³e monitorowanie aktywnoœci choroby(2). Od lat trwaj¹ poszukiwania specyficznego markera serologicznego, który pozwoli³by na prognozowanie jej przebiegu. W 2002 roku Visser
i wsp.(3) opracowali zestaw kryteriów prognostycznych, do których w³¹czono obecnoœæ
przeciwcia³ przeciw cyklicznemu cytrulinowanemu peptydowi (anty-CCP), opisywanych w literaturze jako „idealny” marker reumatoidalnego zapalenia stawów ze wzglêdu
na wysok¹ czu³oœæ i specyficznoœæ. Dowodzi
siê zatem, ¿e okreœlenie poziomu przeciwcia³ anty-CCP mo¿e byæ wartoœciowym
wskaŸnikiem predykcyjnym aktywnej, nad¿erkowej postaci choroby, a w skojarzeniu
z oznaczaniem RF IgM mo¿e
przyczyniæ siê do selekcji
chorych wymagaj¹cych
wczesnego agresywnego leczenia farmakologicznego(4).
Celem
pracy by³a
ocena stê¿enia wybranych autoprzeciwcia³ (anty-CCP, RF IgM i IgG)
i bia³ka C-reaktywnego, oznaczonego metod¹ o wysokiej czu³oœci,
u chorych na reumatoidalne zapalenie stawów
w ró¿nych stadiach zaawansowania procesu chorobowego.
Cała prawda w jednej kropli
MATERIA£
I METODY
PACJENCI
Badaniem objêto grupê 75 pacjentów
(68 kobiet i 7 mê¿czyzn) w wieku 25–80 lat
z rozpoznanym reumatoidalnym zapaleniem
stawów (RZS) oraz 26 osób zdrowych (17
kobiet i 9 mê¿czyzn) w wieku 28–60 lat.
Rozpoznanie choroby zosta³o postawione
przez lekarzy reumatologów na podstawie
ustalonych kryteriów ARA/ACR obejmuj¹cych objawy kliniczne, zmiany radiologiczne
i obecnoϾ/brak czynnika reumatoidalnego.
Pacjentów z RZS podzielono wed³ug kryteriów Steinbrockera uwzglêdniaj¹cych cztery
okresy zaawansowania choroby: I° (wczesny)
– 11 chorych, II° (umiarkowany) – 35, 111°
(ciê¿ki) – 21 i IV° (koñcowy) – 8 chorych.
U wiêkszoœci pacjentów stosowano farmakoterapiê, tj. leki modyfikuj¹ce przebieg choroby, czyli LMPCh (metotreksat, sulfasalazynê,
arechinê, sole z³ota), niesteroidowe leki
przeciwzapalne, czyli NLPZ (Diclac, Dicloratio, Diclo Duo, Naklofen, Ketonal, Profenid,
Piroxicam, Meloksam) oraz glikokortykosteroidy (Encorton, Metypred). 13 badanych
by³o leczonych LMPCh przez 2 miesi¹ce
do 25 lat, a 10 chorych NLPZ przez 8 miesiêcy do 14 lat. Leczenie skojarzone by³o
stosowane u 11 pacjentów przez okres
3 miesiêcy do 20 lat (LMPCh i NLPZ), u 19
chorych (LMPCh i glikokortykosteroidy)
i 9 badanych (LMPCh, glikokortykosteroidy
i NLPZ) przez 1 miesi¹c do 30 lat.
Badania wykonano w surowicy krwi pobranej od pacjentów, w warunkach standardowych. Surowicê przechowywano w temperaturze – 70°C do czasu wykonania oznaczeñ.
W badanym materiale oznaczono testami
ELISA stê¿enie przeciwcia³ przeciw cyklicznemu cytrulinowanemu peptydowi (anty-CCP)
Biuletyn Informacyjny PZ CORMAY
DIAGNOSTYKA POD LUPĄ
(EUROIMMUN), czynników reumatoidalnych
w klasie M (RF IgM) i G (RF IgG) (IMTEC Immunodiagnostica GmbH) oraz poziom bia³ka C-reaktywnego (CRP) metod¹ immunonefe-lometrii o wysokiej czu³oœci przy u¿yciu
zestawu odczynników CardioPhase hs CRP
(Dade Behring). Przyjête wartoœci odciêcia
wynosi³y dla anty-CCP 5 RU/ml, RF IgM 15
IU/ml, RF IgG 30 IU/ml i hs CRP 3 mg/l.
Analizê statystyczn¹ otrzymanych wyników
przeprowadzono za pomoc¹ testu U Manna-Whitneya dla prób niezale¿nych oraz korelacji liniowej Pearsona oraz Spearmana.
Ze wzglêdu na rozk³ad wszystkich badanych
zmiennych istotnie ró¿ni¹cy siê od rozk³adu
normalnego wartoœci dla grupy badanej i kontrolnej podano w postaci mediany i kwartyli.
WYNIKI
Poziom przeciwcia³ anty-CCP w grupie
chorych na RZS by³ istotnie wy¿szy w porównaniu z grup¹ kontroln¹ (tab. 1). Pomimo ¿e mediana stê¿enia anty-CCP mieœci³a
siê w zakresie wartoœci prawid³owych, to
jednak u niektórych badanych (czwarty
kwartyl) oznaczone stê¿enie przeciwcia³
by³o kilkunastokrotnie wy¿sze. U chorych
na RZS mediana RF IgM by³a powy¿ej wartoœci odciêcia, z kolei mediana stê¿enia RF
IgG mieœci³a siê w zakresie referencyjnym,
jednak wartoœci obu czynników w najwy¿szym kwartylu by³y wysokie. Stê¿enie bia³ka C-reaktywnego – hs CRP oznaczone
w grupie chorych na RZS by³o poni¿ej wartoœci granicznej, chocia¿ mediana by³a
wy¿sza ni¿ w grupie kontrolnej. Poziomy
CRP u chorych na RZS w najwy¿szym
kwartylu ponad trzykrotnie przewy¿sza³y
wartoœæ odciêcia.
Mediany stê¿enia przeciwcia³ anty-CCP
oraz RF IgM i CRP u pacjentów z III° i IV° RZS
by³y wysokie, podczas gdy u chorych z I i 11°
nie przekracza³y zakresu wartoœci referencyjnych (tab. 2). Stê¿enia przeciwcia³ anty-CCP
i RF IgM w najwy¿szym kwartylu w RZS III° i IV°
– postacie ciê¿ka i koñcowa – by³y wielokrotnie
wy¿sze w porównaniu z postaci¹ wczesn¹
i umiarkowan¹. Wartoœci CRP by³y znamiennie
wy¿sze u chorych z zaawansowanymi zmianami
w porównaniu z wczesn¹, jak i umiarkowan¹
Tabela 2. Mediany stężenia badanych parametrów w grupie
chorych z różnym stopniem zaawansowania RZS (wg kryteriów
Steinbrockera)
Parametr badany
wiek (lata)
anty-CCP
RF IgM [IU/ml]
RF IgG [IU/ml]
CRP [mg/l]
I° RZS wczesny
(n = 11)
Me [kwartyle]
46
1,6
9,7
20,1
1,7
II° RZS umiarkowany
(n = 35)
Me [kwartyle]
[26; 55]
55 [48; 64]
[1,5; 2,2]
1,7 [0,6; 38,1]
[8,3; 16,2] 13,2 [8,8; 29,2]
[9,9; 66,5 28,5 [9,1; 67,3]
[0,4; 2,7] 1,98 [0,8;11,6]
wiek (lata)
anty-CCP [RU/ml] wartość odcięcia
RF Ig M [IU/ml] wartość odcięcia
RF IgG [IU/ml] wartość odcięcia
CRP [mg/l] wartość odcięcia
postaci¹ choroby. Stê¿enie tego wskaŸnika ró¿ni³o siê szczególnie pomiêdzy I° i IV° RZS.
W badanej grupie wraz z zaawansowaniem choroby (w stadium ciê¿kim i koñcowym) wzrasta³ odsetek wyników dodatnich
oznaczanych parametrów, a obni¿a³ siê odsetek wyników ujemnych. Najni¿szy odsetek wyników dodatnich (18 proc.) we wczesnym stadium RZS (I°) stwierdzono dla anty-CCP i CRP,
podczas gdy u chorych z postaci¹ koñcow¹
RZS (IV°) najwy¿szy by³ odsetek dodatnich wyników CRP (88 proc.) (tab. 3). Dodatnie wyniki RF IgM i anty-CCP u pacjentów z postaci¹
ciê¿k¹ RZS obserwowano w 76 i 67 proc. oraz
z postaci¹ koñcow¹ – w 71 i 63 proc.
Tabela 4 ilustruje zgodnoœæ wystêpowania
wyników dodatnich/ ujemnych anty-CCP i CRP
u chorych serododatnich (RF IgM+) lub seroujemnych (RF IgM-) w zale¿noœci od stopnia
ciê¿koœci choroby. U 81 proc. serododatnich
pacjentów z III0 i IV° zaawansowania RZS wystêpowa³y tak¿e dodatnie wartoœci przeciwcia³
anty-CCP, natomiast podwy¿szone >3mg/L
wartoœci CRP cechowa³y 54 proc. chorych. Anty-CCP i hs CRP by³y dodatnie tak¿e u 14 proc.
chorych RF IgM (-) z postaci¹ ciê¿k¹ i koñcow¹
RZS. Z kolei we wczesnych i umiarkowanych
stadiach choroby (I° i II° RZS) a¿ u 83 proc. pacjentów RF IgM (-) wystêpowa³y ujemne wartoœci przeciwcia³ anty-CCP, podczas gdy 43 proc.
mia³o stê¿enie CRP <3 mg/L.
DYSKUSJA
Reumatoidalne zapalenie stawów (RZS)
jest najczêstsz¹ chorob¹ zapaln¹ stawów(5). Ze
wzglêdu na postêpuj¹cy charakter tej choroby
Grupa badana
Me [kwartyle] (n=75)
55
1,99
16,8
18,9
2,86
[46; 65]
[1,1; 83,5]
[9,5; 40,7]
[8,0; 67,3]
[1,0; 11,6]
Grupa kontrolna
Me [kwartyle] (n=26)
43,5 [28; 50]
<0,05
3,8 [2,7; 6,1]
11,8 [8,4; 21,2]
0,62 [0,2; 1,2]
p
p<0,000001
p<0,00001
p=0,04
p<0,00001
anty-CCP – przeciwciała przeciw cyklicznemu cytrulinowanemu peptydowi; RF IgM – czynnik reumatoidalny w klasie immunoglobulin M; RF IgG – czynnik
reumatoidalny w klasie immunoglobulin G; CRP – białko C-reaktywne; p – współczynnik istotności statystycznej.
Nr 2 (27), jesień 2013
55
47,2
24,5
12,6
5,99
IV° RZS końcowy
(n = 8)
Me [kwartyle]
[49; 67]
61 [49; 68]
[1,6;131,6] 37,2 [1,3;87,5]
[15,9; 78,4] 33,2 [9,9; 59,9]
[8,0; 20,0] 28,4 [10,7; 93,2]
[2,2; 17,4]
5,7 [5,5; 62,6]
dla anty-CCP p = 0,02 (II° a III° RZS); dla RF IgM p = 0,005 (I° a III° RZS), p = 0,04 (II° a III° RZS);
dla CRP p = 0,005 (I° a III° RZS), p = 0,0007 (I° a IV° RZS), p = 0,02 (II° a IV° RZS).
Tabela nr 1. Stężenia oznaczanych parametrów w grupie badanej
i kontrolnej
Parametr badany
III° RZS ciężki
(n = 21)
Me [kwartyle]
Cała prawda w jednej kropli
istnieje koniecznoϾ agresywnego leczenia,
które spowalnia destrukcjê stawów, ale jednoczeœnie czêsto doprowadza do wielu powik³añ
narz¹dowych. Dlatego wci¹¿ poszukuje siê
czu³ych i swoistych markerów, które by³yby
przydatne w monitorowaniu przebiegu RZS(6).
Oznaczane w tej pracy przeciwcia³a przeciw cyklicznemu cytrulinowanemu peptydowi
s¹ od pewnego czasu wykorzystywane w diagnostyce laboratoryjnej RZS. Wielu badaczy(7,8,9) t³umaczy obecnoœæ przeciwcia³ anty-CCP z wystêpowaniem lokalnej cytrulinacji
³añcuchów fibryny znajduj¹cych siê w ³uszczce reumatoidalnej. Bizzaro i wsp.(10) podkreœlaj¹, ¿e wysokie stê¿enia tych przeciwcia³ s¹
wy³¹cznie zwi¹zane z wystêpowaniem RZS.
W grupie chorych z wczesn¹ postaci¹ RZS
(1° wg skali Steinbrockera), trwaj¹c¹ <2 lat,
dodatnie przeciwcia³a anty-CCP wykryto u 18
proc. badanych. Dane literaturowe wskazuj¹
na wystêpowanie anty-CCP we wczesnym stadium RZS u 30–45 proc. badanych(11), a wg
Vallbrachta i wsp.(12) nawet u 40–60 proc.
chorych. Czynnik reumatoidalny u chorych
z RZS wystêpuje najczêœciej w klasie IgM, rzadziej w klasie IgG(13). W niniejszej pracy obok
Rp IgM oznaczano tak¿e Rp IgG metod¹ ELISA o wysokiej czu³oœci. Rp IgM wykrywany
jest w 20–30 proc. przypadków wczesnego
reumatoidalnego zapalenia stawów(14). W badaniach w³asnych we wczesnym okresie choroby (I°) Rp IgM (+) obecny by³ u 27 proc.
pacjentów, a Rp IgG u 37 proc. chorych. Wed³ug Steinera i wsp.(11) czynnik reumatoidalny
mo¿e wystêpowaæ we wczesnym stadium choroby nawet u 40–50 proc. badanych.
Zaobserwowano zale¿noœæ pomiêdzy
obecnoœci¹ anty-CCP a stopniem nasilenia
RZS. Odsetek wyników dodatnich w ciê¿kim
i koñcowym stadium choroby by³ kilkakrotnie
wy¿szy ni¿ w fazie wczesnej (I°). Wskazuj¹
na to równie¿ najnowsze dane z piœmiennictwa œwiatowego(12–17). Wed³ug Lee i wsp.(18)
i innych(19,20) u pacjentów z dodatnim wynikiem testu anty-CCP obserwuje siê nasilenie
zapalenia stawów oraz wiêksze zmiany w obrazie radiologicznym, co prowadzi do destrukcji stawów. Wielu autorów podkreœla
wartoœæ przeciwcia³ anty-CCP jako wskaŸnika
prognostycznego aktywnoœci choroby(8,10,23).
13
DIAGNOSTYKA POD LUPĄ
³ek ostrej fazy, takich jak: CRP(24,25). Wed³ug niektórych autorów(22,26) u pacjentów z RZS mo¿e
wystêpowaæ stan zapalny o niewielkim nasileniu, dlatego te¿ s³uszne wydaje siê oznaczanie
bia³ka C-reaktywnego metod¹ o wysokiej czu³oœci. Badania Desseina i wsp.(26) i innych(22,27)
wskazuj¹ na zwi¹zek hs CRP z aktywnoœci¹
choroby w RZS, co tak¿e potwierdzaj¹ otrzymane wyniki. Istotnie ni¿sze wartoœci CRP zaobserwowano u chorych z I° i II° RZS w porównaniu do pacjentów, u których choroba by³a zaawansowana (III° i IV°), co sugeruje ostry
jej przebieg mimo stosowanego leczenia.
Autorzy niniejszej pracy nie mieli mo¿liwoœci oceny aktywnoœci choroby na podstawie
wskaŸnika DAS, który bierze pod uwagê m.in.
liczbê bolesnych i obrzêkniêtych stawów. Jednak¿e zaobserwowany najwy¿szy odsetek
(88 proc.) wyników CRP >3mg/L wœród chorych z postaci¹ koñcow¹ RZS, a tym samym
najni¿szy odsetek (12 proc.) niskich stê¿eñ tego wskaŸnika i brak istotnego nak³adania siê
W grupie chorych z ciê¿kim i koñcowym stadium (III° i IV°) stê¿enia anty-CCP kilkakrotnie przekracza³y wartoœæ przyjêt¹ za prawid³ow¹ (47,25 i 37,18 RU/ml), a przeciwcia³a
by³y obecne u 67 i 63 proc. pacjentów. Wskazuje to, ¿e pomimo leczenia, wraz z zaawansowaniem procesu chorobowego i zwi¹zanym
z tym nasileniem zmian kostno-stawowych,
u wiêkszej liczby chorych obecne s¹ przeciwcia³a anty-CCP, a ich miana s¹ zazwyczaj bardzo wysokie(21). Wed³ug Saleema i wsp.(22) kliniczna odpowiedŸ na leczenie nie ma zwi¹zku z obni¿eniem poziomu anty-CCP. Cruyssen i wsp.(23) wykazali, ¿e ni¿szy poziom anty-CCP zwi¹zany jest z krótszym czasem trwania choroby, co potwierdzaj¹ wyniki w³asne
otrzymane w grupie chorych z I° i II° RZS.
Wskazuje siê równie¿ na zwi¹zek Rp
z ciê¿koœci¹ zmian w RZS(7). W badaniach
w³asnych stwierdzono wzrost stê¿enia Rp IgM
wraz z zaawansowaniem choroby, pomimo
stosowanego leczenia farmakologicznego, co
Tabela 3. Częstość (%) występowania wartości powyżej (+) i poniżej
(-) odcięcia u chorych z różnym stopniem zaawansowania RZS
Badany parametr
anty-CCP(+)
anty-CCP(-)
hs CRP(+)
hs CRP(-)
RF lgM(+)
RF lgM(-)
I° RZS
wczesny
II° RZS
umiarkowany
III° RZS
ciężki
IV° RZS
końcowy
18
82
18
82
27
73
43
57
40
60
48
52
67
33
57
43
76
24
63
37
88
12
71
29
Tabela 4. Zgodność wyników dodatnich/ujemnych anty-CCP
i hsCRP (%) u chorych serododatnich (RF lgM+) i seroujemnych
(RF IgM-) w zależności od stopnia zaawansowania RZS
III° i IV° RZS
hs CRP (+)
anty-CCP (+)
(%)
I° i II° RZS
anty-CCP (-)
(%)
hs CRP (-)
RF lg M (+)
81
54
37
20
RF lg M (-)
14
14
83
43
potwierdza wczeœniejsze wyniki innych autorów(22). Rp IgM (+) by³ obecny u 71 proc. pacjentów z postaci¹ koñcow¹ choroby.
Odsetek dodatnich wyników anty-CCP i Rp
IgM by³ znacz¹co wiêkszy u pacjentów
z III i IV° RZS, u których wystêpuj¹ wyraŸne
objawy uszkodzenia stawów. Wysoka zgodnoœæ wystêpowania dodatnich anty-CCP u chorych RF IgM (+) i ujemnych anty-CCP u pacjentów RF IgM (-), w zale¿noœci od stopnia
ciê¿koœci choroby, wskazuje na zwi¹zek obu
rodzajów przeciwcia³ z klinicznymi objawami
RZS. Obecnoœæ dodatnich wyników anty-CCP
u osób z zaawansowanymi postaciami choroby,
ale RF IgM (-) wskazuje na koniecznoϾ poszerzenia diagnostyki serologicznej w RZS.
W przewlek³ych chorobach zapalnych,
w tym RZS, dochodzi do wzrostu stê¿enia bia-
14
wartoœci CRP, najwy¿szych w I° i najni¿szych
w IV° RZS, wskazuj¹ na mo¿liwoœæ wykorzystania oznaczania CRP metod¹ o wysokiej
czu³oœci do oceny nasilenia procesu zapalnego, który pozostaje w zwi¹zku z kryteriami
prognostycznymi i nastêpstwami choroby, co
równie¿ proponuj¹ inni autorzy(13,28,29).
WNIOSKI
Przewa¿aj¹ca wiêkszoœæ chorych w stadium
ciê¿kim i koñcowym RZS cechowa³a siê znacznie podwy¿szonym stê¿eniem anty-CCP, RF
IgM oraz CRP w porównaniu do postaci wczesnej choroby. Stwierdzono wysok¹ zgodnoœæ
wystêpowania dodatnich lub ujemnych wyników RF IgM i anty-CCP w zale¿noœci od stopnia ciê¿koœci choroby, co wskazuje na zwi¹zek
obu rodzajów przeciwcia³ z klinicznymi objaCała prawda w jednej kropli
wami RZS. Sugeruje siê, ¿e w praktyce klinicznej do oceny nasilenia stanu zapalenia i stopnia
zaawansowania RZS, powinno byæ w³¹czone
oznaczanie przeciwcia³ anty-CCP i hsCRP.
Wykaz skrótów:
• anty-CCP – przeciwcia³a przeciw cyklicznemu cytrulinowanemu peptydowi,
• ARA – Amerykañskie Towarzystwo Reumatologiczne,
• CRP – bia³ko C-reaktywne,
• hs CRP – bia³ko C-reaktywne oznaczane
metod¹ o wysokiej czu³oœci,
• NLPZ – niesteroidowe leki przeciwzapalne,
• RF IgM/IgG – czynnik reumatoidalny
w klasie immunoglobulin M/G,
• RZS – reumatoidalne zapalenie stawów.
Autorzy badañ:
1. Katedra i Zak³ad Diagnostyki Laboratoryjnej Collegium Medicum w Bydgoszczy,
Uniwersytet Miko³aja Kopernika w Toruniu.
2. Przyszpitalna Poradnia Reumatologiczna
Wojewódzkiego Szpitala im. dr. J. Biziela.
Cel pracy
Celem pracy by³a ocena stê¿enia wybranych autoprzeciwcia³ (anty-CCP, RF IgM
i IgG) i hsCRP u chorych na reumatoidalne
zapalenie stawów (RZS) w ró¿nych stadiach
zaawansowania choroby.
Materia³ i metody
Badania przeprowadzono w grupie 75 chorych na RZS oraz w grupie kontrolnej 26 osób
zdrowych. W surowicy krwi oznaczono testami
ELISA stê¿enie przeciwcia³ przeciw cyklicznemu cytrulinowanemu peptydowi (anty-CCP),
czynników reumatoidalnych w klasie IgM (RF
IgM) i IgG (RF IgG) oraz metod¹ immunonefelometrii poziom bia³ka C-reaktywnego (hsCRP).
Wyniki
Stê¿enie anty-CCP, RF IgM i CRP by³o znamiennie wy¿sze u chorych z zaawansowanymi
zmianami w porównaniu z wczesn¹ i umiarkowan¹ postaci¹ choroby. Wraz z zaawansowaniem choroby wzrasta³ odsetek wyników dodatnich oznaczanych parametrów. Stwierdzono wysok¹ zgodnoœæ wyników dodatnich (81
proc.) anty-CCP z RF IgM u chorych z ciê¿k¹
i koñcow¹ postaci¹ RZS oraz wyników ujemnych (83 proc.) u pacjentów z postaci¹ wczesn¹ i umiarkowan¹. U 14 proc. chorych z zaawansowan¹ postaci¹ RZS, mimo ujemnych
wyników RF IgM, przeciwcia³a anty-CCP tak¿e
by³y dodatnie, podobnie jak bia³ko hs CRP.
Wnioski
W praktyce klinicznej do oceny nasilenia
stanu zapalenia i stopnia zaawansowania
RZS powinno byæ w³¹czone oznaczanie
przeciwcia³ anty-CCP i hs CRP.
Piœmiennictwo dostêpne na ¿yczenie.
Biuletyn Informacyjny PZ CORMAY
PRZYPADKI KLINICZNE
Postać skórna
liszaja twardzinowego
Każdy z Państwa może zaangażować się w tworzenie
tego działu. Jeżeli spotkali się Państwo z interesującym,
nietypowym przypadkiem, chętnie go opublikujemy.
Mamy nadzieję, że te przypadki będą edukacyjnym
narzędziem w doskonaleniu Państwa umiejętności
diagnostycznych.
Liszaj twardzinowy (LS – lichen sclerosus, dawniej zwany lichen sclerosus et atrophicus – LSA) to choroba z dużym udziałem
nacieków limfocytarnych. Często występuje w okolicy narządów płciowych, ale jest także spotykana w innych okolicach ciała.
Prof. nadzw. dr hab. med. Helena Rotsztejn
Istnieje wiele teorii etiopatogenezy choroby – brane są pod uwagę czynniki
genetyczne, hormonalne, miejscowe, infekcyjne, a także immunologiczne.
Częściej występuje antygen HLA klasy II – HLA-DQ7, przy czym zależność ta
jest silniejsza u kobiet niż u mężczyzn. U dzieci do wystąpienia LS może
predysponować obecność alleli HLA-BO8 i HLA-B18. W etiologii rozpatruje się
również związek z infekcjami Borelia burgdorferi oraz zapaleniem wątroby
typu C. Brana jest także pod uwagę teoria autoimmunizacyjna. Należy
podkreślić, że u chorych na LS spotyka się różnego typu przeciwciała
(przeciwjądrow e ANA, przeciw macierzy zewnątrzkomórkowej ECM1, przeciw
błonie podstawnej IgG). Obserwuje się współwystępowanie LS z GVHD (choroba
– przeszczep przeciw gospodarzowi), liszajem płaskim, twardziną, bielactwem,
łysieniem plackowatym oraz z chorobami tarczycy, a więc chorobami z dużym
udziałem procesów autoimmunizacyjnych. Przyczyny występowania LS
nie zostały jednak do końca wyjaśnione.
W obrazie klinicznym stwierdzamy porcelanowobiałe grudki często zlewające się
w większe ogniska zanikowe z obecną hiperkeratozą mieszkową. Czasami
na powierzchni pojawiają się wybroczyny lub pęcherze wypełnione krwistą
zawartością. Ogniska LS na skórze ciała (w przeciwieństwie do tych w okolicy
genitalnej) nie sprawiają żadnych dolegliwości.
głównie w głębszych warstwach skóry właściwej. W tych przypadkach
zmiany nie zawsze są odwracalne.
Istotne w leczeniu LS sromu jest szybkie wdrożenie terapii miejscowej.
Stosuje się silne maści glikokortykosteroidowe w zmniejszającej częstości
aplikacji, uzupełniane emolientami. Były próby leczenia roztworami
cyklosporyny z dość dobrymi efektami, ale jest to leczenie drogie
i obwarowane wieloma procedurami ze względu na toksyczność chemiczną
dla otoczenia. Próbowano leczenia pochodnymi kalcyneuryny, testosteronem
i terapią fotodynamiczną. Terapia systemowa stosowana jest niezwykle
rzadko.
W literaturze dyskutowany jest problem kancerogenezy w ogniskach LS.
SCC (rak kolczystokomórkowy) w ogniskach LS występuje rzadko i tylko
w lokalizacji genitalnej choroby.
Piśmiennictwo:
1. Tchórzewski H, Rotsztejn H, Banasik M, et al. The involvement of immunoregulatory T cells in the pathogenesis
of lichen sclerosus. Med Sci Monit 2005; 11: CR 39–43.
2. Howard A, Dean D, Cooper S, et al. Circulating basement membrane zone antibodies are found in lichen sclerosus
of the vulva. Austral J Dermatol 2004; 45: 12–5.
3. Rotsztejn H, Trznadel-Budźko E, Jesionek-Kupnicka D. Langerhans cells in vulvar lichen sclerosus and squamous
cell carcinoma. Arch Immunol Ther Exp 2006; 54: 363–6.
4. Chan JJ, Oyama N, Neill SM, et al. Characterization of IgG autoantibodies to extracellular matrix protein 1 in lichen
sclerosus. Exp Dermatol 2004; 29: 499–504.
5. Meffert JJ, Davis BM, Grimwood RE. Lichen sclerosus. J Am Acad Derm 1995; 32: 393–416.
6. Carlson A, Grabowski R, Xiao CM, et al. Possible mechanisms of hypopigmentation in lichen sclerosus.
Am J Dermopathol 2004; 24: 97–107.
7. Stavrianeas NG, Katoulis AC, Kanelleas AI, et al. Extragenital lichen sclerosus of childhood presenting as
erythematous patches. Indian J Dermatol Venereol Leprol 2008; 74: 59–60.
8. Guerriero C, Manco S, Paradisi S, et al. Extragenital lichen sclerosus and atrophicus treated with topical steroids
and retinoids in a child with vitiligo. Int J Immunopathol Pharmacol 2008; 21: 757–9.
9. Marren P, De Berker D, Millard P, Wojnarowska F. Bullous and haemorrhagic lichen sclerosus with scalp
involvement. Clin Kowalewski C, Kozłowska A, Zawadzka M, et al. Alterations of basement membrane zone in bullous
and non-bullous variants of extragenital lichen sclerosus. Am J Dermatopathol 2004; 26: 96–101.
10. Ristić B, Divic J, Belic LJ, Zdelar D. Bullous lichen sclerosus atrophicus. JEADV 2004; 18: 108–9.
Ryc. 1. Ognisko LS na skórze tułowia
W obrazie morfologicznym LS dominuje ścieńczenie nabłonka, wygładzenie
granicy nabłonek–podścielisko, występowanie pod nabłonkiem pasa tkanki
łącznej o homogennej, ubogokomórkowej strukturze oraz nacieków
z limfocytów i komórek plazmatycznych. Stopień ścieńczenia nabłonka oraz
szerokość pasa homogennego zależą od czasu trwania choroby. W zmianach
trwających stosunkowo krótko (do roku) stopień zaniku nabłonka jest
niewielki, a pas homogenny umiarkowanie szeroki. Nacieki zapalne występują
w górnej części skóry właściwej. W tej fazie choroby proces wydaje się być
pod wpływem leczenia całkowicie odwracalny. W zmianach trwających dłużej
dochodzi do znacznego ścieńczenia nabłonka, a nacieki zapalne obecne są
Nr 2 (27), jesień 2013
Ryc. 2. Obraz histopatologiczny prezentowanej zmiany LS
Cała prawda w jednej kropli
15










