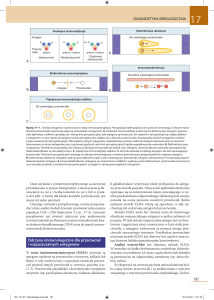
Fakultet: Cytometria – zastosowanie
w badaniach biologicznych
Wprowadzenie do cytometrii
przepływowej:
metody znakowania komórek
Nadzieja Drela
Zakład Immunologii WB UW
[email protected]
Przygotowanie komórek do
znakowania
1. Zawiesina komórek (bez fragmentów tkanek, błon
komórkowych, zlepionych komórek). Komórki z hodowli
nieadherentnych i krwi obwodowej stwarzają najmniej
problemów
2. Komórki z hodowli adherentnych (trawienie
enzymatyczne). Trawienie receptorów, zmniejszenie ich
ekspresji, zmniejszenie dostępności do epitopów
3. Izolowanie komórek z narządów metodami
mechanicznymi, enzymatycznymi lub obiema
jednocześnie
1. Próbki kliniczne – zwykle krew obwodowa, wymaga lizy
erytrocytów (wodą, chlorkiem amonu, detergentem)
2. Antygeny powierzchniowe znakowane są na komórkach
nieutrwalonych – standardowe procedury
3. Znakowanie wewnątrzkomórkowe wymaga utrwalania i
permeabilizacji komórek. Brak jest standardowej
procedury: a/ utrwalanie 70% etanolem w 4 st. C; b/
utrwalanie absolutnym metanolem w -80 st.C; c/ 1%
formaldehyd w 4 st.C, następnie metanol w -20 st.C; d/ 1%
formaldehyd w obecności detergentu (saponina) w 0-4
st.C, następnie metanol w -20 st.C (lub bez tego etapu)
Zasady barwienia komórek
Barwienie z użyciem przeciwciał sprzężonych z
fluorochromami
Barwienie z użyciem cząsteczek innych niż
przeciwciała sprzężonych z fluorochromami
Barwienie wolnymi barwnikami fluorescencyjnymi
Zastosowanie przeciwciał w
cytometrii przepływowej
Schematyczna budowa przeciwciał
Odpowiedź pierwotna i wtórna
Zastosowanie przeciwciał wykorzystuje
ich zdolność do wiązania antygenów:
Podstawą jest reakcja Ag:Ab
Antygeny występują w organizmach
żywych powszechnie i służą do
specyficznej identyfikacji komórek
Przeciwciała poliklonalne
Przeciwciała monoklonalne
Porównanie surowicy poliklonalnej i
przeciwciał monoklonalnych
Surowica poliklonalna
Ag
Ag
Przeciwciała
monoklonalne
Ag
Rysunek :Ewa Kozłowska
Porównanie surowicy poliklonalnej i
przeciwciał monoklonalnych
Przeciwciała poliklonalne są specyficzne dla
wielu epitopów tego samego antygenu, zatem są
heterogenne i utrudniają standaryzację
znakowania i analizy
Przeciwciała monoklonalne wiążą takie same
epitopy, zatem można uzyskać powtarzalność
znakowania
Określanie fenotypu komórek immunofenotypowanie
Identyfikacja komórek na podstawie
znaczników/markerów powierzchniowych
Do tego celu używamy Ab monoklonalnych
przeciwko markerom różnicującym komórki
analiza
Znakowanie/inkubacja
Znakowanie
bezpośrednie
Znakowanie
pośrednie
http://flowbook.denovosoftware.com/Flow_Book/Chapter_5%3A_Immunofluorescence_and_Colour_Compensation
Który sygnał jest silniejszy?
Jak wybieramy przeciwciała
http://flowbook.denovosoftware.com/Flow_Book/Chapter_5%3A_Immunofluorescence_and_Colour_Compensation
Która metoda jest lepsza?
Znakowanie markerów powierzchniowych
CD8
CD4
CD8
CD4
CD4
Która metoda jest lepsza?
Fałszywe pozytywne wyniki
Czy można stosować obie metody
jednocześnie?
1. Inkubacja z nieznakowanym I rz. przeciwciałem. Płukanie
2. Inkubacja ze znakowanym II rz. Ab. Płukanie
3. Inkubacja z surowicą myszy (blokuje niewysycone miejsca
II rz. przeciwciała)
4. Inkubacja ze znakowanym I rz. Ab. Płukanie
5. Analiza
Przeciwciało/biotyna/awidyna
1. Biotyna, wit. H, wit. B7
2. Awidyna, białko obecne w jajach, wykazuje
powinowactwo do biotyny, 1 cz. awidyny wiąże 4 cz.
biotyny
3. Streptoawidyna, białko bakteryjne (Streptomyces
avidinii), wiąże niekowalencyjnie biotynę
Reakcja biotyna-awidyna; biotyna-streptoawidyna –
specyficzna, nieodwracalna
1. Nieznakowane Ab I-rzędowe + Ab II-rzędowe sprzężone
z fluorochromem
2. Ab I rz. + Ab II rz. Biotyna + streptawidyna/fluorochrom
3. Amplifikacja systemu 2
Wybór odpowiedniego stężenia
przeciwciała
http://flowbook.denovosoftware.com/Flow_Book/Chapter_5%3A_Immunofluorescence_and_Colour_Compensation
1. Zwykle rozcieńczamy Ab: szereg dwukrotnych
rozcieńczeń np. 1:50, 1:100, 1:200 itd.
2. Inkubujemy komórki z takimi samymi rozcieńczeniami
kontroli izotypowej
3. Chcemy oceniać ekspresję badanego markera – używamy
stężenie saturujące
4. Chcemy ocenić obecność pozytywnych i negatywnych
komórek – używamy mniejszego stężenia (przeważają
względy finansowe)
Kontrola izotypowa
Rodzaj kontroli negatywnej wykluczający niespecyficzne
wiązanie przeciwcial wynikające głównie z wiązania z
receptorami Fc.
Przykład: mysie przeciwciała IgG2a silnie wiązane są przez
leukocyty człowieka.
Znakowanie komórek z
zastosowaniem cząsteczek innych
niż Ab sprzężonych z
fluorochromami
Aneksyna V
Białko komórkowe o słabo poznanej funkcji. Wykazuje
powinowactwo do fosfatydyloseryny.
http://www.google.pl/imgres?imgurl=http://www.biomol.de/dateien/infos_nr647.gif&imgrefurl=http://www.biomol.
Oznaczanie komórek apoptotycznych
Znakowanie wolnymi barwnikami
fluorescencyjnymi
Oznaczanie zawartości DNA
DAPI, PI, 7-AAD bezpośrednio łączą się z DNA
DAPI (4',6-diamidyno-2-fenyloindol) – UV, przenika przez błony
żywych i utrwalonych komórek, 358 nm/461 nm
PI – 535 nm/617 nm, nie przepuszczalny dla błon żywych komórek
(w komórkach roślinnych znakuje ścianę komórkową)
7-AAD, (7-aminoactinomycin D), duże powinowactwo do regionów
GC, nie przenika przez błony żywych komórek, 546 nm/647 nm
Hoechst – bis-benzimidazole, przenika przez nienaruszone błony
komórek, UV, 345 nm/ 485 nm
Analiza cyklu komórkowego
Analiza potencjału błonowego
JC-1 (5,5’,6,6’-tetrachloro-1,1’,3,3’
tetraethylbenzimidazolylcarbocyanine iodide)
Ctrl
ASM
A
R2
R2
R3
R3
R4
R4
-Hc
R2 - 88.30%
R3 - 7.51%
R4 - 0.06%
R2 - 77.65% *
R3 - 17.60% *
R4 - 0.07%
B
R2
R2
R3
R3
R4
R4
+Hc
R2 - 76.16% #
R3 - 13.81% #
R4 - 6.21% #
R2 - 60.27% * # ^
R3 - 29.18% * # ^
R4 - 7.19%
# ^
Analiza
potencjału
błonowego
Zastosowanie CFDA-SE do
znakowania komórek
Analiza proliferacji
Analiza proliferacji
G3 G3
G3
G3
G3 G2 G2
G1G1G2 G3
G3 G2 G1
G3
G2
G3 G2
G3
G3 G3
Ewa Kozłowska
Jeszcze raz zastosowanie
przeciwciał…..ale na nośniku
Oznaczanie stężenia cytokin
Wybór fluorochromów
1. Typ i liczba laserów i detektorów
2. Zestaw filtrów optycznych (filtry pasmowe
zwiększają czułość detekcji fluorochromu,
ale zwiększają ryzyko „spillover”)
Wirtualne testowanie:
Bdbiosciences.com.spectra
Źródła światła i fluorochromy (Aria)
Laser
Fluorochromes
Wavelength
(nm)
Min. Power Commonly Used
(mW)
Coherent®
Sapphire™
Solid State
488 nm (blue)
13
FITC, PE, PE-TxRed, PE-Cy7,
PerCP, PerCPCy5.5, PI
JDS Uniphase™
HeNe Air Cooled
633 nm (red)
11
APC, APC-Cy7
Point Source
407 nm (violet)
Violet Solid State
(optional)
http://www.bdbiosciences.com
10
Alexa Fluor®, Cascade blue,
Pacific blue, DAPI, Hoeschst,
AmCyan
Układ optyczny: laser niebieski
http://www.bdbiosciences.com
Układ optyczny: czerwony i fioletowy
http://www.bdbiosciences.com
Wybór fluorochromu
“Bright” = zapewniają dobrą czułość
http://www.bdbiosciences.com
http://www.bdbiosciences.com
BD Biosciences Application Note
“Bright” ale…minimalizacja „spillover”
(spectral overlap, nakładanie spektrum
emisji)
Te dwie zasady
często się wykluczają
BD Biosciences Application Note
http://www.bdbiosciences.com
BD Biosciences Application Note
http://www.bdbiosciences.com
Przykład: CD8 bright/CD62L dim – CD62L
PE/CD8 FITC
FITC-PE
PE-FITC
Jeszcze jedna zasada doboru fluorochromów:
Stosuj „bright” fluorochrom dla „dim” Ab
Stosuj „dim” fluorochrom dla „bright” Ab
ale…….
Unikaj „spillover” silnie świecącej populacji do
detektora wykrywającego słabo świecącą populację,
czyli do detektora wykrywającego z dużą czułością.
Fluorochromy tandemowe:
APC-Cy7
PE-Cy7
Degradują pod wpływem światła, utrwalania
(formaldehydem) i ogrzewania. Wówczas emitują
fluorescencję w zakresie barwnika głównego (APC,
PE), co skutkuje fałszywym wynikiem pozytywnym.
Zatem: stosuj stabilne pochodne, używaj zalecanych
buforów do utrwalania, przechowuj próby w
ciemności i odpowiedniej temperaturze, zwykle 4 st.
C.
Zasady doboru fluorochromów do analizy
wielokolorowej:
1. Wybieraj najsilniej świecące fluorochromy
2. Minimalizuj „spillover”
3. Stosuj silne fluorochromy do słabych
przeciwciał i odwrotnie: słabe fluorochromy
do silnych przeciwciał
4. Unikaj spillover silnie świecącej populacji
do detektorów wykrywających słabo
świecące populacje
5. Stosuj procedury zapobiegające
degradacji fluorochromów tandemowych
Spektra emisji fluorochromów: spillover
http://www.bdbiosciences.com
Spillover
Najczęściej używane zestawy barwników
BD Biosciences Application Note
http://www.bdbiosciences.com
Kompensacja
A. Zła kompensacja
B. Prawidłowa kompensacja
C. Niedokompensowane
D. Przekompensowane
http://flowbook.denovosoftware.com/Flow_Book/Chapter_5%3A_Immunofluorescence_and_Colour_Compensation
Kompensacja – kiedy jest
nieprawidłowa?
A. Zła kompensacja – spektra emisji fluorochromów
na siebie zachodzą
B. Prawidłowa kompensacja
C. Niedokompensowane – za mało sygnału FITC
odjęto z kanału PE
D. Przekompensowane – za dużo sygnału FITC
odjęto z kanału PE
Spillover
http://flowbook.denovosoftware.com/Flow_Book/Chapter_5%3A_Immunofluorescence_and_Colour_Compensation
Kompensacja w praktyce
Przykłady prawidłowej kompensacji
Correct Compensation
http://www.bdbiosciences.com
Under Compensation
Over Compensation
Jakich markerów używamy do kompensacji?
Small errors in compensation of a dim control (A) can result in large
compensation errors with bright reagents (B & C).
Use bright markers to setup proper compensation.
http://www.bdbiosciences.com
Barwniki tandemowe
CD8
PE-Cy7
CD3
PE-Cy5
Time Sample Left
in Light
0 hours
PE
(FL2)
2 hours
22.5 hours
http://www.bdbiosciences.com
Kompensacja konjugatów tandemowych jest
charakterystyczna dla serii
http://www.bdbiosciences.com
Obraz zależny od kompensacji i rodzaju skali
A. Zła kompensacja – spektra emisji fluorochromów na siebie zachodzą
B. Prawidłowa kompensacja off-line
C. Prawidłowa kompensacja – jak B, ale inna skala osi
D. Prawidłowa kompensacja na skali bieksponencjalnej
http://flowbook.denovosoftware.com/Flow_Book/Chapter_5%3A_Immunofluorescence_and_Colour_Compensation
Kompensacja przy użyciu kulek
kalibracyjnych
http://www.bdbiosciences.com
http://www.bdbiosciences.com/research/m
ulticolor/spectrum_viewer/index.jsp
Dziękuję za uwagę