Perinatologia, Neonatologia i Ginekologia, tom 6, zeszyt 3, 174-177, 2013
SYTUACJA KLINICZNA #12
Zespół przetoczenia krwi między płodami – TTTS
Sytuacja kliniczna
32-letnia wieloródka w ciąży bliźniaczej jednokosmówkowej dwuowodniowej została przyjęta do szpitala w 31.
tygodniu ciąży z powodu nieregularnej czynności skurczowej macicy. Rozpoznanie jednokosmówkowości zostało postawione w trakcie badania USG w I trymestrze. Badanie USG po przyjęciu do szpitala wykazało asymetrię
wzrastania bliźniąt oszacowaną na 19 % (szacunkowa masa
większego płodu 1960 ± 286 g, natomiast mniejszego płodu
1588 ± 232 g). Ponadto stwierdzono wielowodzie w jednym
worku owodniowym (MAP– 14 cm), wodobrzusze i wolny
płyn w jamie osierdziowej oraz nieprawidłowe wyniki
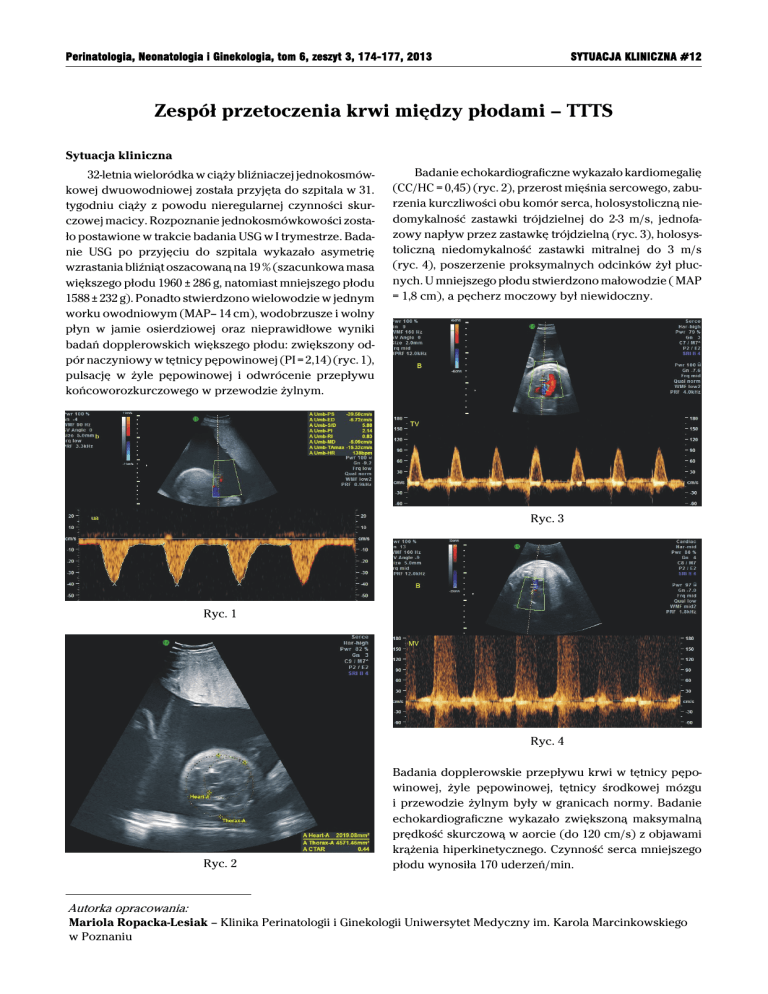
badań dopplerowskich większego płodu: zwiększony odpór naczyniowy w tętnicy pępowinowej (PI = 2,14) (ryc. 1),
pulsację w żyle pępowinowej i odwrócenie przepływu
końcoworozkurczowego w przewodzie żylnym.
Badanie echokardiograficzne wykazało kardiomegalię
(CC/HC = 0,45) (ryc. 2), przerost mięśnia sercowego, zaburzenia kurczliwości obu komór serca, holosystoliczną niedomykalność zastawki trójdzielnej do 2-3 m/s, jednofazowy napływ przez zastawkę trójdzielną (ryc. 3), holosystoliczną niedomykalność zastawki mitralnej do 3 m/s
(ryc. 4), poszerzenie proksymalnych odcinków żył płucnych. U mniejszego płodu stwierdzono małowodzie ( MAP
= 1,8 cm), a pęcherz moczowy był niewidoczny.
Ryc. 3
Ryc. 1
Ryc. 4
Ryc. 2
Autorka opracowania:
Badania dopplerowskie przepływu krwi w tętnicy pępowinowej, żyle pępowinowej, tętnicy środkowej mózgu
i przewodzie żylnym były w granicach normy. Badanie
echokardiograficzne wykazało zwiększoną maksymalną
prędkość skurczową w aorcie (do 120 cm/s) z objawami
krążenia hiperkinetycznego. Czynność serca mniejszego
płodu wynosiła 170 uderzeń/min.
Mariola Ropacka-Lesiak – Klinika Perinatologii i Ginekologii Uniwersytet Medyczny im. Karola Marcinkowskiego
w Poznaniu
Zespół przetoczenia krwi między płodami – TTTS
Zaznacz prawidłowe stwierdzenia
G
Y 1) Rozpoznano zespół TTTS, a wykonane badania
potwierdziły niewydolność serca u większego
płodu.
G 2) W postępowaniu można wdrożyć seryjne amnioredukcje.
G 3) Proponowane postępowanie powinno obejmować
fetoskopię z laserową okluzją anastomoz.
G
Y 4) W postępowaniu należy wdrożyć stymulację dojrzewania układu oddechowego kortykosteroidami i w trybie pilnym zakończyć ciążę.
Uzasadnienie
Prawidłowa odpowiedź obejmuje rozpoznanie zespołu
przetoczenia krwi między bliźniętami (TTTS). Wykonane
badania dopplerowskie umożliwiły ocenę zaburzeń hemodynamicznych, a wraz z oceną echokardiograficzną umożliwiły ustalenie stopnia zaawansowania zaburzeń hemodynamicznych oraz potwierdziły niewydolność serca
większego płodu, czyli biorcy. 31. tydzień ciąży stanowi
przeciwwskazanie do wykonania fetoskopowej okluzji
anastomoz. Zalecany termin ciąży to okres między 15 a 26.
tc. Po 26. tygodniu zaleca się wykonanie amnioredukcji
i/lub ukończenie ciąży. Występowanie silnie wyrażonych
zaburzeń w przepływach dopplerowskich oraz objawy niewydolności serca biorcy w 31. tc stanowią wskazanie do
natychmiastowego zakończenia ciąży.
Zespół przetoczenia jest ciężkim powikłaniem bliźniąt
jednokosmówkowych. Częstość występowania TTTS jest
około 1-3 na 10000 urodzeń. [1]. Rozpoznanie TTTS opiera
się na ultrasonograficznych kryteriach: 1) występowaniu
jednokosmówkości i 2) stwierdzeniu małowodzia (maksymalna kieszonka płynu owodniowgo [MVP] < 2 cm w jednym worku owodniowym oraz wielowodzia ( MVP > 8 cm)
w drugim [2]. Ta asymetria płynu owodniowego, które
oznacza obecność wielo- i małowodzia, służy do określenia stopnia TTTS [3]. Asymetria wzrastania oraz wewnątrzmaciczne ograniczenie wzrastania (IUGR) często obserwowane jest w zespole TTTS. Jednak ani asymetria sama w
sobie, ani IUGR, nie stanowią kryteriów diagnostycznych
zespołu. Ocena stopnia zaburzeń hemodynamicznych
przeprowadzana jest na podstawie ultrasonograficznych
parametrów i opisana została przez Quintero i wsp. w 1999
[3]. Skala Quintero obejmuje 5 stopni zaawansowania począwszy od łagodnej postaci choroby z izolowaną asymetrią objętości płynu owodniowego do ciężkiej choroby
z obumarciem jednego lub obu bliźniąt. Z analizy raportów z Ośrodków Terapii Płodu wynika, że około 11-15%
przypadków to stopień I, 20-40% było w stopniu II, 38-60%
było w III, 6-7% w IV, a 2% było w stopniu V [4]. Jednak
skala Quintero nie odzwierciedla w idealny sposób rokowania dla płodów, jest jednak relatywnie prosta do zastosowania i komunikowania się z pacjentami [1]. W literaturze pojawiło się kilka prób zmiany tej skali przez wpro-
175
wadzenie oceny funkcji serca płodu [5], a nawet opracowano nowy system punktacji [6].
TTTS może rozwinąć się w każdym czasie w ciąży,
jednak większość przypadków rozpoznaje się w drugim
trymestrze ciąży. TTTS często nie rozwija się w sposób
przewidywalny. Dane na temat naturalnego przebiegu są
ograniczone, szczególnie w bardziej zaawansowanych stadiach [3]. W ponad trzy czwartych przypadków w stopniu
I choroba ma przebieg stabilny lub nawet niekiedy obserwuje się regresję objawów bez konieczności inwazyjnego leczenia. Naturalny przebieg bardziej zaawansowanych zaburzeń (np. stopień III) TTTS jest ciężki, a umieralność perinatalna wynosi ok. 70-100%, zwłaszcza gdy
rozwija się poniżej 26. tygodnia. Bez zastosowania wewnątrzmacicznej terapii, obumarcie co najmniej jednego
płodu jest powszechne. Obumarcie przeżywającego bliźniaka występującego w około 10% przypadków, a uszkodzenia neurologiczne obserwuje się u ok 10-30% przeżywających płodów.
Podsumowując, przeżywalność płodów z ciąż powikłanych zespołem TTTS różni się sięgając od 15 do 70%, w zależności od wieku ciążowego w momencie rozpoznania oraz stopnia zaawansowania zmian hemodynamicznych [1] .
Ocena serca płodu może być przydatna w identyfikacji
przypadków, u których zastosowanie terapii wewnątrzmacicznej byłoby korzystne oraz może być wykorzystywana do oceny odpowiedzi na leczenie. Chociaż echokardiograficzna ocena serca płodu nie wchodzi w skład
skali Quintero, rutynowo wykorzystywanej do oceny zaawansowania zmian hemodynamicznych, wiele ośrodków
wykonuje echokardiografię płodu w przypadkach TTTS,
obserwując pogorszenie funkcji serca w zaawansowanych
stopniach zespołu [1]. Jednakże, zmiany parametrów
echokardiograficznych są również obserwowane w 10%
we wczesnych etapach choroby. Czynnościowe wady serca w zespole TTTS występują głównie u biorców. Przeciążenie objętościowe powoduje wzrost prędkości przepływu
przez zastawkę aortalną i płucną, kardiomegalię oraz
niedomykalność zastawek przedsionkowo-komorowych.
Z czasem u biorcy może rozwinąć się postępujący przerost mięśniówki komór, zaburzenia kurczliwości oraz
osłabienia funkcji skurczowej prawej komory, która może
prowadzić do funkcjonalnej atrezji pnia płucnego [1]. Rozwój zaburzeń odpływu prawej komory, obserwowano
w ok.10% przypadków. Jest on prawdopodobnie wieloczynnikowy, związany ze wzrostem obciążenia wstępnego,
następczego, a także następstwem krążących czynników,
takich jak renina, angiotensyna i endotelina oraz przedsionkowego peptydu natriuretycznego. Odpowiedź układu
krążenia na zaburzenia hemodynamiczne obserwowane
u biorcy w zespole TTTS odpowiada za rokowanie dla
biorcy. Biorcy wykazujący prawidłową czynność serca
mają lepsze szanse na przeżycie.
176
Zespół przetoczenia krwi między płodami – TTTS
Podsumowując, opracowane systemy punktacji, które
wprowadziły do oceny stanu płodu parametry echokardiograficzne, są wykorzystywane w praktyce klinicznej.
Jednak ich przydatność w przewidywaniu rokowania dla
płodów w zespole TTTS pozostaje nadal mało poznana.
Konieczne są dalsze badania w celu oceny znaczenia
echokardiografii płodowej w predykcji rokowania dla płodów [1, 7].
Możliwości terapeutyczne w zespole TTTS obejmują
amnioredukcję, septostomię, fetoskopową fotokoagulację
anastomoz oraz selektywną fetoredukcję. Amnioredukcje
mogą być wykonywane zarówno jako procedury pierwszego rzutu, jednorazowo, szczególnie w stopniu I lub II
TTTS lub seryjnie, gdy MAP przekracza 8-10 cm. Te zabiegi
mogą być wykonywane od 14. tygodnia ciąży. Amnioredukcja hipotetycznie może zmniejszyć ciśnienie wewnątrzowodniowe oraz wewnątrz naczyń łożyskowych, co
potencjalnie może ułatwić przepływ krwi przez łożysko
i/lub ewentualnie zmniejszyć częstość występowania porodu przedwczesnego związanego z wielowodziem. Amnioredukcje mogą być stosowane również po 26. tygodniu,
szczególnie w przypadkach zaburzeń oddychania u matki
oraz przedwczesnej czynności skurczowej wynikającej
z wielowodzia [1, 8]. Amnioredukcja jako metoda terapeutyczna związana ze średnią przeżywalnością ocenianą na
ok 50% (w dużych rejestrach sprawozdawczych 60-65%)
[9]. Jednak często konieczne jest wykonanie seryjnych
amnioredukcji, a powtórne procedury zwiększają prawdopodobieństwo wystąpienia powikłań, takich jak przedwczesne pęknięcie błon płodowych, poród przedwczesny,
przedwczesne oddzielenie łożyska, zakażenie i obumarcie
wewnątrzmaciczne płodu [10]. Inną kwestią jest to, że
każda inwazyjna procedura wykonana przed fetoskopią
może zmniejszyć efektywność leczenia laserem z powodu
krwawienia, separacji błon, przypadkowej septostomii lub
pęknięcie błon płodowych.
Zabieg fetoskopii polega na fotokoagulacji anastomoz
naczyniowych. Celem ablacji laserowej jest funkcjonalny
rozdział łożyska na 2 regiony, z których każdy zaopatruje
jedno z bliźniąt. Ten zabieg jest często określany jako
„dichorionizacja” jednokosmówkowego łożyska. Selektywna koagulacja zarówno połączeń AV, jak i AA i VV zespoleń jest korzystniejsza niż nieselektywna ablacja wszystkich
połączeń naczyniowych [1, 11]. Kryteria włączenia do tego
typu terapii obejmują ciąże między 15. a 26. tygodniem.
Selektywna redukcja płodu polega na celowym przerywaniu przepływu krwi w pępowinie jednego płodu, doprowadzające do jego obumarcia, jednocześnie zwiększenia szansy przeżycia drugiego płodu. Zazwyczaj zabieg
ten wykonywany jest za pomocą ablacji o częstotliwości
radiowej lub koagulacji sznura pępowinowego, chociaż
wykorzystywano również inne procedury. Metoda ta
umożliwia maksymalnie 50% przeżycie, tak więc jest to
procedura zazwyczaj zarezerwowana dla III lub IV stopnia
zaawansowania.
Brak jest dużych badań klinicznych dotyczących optymalnego czasu porodu w ciążach powikłanych zespołem
TTTS. Jest on uzależniony od kilku czynników, w tym stopnia zaawansowania i ciężkości choroby, progresji, efektywności interwencji wewnątrzmacicznych oraz wyników
badań diagnostycznych. Zalecenia dotyczące terminu
porodu w zespole TTTS różnią się znacząco, w niektórych
ośrodkach planuje się poród przedwczesny już w 32-34.
tygodniu, a w innych indywidualizuje się opiekę kontynuując ciążę do 34-37. tygodnia, szczególnie w przypadkach o łagodnym przebiegu choroby (np. stopień I i II)
przy wdrożonym intensywnym nadzorze [1]. Pacjentki
leczone laserem mają na ogół bardziej zaawansowany
stopień zaburzeń hemodynamicznych i mogą być narażone na zwiększone ryzyko porodu przedwczesnego z powodu zarówno zespołu TTTS, jak i samej procedury.
Jednak wcześniactwo zostało zidentyfikowane jako niezależny czynnik ryzyka zaburzeń neurologicznych w zespole TTTS. Biorąc pod uwagę szerokie spektrum powikłań
związanych z TTTS, wiele czynników może wpływać na
decyzję o zakończeniu ciąży, w tym stopień zaawansowania, progresja, efekt terapii wewnątrzmacicznej, wiek
i wielkość płodu oraz wyniki badań stosowanych w monitorowaniu ciąż powikłanych tym zespołem. Przedłużenie
czasu trwania ciąży do 34-36. tygodnia może być uznane za
słuszne, zwłaszcza po udanej ablacji laserowej [1].
Piśmiennictwo
[1] Society for Maternal-Fetal Medicine (SMFM), Simpson L.
(2013) Twin-twin transfusion syndrome. SMFM guidelines.
Am. J. Obstet. Gynecol. 1: 3-18.
[2] Malinowski W, Ropacka-Lesiak M. (2012) Ciąża wielopłodowa. [W:] Położnictwo. T. 2. Medycyna matczyno-płodowa.
red. G.H. Bręborowicz, T. Paszkowski. Warszawa: Wyd. Lek.
PZW, 83-103.
[3] Quintero R.A., Morales W.J., Allen M.H., Bornick P.W., Johnson P.K., Kruger M. (1999) Staging of twintwin transfusion
syndrome. J. Perinatol. 19: 550-5.
[4] Gandhi M., Papanna R., Teach M., Johnson A., Moise K.J.J.
(2012) Suspected twin-twin transfusion syndrome: how often
is the diagnosis correct and referral timely? J. Ultrasound
Med. 31: 941-5.
[5] Michelfelder E., Gottliebson W., Border W. et al. (2007) Early
manifestations and spectrum of recipient twin cardiomyopathy in twin-twin transfusion syndrome: relation to Quintero stage. Ultrasound Obstet. Gynecol. 30: 965-71.
[6] Rychik J., Tian Z., Bebbington M. et al. (2007) The twin-twin
transfusion syndrome: spectrum of cardiovascular abnormality and development of a cardiovascular score to assess
severity of disease. Am. J. Obstet. Gynecol. 197: 392.
[7] Ropacka-Lesiak M., Kowalska-Jasiecka J., Kowalska K., L.ech
J, Malewski W., Bręborowicz G.H. (2012) Koarktacja aorty
u biorcy w zespole TTTS – trudności diagnostyczne – opis
przypadku. Ginek. Pol. 83, 7: 545-548.
[8] Chalouhi G.E., Stirnemann J.J., Salomon L.J., Essaoui M, Quibel T., Ville Y. (2010) Specific complications of monocho-
rionic twin pregnancies: twintwin transfusion syndrome and
twin reversed arterial perfusion sequence. Semin. Fetal Neonatal Med. 15: 349-56.
Zespół przetoczenia krwi między płodami – TTTS
[9] Mari G., Roberts A., Detti L. et al. (2001) Perinatal morbidity
and mortality rates in severe twin-twin transfusion syndrome: results of the international amnioreduction registry. Am.
J. Obstet. Gynecol. 185: 708-15.
[10] Roberts D., Gates S., Kilby M., Neilson J.P. (2008) Interventions for twin-twin transfusion syndrome: a Cochrane review.
Ultrasound Obstet. Gynecol. 31: 701-11. Level I.
177
[11] Quintero R.A., Comas C., Bornick P.W., Allen M.H., Kruger
M. (2000) Selective versus non-selective laser photocoagula-
tion of placental vessels in twin-to-twin transfusion syndrome. Ultrasound Obstet. Gynecol. 16: 230-6.