Badanie reakcji Mukaiyamy i winylogowej reakcji Mukaiyamy w obecności
wody katalizowanych kwasami Lewisa
mgr Marta Woyciechowska
Winylogowa reakcja Mukaiyamy jest powszechnie stosowana do otrzymywania
δ–hydroksy
prekursory
α,β–nienasyconych
do
syntezy
związków
związków
karbonylowych,
naturalnych.
Metoda
ta
stanowiących
jest
ściśle
często
związana
z wykorzystaniem enoloeterów sililowych, posiadających sprzężony układ wiązań
podwójnych. Spośród nich na szczególną uwagę zasługują siloksyfurany o ambidentnym
charakterze nukleofilowym, dające dostęp do ważnej klasy laktonów: γ–butenolidów.
Doniesienia literaturowe pokazują, że mogą być one z powodzeniem zastosowane
w winylogowej reakcji Mukaiyamy (Schemat 1).1
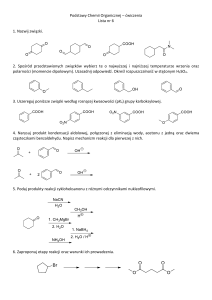
Schemat 1. Reakcja Mukaiyamy w sprzężonym układzie wiązań podwójnych
Prowadzenie reakcji w obecności wody jest ważnym aspektem współczesnej chemii,
która dąży do eliminacji szkodliwych rozpuszczalników organicznych na korzyść warunków
imitujących warunki naturalne. Brak procedur, opisujących przebieg winylogowej reakcji
Mukaiyamy w środowisku wodnym, otwiera drogę do nowych badań w tym obszarze.
Postanowiłam więc sprawdzić
przebieg reakcji aldolowej 2-(trimetylosiloksy)-furanu
z aldehydami w tych warunkach. Badania wstępne wskazywały na nietypowy przebieg reakcji
Mukaiyamy w sprzężonym układzie wiązań podwójnych enoloeteru sililowego wywołany
obecnością wody w środowisku reakcji (Schemat 1). Możliwość kontroli regioselektywności
reakcji dla tego typu substratów poprzez prostą zmianę rozpuszczalnika w celu otrzymania
pożądanego produktu addycji zachęcało do dalszych badań. Postanowiłam opracować
metodę komplementarną do winylogowej reakcji Mukaiyamy, prowadzącą do produktów
reakcji aldolowej. Uwagę skupiłam w szczególności na zastosowaniu w reakcji Mukaiyamy
siloksyfuranów oraz pochodnych sililowych estrów kwasu krotonowego. Dlatego też
głównym celem badań przedstawionych w niniejszej pracy było sprawdzenie, jaki wpływ na
przebieg
winylogowej
reakcji
karbonylowymi ma obecność
regioselektywność
Mukaiyamy
siloksyfuranów
z
różnymi
partnerami
wody. W pierwszej części pracy została określona
(α/γ) reakcji aldolowej 2-(trimetylosiloksy)-furanu prowadzonej
w obecności kwasu Lewisa. Do realizacji tego celu wykorzystałam prowadzone równolegle
reakcje w suchych rozpuszczalnikach organicznych oraz w środowisku wodnym.
Sprawdziłam także regioselektywność reakcji innych siloksyfuranów, posiadających większe
zatłoczenie steryczne wokół atomu węgla α względem grupy karbonylowej. Badania
obejmowały optymalizację warunków omawianej reakcji, prowadząc do otrzymania nowej
efektywnej metody syntezy pochodnych 2(5H)-furanonu w środowisku wodnym.
Kolejny etap pracy pozwolił mi określić uniwersalność opracowanej metody poprzez
zastosowanie różnych aldehydów aromatycznych, alifatycznych oraz estrów kwasu
pirogronowego w reakcji z siloksyfuranami. Otrzymałam szereg związków nieopisanych do
tej pory w literaturze, które mogą
być
wykorzystane w dalszych modyfikacjach.
Rozszerzenie badań miało na celu sprawdzenie, czy wpływ wody na regioselektywność
reakcji Mukaiyamy jest taki sam dla siloksyfuranów jak i łańcuchowych enoloeterów
sililowych, posiadających sprzężony układ wiązań podwójnych.
Mając na uwadze aspekty współczesnej syntezy organicznej, bardzo ważną częścią
zaplanowanych przeze badań było wprowadzenie do środowiska reakcji chiralnych kwasów
Lewisa. Umożliwiło to otrzymanie enancjomerycznie wzbogaconych alkoholi przy
zachowaniu łagodnych warunków reakcji. Ten fragment badań wymaga szczególnej uwagi,
jest to bowiem pierwszy przykład asymetrycznej katalitycznej reakcji Mukaiyamy
sprzężonych enoloeterów sililowych.
Ostatni etap pracy obejmował zastosowanie opracowanej metody w syntezie związku
pochodzenia naturalnego, posiadającego w swojej strukturze jednostkę budulcową, bazującą
na α-podstawionym pierścieniu 2(5H)-furanonu. W dwóch etapach otrzymałam wilozynę,
posiadającą między innymi właściwości przeciwzapalne. Zastosowanie reakcji Mukaiyamy
siloksyfuranów prowadzonej w roztworach wodnych umożliwiło znaczne uproszczenie
procedur
opisanych
w
literaturze
poprzez
wyeliminowanie
etapów
związanych
z wytworzeniem litopochodnych 2(5H)-furanonu bądź generowaniu enolanów boru.
1
Ollevier, T.; Bouchard, J.-E.; Desyroy, V. J. Org. Chem. 2008, 73, 331.