Treści multimedialne - kodowanie,
przetwarzanie, prezentacja
Odtwarzanie treści multimedialnych
Andrzej Majkowski
informatyka +
1
Model
atomu
Bohra
Wioletta Ewartowska
informatyka +
2
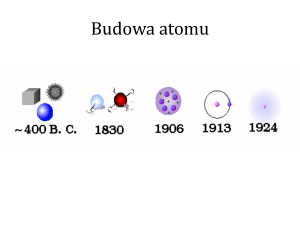
Model atomu Thomsona 1903r.
• Dodatnio naładowany
ładunek rozłożony jest w
całej objętości atomu,
a elektrony tkwią w nim
punktowo, tak jak rodzynki
w cieście.
• Atom jest elektrycznie
obojętny.
informatyka +
3
DOŚWIADCZENIE RUTHERFORDA
W 1911r. Ernest Rutherford
przeprowadził eksperyment, który
polegał na skierowaniu wiązki
cząsteczek alfa (mają one
ładunek dodatni równy 2e) na
cieniutką złotą folię (grubość
0,4µm).
informatyka +
4
DOŚWIADCZENIE RUTHERFORDA
Gdyby poprawna
była teoria
Thomsona,
cząstki a
powinny prawie
swobodnie
pokonywać
wnętrze atomu.
informatyka +
5
DOŚWIADCZENIE RUTHERFORDA
Gdyby poprawna
była teoria
Thomsona,
cząstki alfa
powinny
swobodnie
pokonywać
wnętrze atomu
6
informatyka +
Źródłoorginalne: http://m.teachastronomy.com/astropedia/article/The-Structure-of-the-Atom
MODEL ATOMU RUTHERFORDA
• Atom jest zbudowany z dodatnio
naładowanego jądra o ładunku Ze, a wokół
jądra w całej objętości zajmowanej przez
atom rozmieszczone jest Z elektronów.
• Prawie cała masa atomu skupiona jest w
jądrze.
• Średnica jądra jest 100 000 razy mniejsza od
średnicy całego atomu i wynosi około 10-15m
informatyka +
7
MODEL ATOMU RUTHERFORDA
Zgodnie z modelem Rutherforda elektron
poruszający się po orbicie z przyspieszeniem
dośrodkowym emituje falę
elektromagnetyczną, a co za tym idzie
zmniejsza się jego energia i odległość od
jądra. Atomy zatem powinny być nietrwałe, a
większość atomów jest stabilna….
informatyka +
8
MODEL BOHRA
Fakty doświadczalne znane w momencie
sformułowania postulatów przez Bohra
1913 r.:
• Znane były przybliżone rozmiary atomu i
jądra atomowego.
• Istniała już teoria Plancka dotycząca
pojęcia fotonu.
• Wiadomo było, że oddziaływania
pomiędzy jądrem atomu a elektronami jest
oddziaływaniem kulombowskim
(elektrostatycznym)
informatyka +
9
MODEL BOHRA
• Atom wodoru składa się z jednego
protonu (stanowiącego jądro atomu)
oraz z jednego elektronu.
• Proton i elektron posiadają identyczny
co do wartości ładunek elektryczny,
ale przeciwnego znaku.
informatyka +
10
MODEL BOHRA
• Pomiędzy elektronem i protonem
występuje siła oddziaływania
elektrostatycznego).
W naszym przypadku q1=q2=e
informatyka +
11
MODEL BOHRA
• Siła wzajemnego oddziaływania
elektrostatycznego, między protonem w
jądrze a elektronem na orbitach pełni rolę
siły dośrodkowej
informatyka +
12
MODEL BOHRA – Pierwszy postulat
Elektron nie może krążyć po dowolnej
orbicie. Dla danego elektronu
dozwolone są tylko takie orbity, dla
których moment pędu liczony
względem jądra jest całkowitą
wielokrotnością stałej Plancka
podzielonej przez 2π
informatyka +
13
MODEL BOHRA
m – masa elektronu
m=9,11.10-31kg
v- prędkość elektronu
rn – promień n-tej orbity
n- numer orbity
h – stała Plancka
h=6,63.10-34 Js
informatyka +
14
MODEL BOHRA - Promienie orbit w atomie wodoru
Elektron może krążyć w atomie wodoru
tylko po dozwolonej orbicie o ściśle
określonym promieniu spełniającym
zależność:
2
rn=n r1
rn – promień n-tej orbity
n – numer orbity
r1 – promień pierwszej orbity tzw.
promień Bohra r1=0,53.10-11m
15
MODEL BOHRA – energia elektronu
Całkowita energia elektronu w atomie
wodoru jest sumą:
– Dodatniej energii kinetycznej związanej z
ruchem elektronu po orbicie
– Ujemnej energii potencjalnej związanej z
elektrostatycznym przyciąganiem elektronu z
jądrem
informatyka +
16
MODEL BOHRA – energia elektronu
En – energia elektronu na n-tej orbicie
n – 1,2,3… numer orbity
A – stała dodatnia A= 13,6eV =2,2 .10-18J
informatyka +
17
MODEL BOHRA – drugi postulat
•Atom, którego elektron znajduje się na
orbicie stacjonarnej, nie promieniuje energii.
•Elektron w atomie może przeskoczyć z
orbity o mniejszym promieniu na orbitę o
większym promieniu, jeśli dostarczymy mu
(zaabsorbuje) odpowiednią porcje (kwant)
energii.
•Elektron w atomie może przeskoczyć z
orbity o większym promieniu na orbitę o
mniejszym promieniu, jeśli emituje
odpowiednią porcje (kwant) energii.
informatyka +
18
MODEL BOHRA – drugi postulat
Stan podstawowy: Elektron
ma najniższa energię
Widmo emisyjne powstaje
gdy elektron przechodzi z
orbity wyższej na orbitę
niższą.
Widmo absorpcyjne powstaje
gdy elektron pochłania
odpowiedni kwant
promieniowania i
przechodzi z orbity niższej
na orbitę wyższą.
informatyka +
19
MODEL BOHRA – drugi postulat
E=Em-Es
E -energia emitowanego
promieniowania.
Zgodnie z teorią Plancka
energia emitowanego
kwantu energii (fotonu)
jest równa:
n – częstotliwość (Hz)
l- długość fali (m)
informatyka
+
20
MODEL BOHRA – zadanie 1
a)Oblicz promienie kolejnych 5
orbit elektronu.
b)Narysuj model atomu wodoru
( 5 orbit) zachowując
odpowiednią skale i proporcje.
informatyka +
21
MODEL BOHRA – zadanie 2
W wyniku pochłonięcia fotonu
przez atom wodoru elektron
przeskoczył z orbity 1 na 4. Oblicz
częstotliwość i długość fali
pochłoniętego fotonu. Energia
atomu w stanie podstawowym
wynosi E1= -13,6eV.
informatyka +
22
MODEL BOHRA – zadanie 3*
Korzystając z reguły kwantowania
momentu pędu elektronu w atomie ( I
postulat) oraz z warunku równowagi siły
elektrostatycznej i odśrodkowej
wyprowadź wzór na dyskretne promienie
stacjonarnych orbit atomu wodoru
informatyka +
23
MODEL BOHRA – zadanie 4*
Korzystając ze wzoru na energię kinetyczną i
energie elektryczną potencjalną układu
proton – elektron zapisz wzór na całkowitą
energię atomu.
Aby otrzymać wzór na dozwolone wartości energii
(poziomy energetyczne) atomu wodoru do otrzymanego
wzoru na całkowitą energię atomu podstaw za r we
wzorze wyrażenie na rn ( zadanie 3).
informatyka +
24
MODEL BOHRA – zadanie 5*
Korzystając z drugiego postulatu Bohra i
wzoru na dozwolone wartości energii
(poziomy energetyczne) atomu wodoru
wyprowadź wzór Rydberga
R – stała Rydberga R=1,0974.107 m-1
s – numer orbity na która przechodzi elektron,
m – numer orbity z której przeskakuje elektron
informatyka +
25