Przedmiot: Chemistry HL
Poziom: rozszerzony
Opis kursu:
Chemia jest podstawową nauką doświadczalną. Cele nauczania chemii są podporządkowane
założeniom IBO Learner Profile. Kurs rozszerzony chemii stwarza możliwości rozwoju
umiejętności eksperymentalnych na poziomie zaawansowanym. Uczniowie poznają naukowe
metody i techniki, zdobędą wiedzę i umiejętności wymagane w praktyce. Powinni swoją wiedzę
wykorzystywać do rozpoznawania problemów o globalnym znaczeniu i poszukiwać naukowych
rozwiązań i odpowiedzi na fundamentalne pytania. Uczniowie będą mieli możliwości używania
technologii komputerowych i komunikacyjnych do zdobywania informacji oraz przetwarzania
danych w pracy laboratoryjnej. Szczególnie ważne jest, aby uczniowie rozwinęli zdolności analizy,
ewaluacji i syntezy informacji naukowych.
Nauczanie chemii związane jest z TOK, czyli teorią wiedzy. Razem z innymi przedmiotami
zachęca uczniów do rozważnego i krytycznego korzystania z wiedzy oraz dostrzegania związków
między nauką i codziennym życiem.
Nauka chemii szczególnie podkreśla potrzebę posiadania wiedzy, bycia dociekliwym, myślącym i
podejmującym wyzwania człowiekiem o otwartym umyśle – obywatelem współczesnego świata.
Uczniowie powinni być świadomi, w jaki sposób chemicy pracują i komunikują się między sobą.
Cele:
Głównym założeniem kursu jest wykształcenie w uczniu potrzeby zdobywania informacji i
szukania odpowiedzi na pytania dotyczące zjawisk i przemian chemicznych z naciskiem na
interkulturowość i współpracę międzynarodową, otwartość i krytyczne myślenie.
Nasze priorytety to:
Wykorzystanie metody naukowej z naciskiem na eksperymenty biologiczne,
Rozwijanie w uczniach kreatywności, stawianie im wyzwań,
Dostarczanie im wiedzy, zaznajamianie z metodami i technikami niezbędnymi w dobie
wysokiego rozwoju nauki i techniki nowoczesnych społeczeństw,
Uczenie ich stosowania wiedzy i umiejętności w praktyce,
Wykorzystanie pracy zespołowej, wykształcenie umiejętności efektywnej współpracy i
komunikacji w grupach,
Uświadomienie im związku pomiędzy różnymi dyscyplinami naukowymi,
Podkreślanie potrzeby międzynarodowej współpracy przy gromadzeniu i wymianie
informacji,
Zachęcanie do wykorzystania technologii informacyjnej na wszystkich etapach pracy.
Zadania:
Prezentowanie i zrozumienie: naukowych faktów, metod badawczych, technik, terminologii,
metod prezentowania informacji
Stosowanie i używanie: naukowych faktów, koncepcji, metod i technik, terminologii w celu
efektywnej komunikacji, właściwych metod prezentowania naukowych informacji
Konstruowanie, analizowanie i ewaluacja: hipotez, problemów badawczych,
przewidywanych wyników, naukowych wyjaśnień
Prezentowanie umiejętności współpracy, odpowiedzialności potrzebnej do efektywnych
badań naukowych
Prezentowanie umiejętności manualnych potrzebnych do precyzyjnego i bezpiecznego
przeprowadzenia badań naukowych
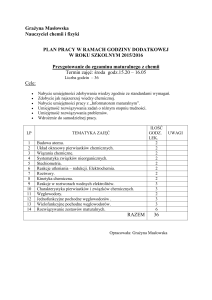
Tematyka zajęć:
Dział 1. Stechiometria
Podstawowe stany materii
Przemiany chemiczne
Mol, masa molowa
Wzory rzeczywiste i empiryczne
Równania reakcji chemicznych
Stechiometria reakcji chemicznych
Równanie gazu doskonałego pV=nRT
Stężenie molowe i wagowe roztworu
Dział 2. Budowa atomu
Cząstki budujące atom
Izotopy
Konfiguracja elektronowa na powłokach i podpowłokach
Energie jonizacji pierwiastków
Dział 3. Budowa układu okresowego pierwiastków
Budowa układu okresowego
Zależność pomiędzy budową atomu a położeniem pierwiastka w układzie okresowym
Właściwości pierwiastków bloku d – metale przejściowe
Związki kompleksowe
Spektometria masowa
Dział 4. Wiązania chemiczne
Wiązanie jonowe
Wiązania kowalencyjne
Odziaływania międzycząsteczkowe
Wiązanie metaliczne
Właściwości związków chemicznych w kontekście wiązań chemicznych
Metoda VSEPR
Struktury geometryczne cząsteczek i jonów
Hybrydyzacja
Dział 5. Termochemia
Entalpia reakcji chemicznej
Reakcje egzotermiczne i endotermiczne
Prawo Hessa
Cykl Borna-Habera
Energia wiązań
Entalpia tworzenia i spalania
Entropia i spontaniczność reakcji
Dział 6. Kinetyka
Szybkość reakcji
Energia aktywacji
Teoria zderzeń
Krzywe przebiegu reakcji
Stała szybkości reakcji
Rząd reakcji
Mechanizmy przebiegu reakcji
Energia aktywacji
Dział 7. Równowaga reakcji
Reakcje przebiegające z ustaleniem stanu równowagi – reakcje odwracalne
Stała równowagi reakcji
Reguła przekory
Równowaga ciecz – gaz
Prawo działania mas
Entalpia swobodna
Dział 8. Kwasy i zasady
Teorie kwasowo-zasadowe: Brønsteda-Lowry’ego, Lewisa
Reakcje pomiędzy kwasami i zasadami
Skala pH roztworu
Mocne i słabe kwasy i zasady
Stała dysocjacji
Miareczkowanie i wskaźniki
Krzywe miareczkowania
Hydroliza soli
Roztwory buforowe
Dział 9. Reakcje utleniania i redukcji
Stopnie utlenienia pierwiastków
Utleniacze i reduktory
Bilans elektronowy reakcji redoks
Ogniwa galwaniczne
Siła elektromotoryczna ogniw
Elektroliza związków stopionych i ich roztworów
Dział 10. Chemia organiczna
Alkany
Alkeny
Alkohole
Aldehydy
Ketony
Kwasy karboksylowe
Estry
Fluorowcopochodne węglowodorów
Aminy i amidy
Nitryle
Izomery i homologi
Reakcje eliminacji, substytucji i kondensacji
Drogi syntezy organicznej
Stereoizomeria
Dział 11. Niepewność i błąd pomiaru
Błąd pomiaru
Niepewność pomiaru
Wykresy dla wybranych reakcji chemicznych
Spektroskopowa identyfikacja związków organicznych
Opcja B. Biochemia
Aminokwasy i białka
Tłuszcze
Mikro i makroskładniki
Hormony i enzymy
Witaminy
Kwasy nukleinowe
Oddychanie
Stereochemia biomolekuł
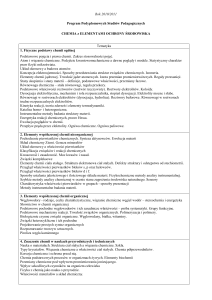
Wymagania i egzaminy:
Ocenianie zewnętrzne
Składniki oceniania
Arkusz 1
Arkusz 2
Arkusz 3
Ocenianie na poziomie HL
40 pytań wielokrotnego wyboru (około 15 wspólnych z
poziomu SL plus 5 innych z materiału podstawowego oraz
około 20 z materiału dodatkowego AHL)
Krótkie odpowiedzi oraz dłuższe wypowiedzi dotyczące
materiału podstawowego oraz materiału dodatkowego AHL
Pytania będą dotyczyły materiału podstawowego,
dodatkowego AHL oraz części opcjonalnej.
Część A: jedno pytanie oparte na bazie danych oraz kilka
krótkich odpowiedzi dotyczących pracy doświadczalnej.
Część B: Krótkie odpowiedzi oraz dłuższe wypowiedzi
dotyczące części opcjonalnej.
Czas
1 godz.
2 godz.
15 min.
1godz.
15 min.
Ocenianie wewnętrzne
Wymagania wewnętrznego oceniania koncentrują się głównie na ocenie zajęć praktycznych –
badań i projektu międzyprzedmiotowego. Aspekty oceniania wewnętrznego to:
D -Projektowanie (planowanie) – zdefiniowanie problemu, podział zmiennych,
doskonalenie metod gromadzenia danych
DCP - Gromadzenie i przetwarzanie danych – zapis i przetwarzanie danych bezpośrednich,
prezentacja przetworzonych danych
CE – Wnioskowanie i ewaluacja – wnioskowanie z przeprowadzonych badań i ewaluacja
wyników badań, poprawa jakości badań
MS – Umiejętności manipulacyjne – postępowanie zgodnie z instrukcją, stosowanie technik
badawczych, bezpieczeństwo pracy
PS - Umiejętności personalne
D, DCP oraz CE są oceniane dwukrotnie, umiejętności manipulacyjne tylko raz na koniec
nauki, a umiejętności personalne również raz, ale podczas pracy nad projektem 4 grupy.