Joanna Lamorska
[email protected]
Państwowa Wyższa Szkoła Zawodowa
w Chełmie
Instytut Nauk Rolniczych
WŁAŚCIWOŚCI ZDROWOTNE TŁUSZCZÓW ZWIERZĘCYCH I ROŚLINNYCH
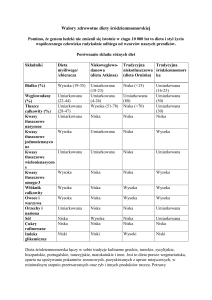
Tłuszcze zwierzęce stanowią głównie źródło nasyconych kwasów tłuszczowych
(SFA). Kwasy te zawarte są w największych ilościach w tłuszczu wieprzowym: słoninie i
smalcu a także w mięsie, przetworach mlecznych. Z kolei tłuszcz oraz mięso ryb obfitują w
wielonianasycone kwasy tłuszczowe (PUFA)
Tabela 1. Zawartość procentowa tłuszczu w wybranych produktach (Kołżyn-Krajewska i Sikora 2007,
Ziemlański i Socha 1999)
Rodzaj produktu
Zawartość procentowa tłuszczu (%)
mięso w zależności od gatunku
3-55
mięso ryb w zależności od gatunku
0,1-13
mleko pełne
3,2
twaróg
1-9
sery dojrzewające
17-30
słonina
83-95,5
smalec
99,3-99,6
masło extra
82
Tłuszcz mleczny oprócz nasyconych kwasów tłuszczowych zawiera także składniki
prozdrowotne, które sprawiają, że mleko i jego przetwory stanowią ważny składnik diety.
Ponadto mleko krowie ma bardzo zbliżoną do mleka kobiecego strukturę sterospecyficzną
czyli rozmieszczenie kwasów tłuszczowych w triacyloglicerolach przez co jest dobrze
przyswajalne przez organizm dziecka i pozwala na utrzymanie właściwego poziomu wapnia
(Cichon i Stołyhwo 1999).
Tabela 2. Wpływ na zdrowie człowieka wybranych składników tłuszczu mlecznego (Stołyhywo i
Rutkowska 2007, Russo i in. 1999, Ip i in. 1996, Ip i in. 2003)
Rodzaj oddziaływania na zdrowie
człowieka
Składnik tłuszczu mlecznego
kwas masłowy C4: 0
antykancerogenne poprzez hamowanie
syntezy
DNA
jąder
komórek
nowotworowych
kwas rumenowy CLA C18:2 (9c, 11t)
przeciwmiażdżycowe, bakteriostatyczne, i
antynowotworowe
i jego izomery
Kwasy
tłuszczowe
średniołańcuchowe C6:0 – C14:0
krótko-
przeciwgrzybiczne i przeciwbakteryjne,
źródło energii wykorzystywanej do
przemiany materii oraz utrzymywania
stałej temperatury ciała
α-tokoferol
witamina E, antyutleniacz
skwalen
prekursor cholesterolu
karetonoidy
witamina A
cholesterol
reguluje przepuszczalność błon lipidowych
komórek, jest prekursorem hormonów
min.
progesteronu,
estronu
testosteronu,kortyzolu
Kwas CLA jest syntetyzowany w przewodzie pokarmowym przeżuwaczy i obecny jest
oprócz mleka i jego produktów w mięsie wołowym, jagnięcym i cielęcym. CLA wykazuje
wielokierunkowe działanie korzystne w organizmie: dzięki właściwościom antyoksydacyjnym
zapobiega procesom miażdżycowym i nowotworowym (Stachowska i in. 2002) a także
obniżaja zawartość tłuszczu w masie ciała (Bartnikowska i in. 1999). Sprzężony kwas linolowy
obniża zawartość triglicerydów w surowicy krwi, poziom cholesterolu całkowitego a także
frakcji LDL (Pariza i in. 2000) Badania przeprowadzone na zwierzętach wykazały skuteczność
kwasu CLA w hamowaniu rozwoju nowotworów skóry, jelita grubego, sutka i żołądka.
Powstające nowotwory charakteryzują się mniejszymi rozmiarami a ich przerzuty są
ograniczone lub całkowicie zahamowane. Przy czym antynowotworowe działanie CLA jest
optymalne przy zawartości w diecie około 1% (Jelińska 2005). Kwas CLA podawany
zwierzętom zwiększa ich odporność na toksyny, w tym E.coli (Migdał i in.2002).
Mięso i olej rybny także jest źródłem wartościowego tłuszczu w skład którego
wchodzą następujące kwasy tłuszczowe:
kwas arachidonowy (AA) (C 20:4 n-6) zawarty w mięsie i olejach rybich
kwas eikozapentaenowy (EPA) (C 20:5 n-3)
kwas dokozaheksaenowy (DHA) (C 22:6 n-3).
EPA i DHA zawarte są w algach i fitoplanktonie a pośrednio w olejach i mięsie ryb morskich
takich jak: makrela, śledź czy dorsz (Bartach i in. 1999). Kwasy AA, EPA oraz DHA należą do
kwasów eikozanowych. Pełnią one istotną rolę w organizmie: są budulcem błon
komórkowych, obniżają poziom triglicerydów we krwi, obecne są w dużych stężeniach w
tkance nerwowej i siatkówce (Karłowicz-Bodalska i Bodalski 2007) a także stanowią
substancje wyjściowe w procesie syntezy eikozanoidów czyli hormonów tkankowych.
Substancje te do których zaliczamy prostaglandyny, prostacykliny, tromboksany, leukotrieny
i lipoksyny, należą do grupy mediatorów lipidowych.
Eikozanoidy wywodzące się od kwasu AA odznaczają się wysoką aktywnością
biologiczną w porównaniu do eikozanoidów pochodnych kwasu EPA i w niewielkim stężeniu
wykazują działanie przeciwzapalne, przeciwmiażdżycowe oraz wpływają na rozkurcz mięśni
gładkich naczyń krwionośnych (wazodilatacja) (Karłowicz-Bodalska i Bodalski 2007). Jednak
w dużym stężeniu eikozanoidy pochodne AA wzmagają reakcje anafilaktyczne, nasilają
zmiany miażdżycowe, działają prozapalnie i zakrzepowo. Mają także dodatni wpływ na
rozwój komórek i tkanki nowotworowej.
Eikozanoidy wywodzące się od kwasu EPA wykazują podobny jednak o wiele słabszy
wpływ na organizm człowieka (James i in. 2000).
Tabela 3. Funkcje biologiczne wybranych eikozanoidów (James i in. 2000, Jelińska 2005)
Funkcja biologiczna wybranych eikozanoidów
pochodne EPA
pochodne AA
PGE3
–działanie
prozapalne,
syntetyzowany z bardzo małą wydajnością
PGE2działanie
pronowotworowe
PGI3działanie
antyagregacyjne
PGI2działanie
antyagregacyjne
wazodilatacyjne
i
prozapalne,
wazodilatacyjne
TXA3- słabe działanie proagregacyjne i
skurczowe
TXA2-bardzo
silne
proagregacyjne i skurczowe
LTB5- niewielkie działanie prozapalne
LTB4-silne
działanie
proalergiczne
i
działanie
pozapalne
i
Przykładem oleju rybnego o szerokim zastosowaniu w farmakologii jest tran
otrzymywany z wątrób dorszy wątłuszy (Gadus morrhua) oraz innych ryb z gatunku
dorszowatych. Tran oprócz długołańcuchowych kwasów wielonienasyconych zawiera także
witaminy A i D. Olej ten wykazuje działanie przeciwzapalne, przeciwmiażdżycowe oraz
immunotropowe. Podawany pacjentom z silnymi i umiarkowanymi bólami mięśniowymi
powoduje zmniejszenie nasilenia bólu. Działanie przeciwzapalne tranu było sprawdzane w
leczeniu nieswoistych stanów zapalnych jelit, wykazano jego wysoką skuteczność w terapii
choroby Leśniowskiego-Crohn’a (Karłowicz-Bodalska i Bodalski 2007).
Kwasy z rodziny ω-3 zawarte w tranie powodują także obniżenie poziomu triglicerydów we
krwi: dzienne spożycie powyżej 4 mg kwasów ω-3 może zredukować poziom triglicerydów o
25-40% (Dudzisz-Śledź i in. 2006). Suplementacja preparatami oleju rybnego niemowląt
urodzonych o czasie wykazała główną rolę kwasu DHA w rozwoju narządu wzroku, z kolei
niedobór kwasu AA u wcześniaków wpływa opóźniająco na ich wzrost i rozwój
psychomotoryczny (Karłowicz-Bodalska i Bodalski 2007). Mleko kobiece zawiera w swym
składzie kwasy EPH i DHA w ilościach od 0,05% do 1,9% dlatego też zaleca się aby sztuczne
mieszanki do karmienia niemowląt także zawierały kwasy z rodziny ω-3 (Dudzisz-Śledź i in.
2006).
Liczne badania udowodniły negatywny wpływ diety obfitującej w nasycone kwasy
tłuszczowe na zdrowie człowieka (Willet i in. 1995). Kwasy palmitynowy, mirystynowy i
stearynowy wykazują właściwości hiperlipemizujace oraz powodują rozwój miażdżycy i
choroby niedokrwiennej serca.
Jednak niektóre prace (Sundram i in. 1994) podają, że w przypadku pacjentów
normolipemicznych kwas palmitynowy może redukować poziom cholesterolu całkowitego. Z
kolei kwas stearynowy na skutek blokady wchłaniania cholesterolu z pożywienia wpływaja na
obniżenie jego stężenia w osoczu krwi i wątrobie oraz powoduje redukcję cholesterolu w
surowicy krwi (German i Gillard 2004). Wysokotłuszczowa dieta w krajach
wysokorozwiniętych stanowi jedną z głównych przyczyn powstawania nowotworów
prostaty, okrężnicy oraz piersi (Bartsch i in. 1999, Rose 1997, Willett 1995). Jednak poziom
tłuszczu w diecie jest tylko jednym z czynników wywołujących choroby nowotworowe. Inną
ważną przyczyną jest rodzaj spożywanych kwasów tłuszczowych. Liczne badania wykazały, że
wysoki poziom kwasów SFA pochodzących ze smalcu i łoju wołowego lub z olejów
palmowego i orzecha kokosowego hamuje proces karciogenezy w porównaniu do tych
samych ilości WNKT z olejów roślinnych (Imrhan i Hsueh 1998, Hopkins i in. 1981, Carroll i
Hopkins 1979 cyt. za Jelińska 2005). Stosowanie jako tłuszczu do smażenia smalcu i masła
przy jednoczesnym nadmiernym spożyciu mięsa wieprzowego i wołowego prowadzi do
nadwagi i otyłości a także choroby niedokrwiennej serca (Pawelec 2005, Ziemlański i Socha
1999). Nadmiar nasyconych kwasów tłuszczowych powoduje podwyższenie stężenia w
osoczu krwi cholesterolu całkowitego oraz frakcji cholesterolu LDL odpowiedzialnego za
powstawanie zmian miażdżycowych, wpływa na podwyższenie krzepliwości krwi (Cuchel i in.
2006, Krzymański i in. 2009).
Miażdżyca jest główną przyczyną chorób sercowo-naczyniowych, sprzyjają jej
nadciśnienie tętnicze i wysoki poziom cholesterolu wynikające ze złych nawyków
żywieniowych oraz palenie papierosów. Do czynników ryzyka zalicza się też otyłość i
cukrzycę, które występują najczęściej w wyniku wysokiego spożycia nasyconych kwasów
tłuszczowych.
Rozwój miażdżycy następuje już w drugiej dekadzie życia człowieka: pod
śródbłonkiem wyścielającym ściany tętnic zaczyna gromadzić się cholesterol. Przez następne
trzy dekady ściana tętnicy pogrubia się co, w konsekwencji prowadzi do powstania złogów
miażdżycowych, które zawężają światło tętnicy i poważnie ją osłabiają. Zwężenie światła
tętnicy wywołuje niedokrwienie serca lub kończyn dolnych powodując ból. W szóstej
dekadzie życia może dojść do pęknięcia tętnicy i powstania skrzepu, który blokuje tętnice.
Skutkiem tych zmian jest zawał bądź udar mózgu. W przypadku wystąpienia zmian
miażdżycowych w tętnicach mózgu dochodzi do wystąpienia arteriosklerozy (Krzymański i in.
2009).
Profilaktyka zmian miażdżycowych polega odpowiedniej diecie bogatej w kwasy
jednonienasycone i wielonienasycone oraz warzywa i owoce, zaprzestaniu palenia oraz
ograniczeniu alkoholu. Zalecana dzienna dawka tłuszczów w diecie człowieka nie powinna
przekraczać 30% zapotrzebowania energetycznego, przy czym tłuszcze nasycone winny
stanowić maksymalnie 10% dawki a izomery tłuszczów nasyconych mniej niż 2% (Ziemlański i
Socha 1999).
Tłuszcze roślinne ze względu na zawartość głównie kwasów tłuszczowych
nienasyconych stanowią ważny składnik pożywienia. Liczne prace udowodniły pozytywny
wpływ na zdrowie diety bogatej w nieprzetworzone oleje charakteryzujących się obecnością
także innych prozdrowotnych składników: antyutleniaczy, polifenoli i steroli, które odgrywają
istotną rolę w neutralizacji wolnych rodników, produktów przemiany materii.
Dominującym w pożywieniu kwasem jednonienasyconym jest kwas oleinowy.
Stanowi on główny składnik wszystkich olejów a szczególnie w dużych ilościach można go
znaleźć w oliwie z oliwek i oleju rzepakowym. Kwasy jednonienasycone obniżają poziom
frakcji cholesterolu LDL nie wpływając jednocześnie na poziom cholesterolu HDL (Krzymański
i in. 2009). Zmniejszają także ryzyko perooksydacji lipidów we frakcjach HDL i LDL a tym
samym zapobiegają odkładaniu się blaszek miażdżycowych wykazując więc działanie
antymiażdżycowe. Sugeruje się także, że dieta bogata w tłuszcze jednonienasycone jest
skuteczna w leczeniu otyłości, cukrzycy i zespołu metabolicznego (Krzymański i in. 2009).
Kwasy wielonienasycone w przeciwieństwie do nasyconych i jednonienasyconych
nie są wytwarzane przez organizm, ponieważ nie posiada on enzymów odpowiedzialnych za
wprowadzenie wiązań podwójnych do łańcucha węglowego kwasu w pozycje n-3 i n-6.
Dlatego te kwasy tłuszczowe zostały nazwane NNKT (Niezbędne Nienasycone Kwasy
Tłuszczowe) lub EFA (Essential Fatty Acids). Do NNKT należą kwasy z rodziny ω-6 i ω-3. Kwasy
ω-6 zawarte są w dużych ilościach w olejach kukurydzianym, rzepakowym, sojowym,
słonecznikowym natomiast oleje lniany, rzepakowy i oleje rybne są źródłem kwasów ω-3.
Normy żywieniowe dotyczące dziennego spożycia NNKT zalecają aby spożycie kwasów
rodziny omega-6 dostarczało od 2 do 8% energii a dieta powinna zwierać 2 g kwasu ALA i 200
mg długołańcuchowych kwasów omega-3 (Achremowicz i Szary-Sworst 2005).
kwas α-linolenowy
ALA 18:3 n-3
kwas linolowy
LA 18:2 n-6
desaturaza
kwas γ-linolenowy
GLA 18:3 n-6
kwas ikozapentaenowy
EPA 20:5 n-3
eikozanoidy
kwas dokozaheksaenowy
DHA 22:6 n-3
elongaza
kwas arachidonowy
AA 20:4 n-6
eikozanoidy
Rys.1. Uproszczony schemat metabolizmu wielonienasyconych kwasów tłuszczowych
Szlaki metaboliczne kwasów omega-3 i omega-6 przebiegają przy udziale tych
samych układów enzymatycznych, dlatego też nadmierny udział kwasu LA w diecie
powoduje ograniczenie syntezy EPA i DHA z kwasu ALA, wiec także i eikozanoidów
pochodnych EPA i DHA. Jednocześnie nasila się kaskada kwasu AA i jego pochodnych
hormonów tkankowych, które wykazują działanie kancerogenne i prozapalne (Rose 1997,
Larrson i in. 2004, Jelińska 2005). Z tego względu ważne jest zachowanie odpowiednich
proporcji w diecie między kwasami omega-3 i omega-6 (Simonsen i in. 1998). Stosunek ten
powinien wynosić 1:3 (Krzymański i in. 2009) 1:5 (Marciniak-Łukasiak i Krygier 2004).
Obecnie ta proporcja jest zaburzona i oscyluje między 1:20-1:30 (Simopoulos 1999). Wynika
to z diety obfitej w oleje zawierające duże ilości kwasu linolowego przy jednoczesnym
znacznym ograniczeniu spożycia ryb. Oleje obfitujące w wielonienasycone kwasy tłuszczowe
omega-6 mogą obniżać cholesterol LDL przy jednoczesnym zmniejszeniu stężenia
cholesterolu HDL (Krzymański i in. 2009).
Izomery trans nienasyconych kwasów tłuszczowych powstają w wyniku procesów
uwodornienia, można je znaleźć w wyrobach cukierniczych i utwardzanych margarynach
(Krzymański i in. 2009). Kwasy PUFA o konfiguracji trans są bardziej szkodliwe od kwasów
nasyconych, ponieważ zwiększają stężenie frakcji cholesterolu LDL i jednocześnie obniżają
zawartość cholesterolu HDL w surowicy krwi (Hunter 2006, Krzymański i in. 2009).
Zaobserwowano także związek między niską masą urodzeniową oraz mniejszym obwodem
głowy noworodków a obecnością w diecie matek izomerów trans nienasyconych kwasów
tłuszczowych przy jednocześnie zmniejszonej zawartości kwasów PUFA (Hornstra 2000,
Ziemlański i Socha 1999). Kwas elaidynowy izomer trans kwasu C 18:1 jest składnikiem
blaszki miażdżycowej i może wpływać na procesy utleniania złogów miażdżycowych
(Stachowska i in. 2002). Dowiedziono także niekorzystny wpływ izomerów trans kwasów
wielonienasyconych między innymi na poziom testosteronu, wydajność przemiany kwasu LA
do AA (Ziemlański i Socha 1999).
Oleje roślinne zawierające duże ilości kwasów NNKT powinny być spożywane na
zimno, ponieważ pod wpływem wysokiej temperatury ulegają utlenieniu i stają się źródłem
szkodliwych produktów peroksydacji lipidów. Bardziej stabilne są tłuszcze roślinne, których
podstawą są kwasy jednonienasycone.
LITERATURA:
Achremowicz K., Szary-Sworst K., 2005. Wielonienasycone kwasy tłuszczowe czynnikiem poprawy
stanu zdrowia człowieka. ŻYWNOŚĆ. Nauka. Technologia. Jakość., 44, 23-35.
Bartsch H., Nair J., Owen N.W., 1999. Dietary polyunsaturated fatty acids and cancers of the breast
and colorectum: emerging evidence for their role as risk modifiers. Carcinogenesis, 20, 2209-2218.
Bartnikowska E., Obiedziński M., Grześkiewicz S., 1999. Rola i znaczenie żywieniowe sprzężonych
dienów kwasu linolowego. Przemysł Spożywczy, 53, 16-18, 42.
Cichon R., Stołyhwo A., 1999. Charakterystyka tłuszczów spożywczych dla dzieci. Pediatria
Współczesna, Gastroenterologia, Hepatologia i Żywienie Dziecka, 1, 151-154.
Cuchel M., Rader D.J., 2006. Macrophage reverse cholesterol transport key to the regression of
atherosclerosis? Journal of the American Heart Association, Circulation, 113, 2548-2555.
Dudzisz-Śledź M., Śledź A., Jażdżewski P., 2006. Nienasycone kwasy tłuszczowe a zdrowie człowieka.
Medycyna Rodzinna, 4, 78-81.
German J.B., Gillard C.J., 2004. Saturated fats: what dietary intake. Am. J. Clin. Nutr., 80, 550-559.
Hornstra G., 2000. Essential fatty acids in mothers and their neonates. Am. J. Clin. Nutr., 71, 12621269.
Hunter J.E., 2006. Dietary trans fatty acids: review of recent human studies and food industry
responses. Lipids, 41, 967-992.
Ip C., Briggs S.P., Haegele A.D., Thompson H.J., Storkson J., Scimeca J.A. 1996. The efficacy of
conjugatet linoleic acid in mammary cancer prevention is independent of the level or type of fat in
the diet. Carcinogenesis, 17, 1045-1050.
Ip M.M., Masso-Welch P.A., Ip C., 2003. Prevention of mammary cancer with conjugated linoleic
acid: role of the stroma and the epithelium. Journal of Mammary Gland Biology and Neoplasia, 8,
103-118.
James M.J., Gibson R.A., Cleland L.G., 2000. Dietary polyunsaturated fatty acids and inflammatory
mediator production. Am. J. Clin. Nutr., 71, 343-348.
Jelińska M., 2005. Kwasy tłuszczowe – czynniki modyfikujące procesy nowotworowe. Biul. Wydz.
Farm. AMW, 1.
Karłowicz-Bodalska K., Bodalski T., 2007. Nienasycone kwasy tłuszczowe, ich właściwości biologiczne i
znaczenie w lecznictwie. Postępy Fitoterapii, 1, 46-56.
Kołżyn-Krajewska D., Sikora T., Towaroznastwo żywności. WSiP, Warszawa 2007.
Krzymański J., Bartkowiak-Broda I., Krygier K., Szostak W.B., Tys J., Ptasznik S., Wroniak M., Teraz
rzepak. Teraz olej . Olej rzepakowy-nowy surowiec, nowa prawda II. Polskie Stowarzyszenie
Producentów Oleju, Warszawa 2009.
Larrson S.C., Kumlin M., Ingelman-Sundberg M., Wolk A., 2004. Dietary long-chain n-3 fatty acids for
the prevention of cancer: a review of potential mechanisms. Am. J. Clin. Nutr., 79, 935-945.
Marciniak-Łukasiak K., Krygier K., 2004. Charakterystyka kwasów omega 3 iich zastosowanie w
żywności funkcjonalnej. Przemysł Spożywczy, 12, 32-36
Migdał W., Barowicz T., Borowiec F., Pieszka M., 2002. Wpływ dodatku oleju słonecznikowego lub
CLA w dawkach pokarmowych dla tuczników na umięśnienie i profil kwasów tłuszczowych w
tkankach. Rośliny Oleiste IHAR, 23, 187-200.
Pariza M.W., Park Y., Cook M.E. 2000. Mechanisms of action of conjugated linoleic acid: Evidence and
speculation. Proc. Soc. Exp. Biol. Med. 223: 8-13.
Pawelec M., 2005. Preferencje żywieniowe pacjentów Kliniki Kardiochirurgii PAM w Szczecinie. Ann.
Univ. Mariae Curie-Skłodowska, 60, 255-259.
Rose P.D., 1997. Dietary fatty acids and cancer. Am. J. Clin. Nutr., 66, 9985-10038.
Russo G.I., Della Pietra V., Mercurcio C,. Palumbo R., Iacomino G., Russo M., Tosto M., Zappia V.,
1999. Protective effects of butyric acid in colon cancer. Adv. Exp. Med. Biol., 472, 131-147
Simonsen N., van't Veer P., Strain J.J., Martin-Moreno J.M., Huttunen J.K., Fernández-Cerhuet
Navajas J., Martin B.C., Thamm M., Kardinaal A.F.M., Kok F.J., Kohlmeier L., 1998. Adipose tissue
omega-3 and omega-6 fatty acid content and breast cancer in the EURAMIC Study. Am. J. Epidemiol.,
147, 342-352.
Simopoulos A.P., 1999. Essential fatty acids in health and chronic disease. Am. J. Clin. Nutr., 70, 560569.
Stachowska E., Dołęgowska B., Chlubek D., Szumiłowicz H., Gutowski P., Turowski R., Samad R., 2002.
Trans unsaturated fatty acids are components of atheromatous plaque., Acta Angiol., 8, 99-104.
Stołyhwo A., Rutkowska J., Tłuszcz mleczny: struktura, skład i właściwości prozdrowotne. W: Chemia
żywności odżywcze i zdrowotne właściwości składników żywności tom III, Sikorski Z.E. (Red.),
Wydawnictwa Naukowo-Techniczne, Warszawa 2007, 39-89.
Sundram K., Hayes KC., Siru O.H., 1994. Dietary palmitic acid results in lower serum cholesterol than
does a lauric-myristic acid combination in normolipemic humans. Am. J. Clin. Nutr., 59, 841-846.
Willett W.C., 1995. Diet, nutrition, and avoidable cancer. Environmental Health Perspectives, 103,
165-170.
Willett W.C., Stampfer M.J., Colditz G.A., Rosner B.A., Speizer F.E., 1995. Relation of meat, fat and
fiber intake to the risk of colon cancer in a prospective study among women., The New Journal
England of Medicine, 323, 1664-1672.
Ziemlański Ś., Socha P., 1999. Normy i zalecenia dotyczące spożycia tłuszczów ze szczególnym
uwzględnieniem dzieci oraz kobiet ciężarnych i karmiących. Pediatria Współczesna.
Gastroenterologia, Hepatologia i Żywienie Dziecka, 1, 139-148.