Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
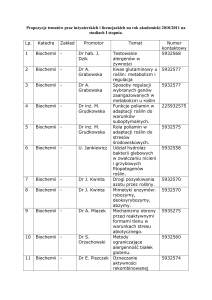
Inhibicja enzymatyczna
Każdą substancję, która zmniejsza szybkość reakcji katalizowanej przez enzym można
uważać za inhibitor. Hamowanie aktywności enzymów jest jednym z głównych sposobów
regulacji metabolizmu komórki i jedną z najważniejszych procedur diagnostycznych
stosowanych przez enzymologów. Analiza inhibicji enzymatycznej daje sugestie co do
specyficzności enzymów, budowy centrum aktywnego enzymu i kinetyki reakcji. W życiu
codziennym inhibitory enzymów spotykamy w postaci leków, antybiotyków, środków
konserwujących, toksyn i trucizn. Inhibitory działają na różne sposoby, poniżej omówimy
najprostsze przykłady mechanizmów inhibicji.
Inhibicja kompetycyjna
Inhibitor kompetycyjny (współzawodniczy) to substancja, która łączy się z wolnym
enzymem w sposób, który nie pozwala na związanie substratu przez cząsteczkę enzymu.
Oznacza to, że inhibitor i substrat wyłączają się wzajemnie, najczęściej z powodu
współzawodnictwa o to samo miejsce w cząsteczce enzymu. Inhibitor kompetycyjny może
być niemetabolizowalnym analogiem lub pochodną substratu, alternatywnym substratem lub
produktem reakcji. Klasycznym przykładem inhibitora współzawodniczego jest kwas
malonowy, który hamuje aktywność dehydrogenazy bursztynianowej (oksydoreduktaza
występująca w cykl Krebsa). Ponieważ kwas malonowy ma tylko jedną grupę metylenową to
nie może ulec reakcji utlenienia jak bursztynian. Może tylko połączyć się z enzymem w
kompleks EI, a kompleks może zdysocjować do wolnych E i I. Innym klasycznym
przykładem tego rodzaju inhibicji jest hamowanie przez amid kwasu sulfanilowego
biosyntezy kwasu foliowego z jego prekursora kwasu p-aminobezoesowego.
Istnieją przykłady inhibicji „współzawodniczej” powodowanej przez związki niepodobne
strukturalnie do substratów, jest to inhibicja zwrotna. Inhibitor (efektor, modulator, regulator)
łączy się z enzymem w miejscu innym niż centrum (miejsce aktywne). To połączenie
indukuje zmiany konformacji enzymu (w trzecio- lub czwartorzędowej jego strukturze) co
zniekształca miejsce wiązania substratu, a zatem uniemożliwia jego wiązanie.
Heksokinaza katalizuje powstawanie glukozo-6-fosforanu z glukozy i ATP. Hamowanie
tej reakcji przez fruktozę lub mannozę jest przykładem inhibicji kompetycyjnej przez
substraty alternatywne. Glukoza, fruktoza i mannoza są wszystkie substratami heksokinazy i
mogą przyłączać się do tego samego centrum aktywnego i być przemieniane w produkt
(heksozo-6-fosforan). W rezultacie fosforylacja każdej z tych heksoz jest hamowana przez
każdą z pozostałych dwóch.
Równanie na szybkość reakcji w obecności inhibitora kompetycyjnego na podstawie
założenia szybkiej równowagi ma postać przedstawioną poniżej:
Taką samą postać równania otrzymamy na podstawie założenia stanu stacjonarnego, tylko że
Km zastąpi Ks.
Równanie na szybkości reakcji w obecności inhibitora kompetycyjnego w formie
odwrotnościowej (wykres Lineweavera-Burka) wygląda następująco (Km w miejscu Ks):
1
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
Z postaci równania widać, że nachylenie wykresu zwiększa się o współczynnik [1+([I]/ Ki)],
który powiększa wartość Km, ale przecięcie na osi 1/v pozostaje 1/Vmax.
Segal IH (1976)
Ta prawidłowość jest widoczna na powyższym wykresie. Każdemu stężeniu inhibitora
odpowiada inna prosta. W miarę jak rośnie stężenie inhibitora, przecięcie z osią 1/[S]
przesuwa się w stronę początku układu współrzędnych co znaczy, że Km app stale wzrasta.
Stałą inhibicji Ki można obliczyć albo z nachylenia wykresu albo z przecięcia z osią 1/[S].
Gdy 1/v = 0, to przecięcie z osią 1/[S] wynosi –1/Km app, gdzie Km app = Km (1+ [I]/Ki).
Nachylenie wykresu w obecności inhibitora kompetycyjnego wynosi: nachylenie 1/S = Km/Vmax
[1+ ([I]/Ki)].
Inhibicja niekompetycyjna
Spośród przykładów tego typu inhibitorów warto zwrócić uwagę na kwas
acetylosalicylowy (aspiryna). Kwas acetylosalicylowy hamuje niekompetycyjnie
dehydrogenazę 2-oksoglutaranową (kompleks enzymatyczny działający w cyklu Krebsa),
natomiast kwas salicylowy hamuje ten enzym kompetycyjnie. Wpływ obydwu tych związków
badano na oddychanie mitochondriów serca, poszukując przyczyn ochronnego działania
aspiryny na układ sercowo-naczyniowy. Innym przykładem inhibicji niekompetycyjnej jest
hamowanie aktywności niektórych izoform cyklazy adenylowej (AC5 i AC6) przez jony
wapnia w stężeniach mniejszych od 1 µM. Substratem cyklazy adenylowej jest ATP, a
produktem obok pirofosforanu jest cykliczny AMP, wtórny przekaźnik sygnałów w
komórkach. Wspomniane izoformy występują w sercu i naczyniach krwionośnych i uważa się
je za regulatory rytmu serca.
Klasyczny inhibitor niekompetycyjny nie ma wpływu na wiązanie substratu, zaś wiązanie
substratu nie ma wpływu na wiązanie inhibitora. Substrat i inhibitor wiążą się odwracalnie,
losowo i niezależnie, w różnych miejscach. Powstały kompleks jest katalitycznie nieaktywny.
2
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
Klasyczną inhibicję niekompetycyjną można opisać tylko w warunkach szybkiej równowagi.
Wówczas Km = KS.
jest pozorną Vmax przy danym [I].
Ze wzoru widać, że skutkiem działania inhibitora niekompetycyjnego jest obniżenie Vmax. W
warunkach kinetyki stanu stacjonarnego gdy Km ≠ KS, równanie na szybkość maksymalną
reakcji zawierałoby składniki występujące w potęgach. konsekwencji czego wykres
odwrotnościowy (stosowany do wyznaczenia typu inhibicji) byłby nieliniowy.
Równanie odwrotnościowe przedstawia się następująco:
Z postaci równania widać, że zarówno nachylenie jak i przecięcie z osią 1/v na wykresie
odwrotnościowym są zwiększone o współczynnik (1+[I]/ Ki) w porównaniu do wykresu
„kontrolnego”. Jeśli nachylenie jak i przecięcie z osią 1/v zwiększają się o ten sam
współczynnik to przecięcie z osią 1/[S] pozostanie niezmienione, równe –1/Km.
Segal IH (1976)
Dla każdego stężenia inhibitora można wykreślić nową prostą. W miarę jak rośnie [I]
zwiększa się nachylenie kolejnych prostych, a także punkt przecięcia z osią 1/v. Zatem, wraz
3
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
ze wzrostem stężenia inhibitora Vmax i stale obniża się. Ki można obliczyć z nachylenia albo z
przecięcia z osią 1/v.
Inhibicja akompetycyjna
Jako przykład inhibitora akompetycyjnego można wymienić lit, który jest stosowany w
leczeniu depresji maniakalnej. Lit hamuje monofosfatazę inozytolową, która katalizuje
hydrolizę fosforanu inozytolu. Hamowanie rozkładu monofosforanu inozytolu powoduje
wzrost jego stężenia w komórce kosztem wolnego inozytolu, potrzebnego do resyntezy
fosfatydyloinozytolu, pierwszego związku kaskady fosfoinozytolowej. Uważa się, że
nadmierna aktywność kaskady fosfoinozytolowej jest istotną przyczyną depresji maniakalnej.
Inny inhibitor akompetycyjny, kwas mykofenolowy hamuje reakcję katalizowaną przez
dehydrogenazę inozynomonofosforanu, co powoduje zmniejszenie puli nukleotydów
guaninowych i niewielkie podniesienie poziomu nukleotydów adeninowych. W rezultacie
takiej nierównowagi w dostarczaniu składników do syntezy kwasów nukleinowych, cykl
komórkowy zostaje zahamowany. Kwas mykofenolowy jest lekiem cytostatycznym i
immunosupresyjnym.
Kwas mykofenolowy
Klasyczny inhibitor akompetycyjny to taki, który wiąże się odwracalnie do kompleksu
enzym-substrat tworząc nieaktywny kompleks ESI. Inhibitor nie wiąże się do wolnego
enzymu. Ten sposób inhibicji jest rzadko spotykany w reakcjach jednosubstratowych. Warto
o nim wspomnieć, bo jest prostym przykładem sekwencyjnego dodawania dwóch ligandów w
ustalonym porządku. Akompetycyjna inhibicja jest powszechna w reakcjach
wielosubstratowych z powodu wspomnianego wyżej.
Zarówno kinetyka szybkiej równowagi jak i stanu stacjonarnego dają takie samo równanie
szybkości reakcji, więc KS może być zastąpione przez Km.
Równanie szybkości reakcji w obecności inhibitora kompetycyjnego wygląda następująco:
4
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
Innymi słowy inhibitor akompetycyjny obniża Vmax i Km o ten sam współczynnik. Równanie
odwrotnościowe szybkości reakcji hamowanej inhibitorem akompetycyjnym wygląda tak jak
poniżej:
Nachylenie wykresu wynosi Km/ Vmax, ale punkt przecięcia z osią 1/v jest podniesiony o
współczynnik (1+[I]/ Ki). W rezultacie krzywe „plus inhibitor” i „kontrolna” są równoległe.
W miarę jak rośnie [I], przecięcie z osią 1/v podnosi się dając serię równoległych prostych.
Segal IH (1976)
Inhibicja mieszana
Jest formą inhibicji niekompetycyjnej. Taką inhibicję obserwuje się w przypadku
hamowania przez jony kadmu arginazy z nerek i wątroby szczura (inhibicja mieszana
niekompetycyjna), czy hamowania syntazy tymidylanowej przez analogi
metylenotetrahydrofolianu. Proste na wykresie odwrotnościowym przecinają się po lewej
stronie osi 1/v, a nie jak w przypadku inhibicji niekompetycyjnej na osi 1/v.
Odczynniki i materiały
0,04 M bufor octanowy pH 4,7
0,2 M (200 mM) roztwór sacharozy w 0,04 M buforze octanowym pH 4,7
0,1 M (100mM) roztwór CuSO4
1,0 % kwas 3,5-dinitrosalicylowy
Odpowiednio rozcieńczona inwertaza o aktywności dającej w reakcji z kwasem 3,5dinitrosalicylowym po 10 min inkubacji z 50 mM sacharozą absorbancję 0,4 – 0,6.
5
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
Wykonanie ćwiczenia
W celu zbadania z jakim typem inhibicji enzymatycznej mamy do czynienia, gdy jony Cu2+
hamują aktywność inwertazy, należy sporządzić wykres odwrotności szybkości reakcji (1/v)
od odwrotności stężenia substratu (1/s) przy braku inhibitora i przy rosnących stężeniach
inhibitora. W rezultacie na wykresie będziemy mieć 4 proste.
Żeby przygotować dane do wykresu należy przeprowadzić doświadczenie, w którym
szybkość reakcji hydrolizy sacharozy będzie mierzona w warunkach kontrolnych i w
obecności kilku stężeń inhibitora. Ilość zhydrolizowanej sacharozy będziemy oznaczać przy
użyciu kwasu 3,5-dinitrosalicylowego, który nie reaguje z jonami miedzi.
Do 20 probówek ponumerowanych A1, A2, A3, A4; B1, B2, B3, B4; C1, C2, C3, C4;
D1, D2, D3, D4; A0, B0, C0, D0, odmierzyć składniki mieszaniny reakcyjnej według podanego
schematu:
probówki
A1
A2
A3
A4
stężenie
sacharozy
8,0 mM
↓
↓
↓
200 mM
sacharoza (ml)
0,080 ml
↓
↓
↓
bufor octanowy
pH 4,7 (ml)
0,920 ml
0,890 ml
0,860 ml
0,830 ml
stężenie
CuSO4 (mM)
—
1,5 mM
3,0 mM
4,5 mM
B1
B2
B3
B4
12,5 mM
↓
↓
↓
0,125 ml
↓
↓
↓
0,875 ml
0,845 ml
0,815 ml
0,785 ml
—
1,5 mM
3,0 mM
4,5 mM
C1
C2
C3
C4
25,0 mM
↓
↓
↓
0,250 ml
↓
↓
↓
0,750 ml
0,720 ml
0,690 ml
0,660 ml
—
1,5 mM
3,0 mM
4,5 mM
D1
D2
D3
D4
50,0 mM
↓
↓
↓
0,500 ml
↓
↓
↓
0,500 ml
0,470 ml
0,440 ml
0,410 ml
—
1,5 mM
3,0 mM
4,5 mM
A0
B0
C0
D0
8,0 mM
12,5 mM
25,0 mM
50,0 mM
0,080 ml
0,125 ml
0,250 ml
0,500 ml
0,920 ml
0,875 ml
0,750 ml
0,500 ml
—
—
—
—
100 mM
CuSO4 (μl)
—
30 μl
60 μl
90 μl
—
30 μl
60 μl
90 μl
—
30 μl
60 μl
90 μl
—
30 μl
60 μl
90 μl
—
—
—
—
Po odmierzeniu, wszystkie składniki mieszaniny reakcyjnej należy wymieszać i wstawić
probówki na 5 min do łaźni wodnej (30˚C) w celu wyrównania temperatury. Po tym czasie
kolejno w odstępach 20 lub 30 sekundowych, do każdej probówki z wyjątkiem probówek
kontrolnych (A0, B0, C0, D0), dodać po 1 ml odpowiednio rozcieńczonego roztworu
inwertazy i dalej inkubować. Po 10 minutach od dodania enzymu do pierwszej probówki,
rozpocząć przerywanie reakcji dodając kolejno po 2 ml kwasu 3,5-dwunitrosalicylowego w
6
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
odstępach czasowych takich samych jak przy rozpoczęciu reakcji. Do probówek kontrolnych
(A0, B0, C0, D0) po 10 minutowej inkubacji również dodać kwas 3,5-dwunitrosalicylowy, a
dopiero potem po 1 ml roztworu enzymu. Wszystkie probówki umieścić we wrzącej łaźni
wodnej i ogrzewać przez 10 min. Wyjąć probówki, ochłodzić, a następnie do każdej dodać 20
ml wody destylowanej i wymieszać. Mierzyć absorbancję prób przy λ = 540 nm zerując
aparat na próbę kontrolną A0 dla szeregu A1, A2, A3, A4, B0 dla szeregu B itd.
Opracowanie wyników
Odczytać z krzywej wzorcowej liczbę μg cukrów redukujących powstałych w każdej
probówce w wyniku hydrolizy sacharozy przez inwertazę. Obliczyć jakiej ilości μmoli
sacharozy odpowiadają te wartości. Wyrazić szybkość początkową (v0) reakcji hydrolizy
sacharozy w μmolach sacharozy/min. Wyniki pomiaru absorbancji i znalezione wartości
wpisać do poniższej tabeli:
absorbancja
prób
A1
B1
C1
D1
stężenie
substratu (S)
8,0 mM
12,5 mM
25,0 mM
50,0 mM
odwrotność μg cukrów
(v0) μmole
odwrotność
stężenia - 1/S redukujących sacharozy/min szybkości - 1/v0
0,125
0,080
0,040
0,020
A2
B2
C2
D2
8,0 mM
12,5 mM
25,0 mM
50,0 mM
0,125
0,080
0,040
0,020
A3
B3
C3
D3
8,0 mM
12,5 mM
25,0 mM
50,0 mM
0,125
0,080
0,040
0,020
A4
B4
C4
D4
8,0 mM
12,5 mM
25,0 mM
50,0 mM
0,125
0,080
0,040
0,020
Na podstawie tabeli przygotować wykres przedstawiający zależność odwrotności szybkości
reakcji (1/v0) katalizowanej przez inwertazę (bez inhibitora i przy różnych jego stężeniach) od
odwrotności stężenia substratu 1/S. Na podstawie przebiegu prostych określić rodzaj inhibicji,
jaki powodują jony Cu2+ gdy oddziałują z inwertazą. W celu wyznaczenia wartości Ki dla
hamowania aktywności enzymu przez Cu2+ przygotować wykres zależności 1/v0 od stężenia
inhibitora. Przecięcie otrzymanej prostej z osią X daje wartość -Ki.
Literatura
Cieśla J, Gołos B, Dzik JM, Pawełczak K, Kempny M, Makowski M, Bretner M,
Kulikowski T, Machnicka B, Rzeszotarska B, Rode W (1995) Thymidylate synthases from
Hymenolepis diminuta and regenerating rat liver: purification, properties, and inhibition by
substrate and cofactor analogues. Biochim Biophys Acta 1249: 127-136.
7
Przedruk materiałów dydaktycznych w całości lub w części możliwy w celu przygotowania do ćwiczeń z biochemii realizowanych w Katedrze Biochemii, WRiB SGGW w Warszawie.
Inne wykorzystanie tych materiałów bez zgody pracowników Katedry Biochemii jest zabronione.
Fauroux CM, Freeman S (1999) Inhibitors of inositol monophosphatase. J Enzyme Inhib 14:
97-108.
Halloran PF (1996) Molecular mechanisms of new immunosuppressants. Clin Transplant
10:118-123.
Mou TC, Masada N, Cooper DM, Sprang SR (2009) Structural basis for inhibition of
mammalian adenylyl cyclase by calcium. Biochemistry 48: 3387-3397.
Nulton-Persson AC, Szweda LI, Sadek HA (2004) Inhibition of cardiac mitochondrial
respiration by salicylic acid and acetylsalicylate. J Cardiovasc Pharmacol 44: 591-595.
Segal IH (1976) Biochemical Calculations str 246-272. John Wiley & Sons
Tormanen CD (2006) Inhibition of rat liver and kidney arginase by cadmium ion. J Enzyme
Inhib Med Chem 21: 119-123.
8