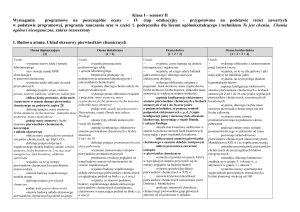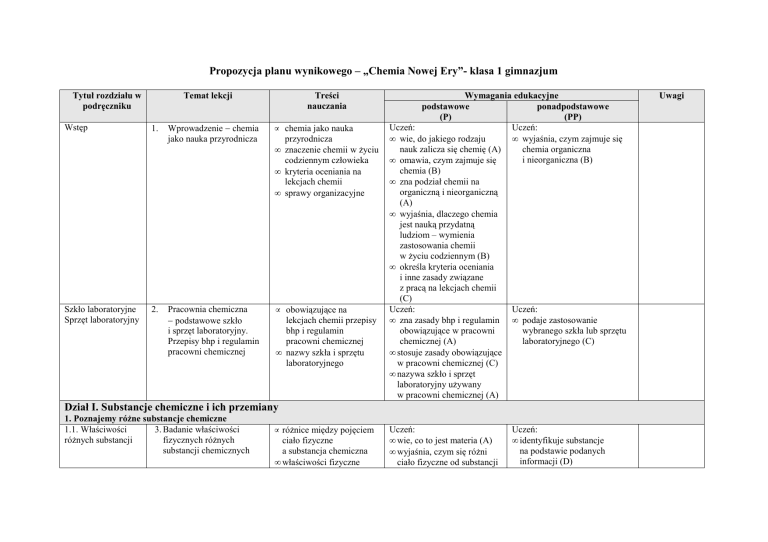
Propozycja planu wynikowego – „Chemia Nowej Ery”- klasa 1 gimnazjum
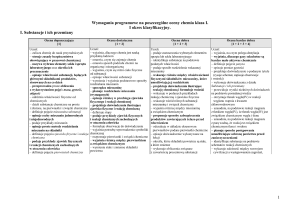
Tytuł rozdziału w
podręczniku
Temat lekcji
Treści
nauczania
Wstęp
1.
Wprowadzenie − chemia
jako nauka przyrodnicza
• chemia jako nauka
przyrodnicza
• znaczenie chemii w życiu
codziennym człowieka
• kryteria oceniania na
lekcjach chemii
• sprawy organizacyjne
Szkło laboratoryjne
Sprzęt laboratoryjny
2.
Pracownia chemiczna
− podstawowe szkło
i sprzęt laboratoryjny.
Przepisy bhp i regulamin
pracowni chemicznej
• obowiązujące na
lekcjach chemii przepisy
bhp i regulamin
pracowni chemicznej
• nazwy szkła i sprzętu
laboratoryjnego
Wymagania edukacyjne
podstawowe
ponadpodstawowe
(P)
(PP)
Uczeń:
Uczeń:
• wie, do jakiego rodzaju
• wyjaśnia, czym zajmuje się
nauk zalicza się chemię (A)
chemia organiczna
i nieorganiczna (B)
• omawia, czym zajmuje się
chemia (B)
• zna podział chemii na
organiczną i nieorganiczną
(A)
• wyjaśnia, dlaczego chemia
jest nauką przydatną
ludziom – wymienia
zastosowania chemii
w życiu codziennym (B)
• określa kryteria oceniania
i inne zasady związane
z pracą na lekcjach chemii
(C)
Uczeń:
Uczeń:
• zna zasady bhp i regulamin • podaje zastosowanie
wybranego szkła lub sprzętu
obowiązujące w pracowni
chemicznej (A)
laboratoryjnego (C)
• stosuje zasady obowiązujące
w pracowni chemicznej (C)
• nazywa szkło i sprzęt
laboratoryjny używany
w pracowni chemicznej (A)
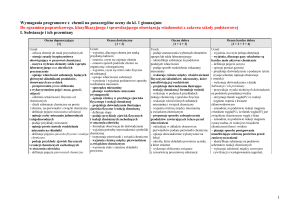
Dział I. Substancje chemiczne i ich przemiany
1. Poznajemy różne substancje chemiczne
1.1. Właściwości
3. Badanie właściwości
różnych substancji
fizycznych różnych
substancji chemicznych
• różnice między pojęciem
ciało fizyczne
a substancja chemiczna
• właściwości fizyczne
Uczeń:
• wie, co to jest materia (A)
• wyjaśnia, czym się różni
ciało fizyczne od substancji
Uczeń:
• identyfikuje substancje
na podstawie podanych
informacji (D)
Uwagi
wybranych substancji
1.2. Mieszaniny
substancji
4. Mieszaniny substancji
• mieszaniny substancji:
− jednorodna
− niejednorodna
• sposoby rozdzielania
mieszanin
• podział substancji
chemicznych
1.3. Zjawisko
fizyczne a reakcja
chemiczna
5.
• zjawisko fizyczne
• reakcja chemiczna
Zjawisko fizyczne
a reakcja chemiczna
chemicznej (B)
• wie, że substancje
charakteryzują się
określonymi
właściwościami (A)
• określa właściwości
substancji (C)
• dzieli substancje na
pierwiastki i związki
chemiczne (A)
Uczeń:
• definiuje mieszaninę (A)
• wyjaśnia różnice między
mieszaniną jednorodną
a niejednorodną (B)
• podaje przykłady mieszanin
(C)
• wymienia metody
rozdzielania mieszanin (A)
• wyjaśnia, na czym polegają
podstawowe sposoby
rozdzielania mieszanin (B)
• przygotowuje mieszaninę
(C)
• dokonuje rozdzielenia
prostych mieszanin na
składniki (sól kuchenna
+ woda, piasek + woda) (C)
Uczeń:
• definiuje zjawisko fizyczne
i reakcję chemiczną (A)
• wymienia różnice między
zjawiskiem fizycznym
a reakcją chemiczną (C)
• podaje przykłady zjawisk
fizycznych i reakcji
chemicznych (A)
• formułuje obserwacje do
Uczeń:
• wyjaśnia, na czym polega
destylacja (C)
• proponuje różne sposoby
rozdzielenia podanej
mieszaniny (C)
Uczeń:
• przeprowadza doświadczenia
pokazujące reakcję chemiczną
i zjawisko fizyczne (C )
• analizuje podane przykłady
pod względem reakcji
chemicznej i zjawiska
fizycznego (D)
• opisuje doświadczenia,
wykonuje doświadczenia (C
doświadczeń i wykonuje
proste doświadczenia (C)
− dotyczy całości
1.4. Pierwiastek
chemiczny
a związek
chemiczny
6.
Poznajemy język
chemiczny
• podział substancji
chemicznych
− przypomnienie
• pierwiastki chemiczne
− metale i niemetale
• symbole pierwiastków
chemicznych
• związek chemiczny
• podstawowe różnice
między mieszaniną
a związkiem chemicznym
1.5. Powietrze
7.
Czym jest powietrze?
• co to jest powietrze
• podstawowy skład
powietrza
• właściwości fizyczne
powietrza
• zastosowanie i rola
powietrza
Uczeń:
• definiuje pierwiastek
i związek chemiczny (A)
• zna podział pierwiastków
chemicznych (A)
• podaje przykłady
pierwiastków chemicznych
należących do metali
i niemetali (C)
• podaje przykłady związków
chemicznych (C)
• zna symbole chemiczne
najważniejszych
pierwiastków chemicznych
(A)
• wyjaśnia potrzebę
wprowadzenia symboliki
chemicznej (B)
• rozpoznaje pierwiastki,
związki chemiczne (C)
Uczeń:
• wie, że powietrze jest
mieszaniną jednorodną (A)
• wymienia główne składniki
powietrza (A)
• bada skład powietrza (C)
lub D), formułuje wnioski,
przewiduje wyniki
niektórych doświadczeń na
podstawie swojej wiedzy (D),
projektuje doświadczenia
(D) − dotyczy całości
Uczeń:
• wskazuje wśród różnych
substancji mieszaninę
i związek chemiczny (D)
• wyjaśnia różnicę między
mieszaniną a związkiem
chemicznym (C)
• odszukuje w układzie
okresowym podane pierwiastki
chemiczne (C)
Uczeń:
• zapisuje obserwacje
i formułuje wnioski
z doświadczenia – badanie
składu powietrza (C)
1.6. Tlen i jego
właściwości
8.
Otrzymywanie tlenu
i badanie jego
właściwości fizycznych
• tlen – najważniejszy
składnik powietrza
(historia odkrycia,
otrzymywanie,
właściwości fizyczne)
• substraty i produkty
reakcji chemicznej
• reagenty
• reakcja rozkładu (analizy)
9.
Badanie właściwości
chemicznych tlenu
• właściwości chemiczne
tlenu
• reakcja syntezy (łączenia)
• utlenianie i spalanie
• tlenki
• obieg tlenu w przyrodzie
• rola tlenu w życiu
człowieka i innych
organizmów
Uczeń:
• wie, co to jest tlen (A)
• opisuje sposoby
otrzymywania tlenu (C)
• określa właściwości
fizyczne tlenu (C)
• wyjaśnia pojęcia: substrat,
produkt, reagent (B)
• definiuje reakcję analizy (A)
• zapisuje słownie przebieg
reakcji analizy (C)
• określa substraty, produkty,
reagenty, pierwiastki
i związki chemiczne
w reakcji chemicznej (C)
Uczeń:
• określa właściwości
chemiczne tlenu (C)
• definiuje reakcję syntezy,
utlenianie i spalanie (A)
• odróżnia utlenianie od
spalania (B)
• zapisuje słownie przebieg
reakcji syntezy (C)
• określa substraty, produkty,
reagenty, pierwiastki,
związki chemiczne w
reakcji chemicznej (C)
• definiuje tlenki (A)
• dokonuje podziału tlenków
(A)
• wie, na czym polega obieg
tlenu w przyrodzie (B)
• wyjaśnia znaczenie tlenu dla
człowieka (B)
Uczeń:
• opisuje sposoby otrzymywania
tlenu (C)
• zapisuje słownie przebieg
reakcji analizy (C)
• wyróżnia reakcje analizy
wśród innych reakcji
chemicznych (D)
Uczeń:
• określa rolę tlenu w życiu
człowieka i innych
organizmów (C)
• zapisuje słownie przebieg
reakcji syntezy (C)
• wyróżnia reakcje syntezy
wśród innych reakcji
chemicznych (D)
1.9. Tlenek
węgla(IV)
− właściwości i rola
w przyrodzie
1.11.
Zanieczyszczenia
powietrza
1.10. Rola pary
wodnej w powietrzu
10. Tlenek węgla(IV) jako
składnik powietrza
• występowanie i obieg
tlenku węgla(IV)
w przyrodzie
• rola tlenku węgla(IV)
w przyrodzie
(fotosynteza), efekt
cieplarniany
11. Otrzymywanie tlenku
węgla(IV) i badanie jego
właściwości
• otrzymywanie tlenku
węgla(IV)
• badanie właściwości
tlenku węgla(IV)
• wykrywanie obecności
tlenku węgla(IV)
• reakcja wymiany
• reakcja charakterystyczna
12. Woda – jej właściwości
i rola w przyrodzie
• dowody obecności pary
wodnej w powietrzu
• higroskopijność
Uczeń:
• wie, co to jest tlenek
węgla(IV) (A)
• omawia obieg tlenku
węgla(IV) w przyrodzie (B)
• rozumie, na czym polega
proces fotosyntezy (B)
• wie, na czym polega efekt
cieplarniany (B)
Uczeń:
• określa właściwości
fizyczne i chemiczne tlenku
węgla(IV) (C)
• definiuje reakcję wymiany
(A)
• podaje sposób
otrzymywania tlenku
węgla(IV), np. reakcja
węgla z tlenem (B)
• wie, co to jest reakcja
charakterystyczna (A)
• określa sposób wykrywania
tlenku węgla(IV) (B)
• zapisuje słownie przebieg
prostych reakcji wymiany
(C)
• określa substraty, produkty,
reagenty, pierwiastki
i związki chemiczne
w reakcji chemicznej (C)
Uczeń:
• wie, co to jest woda (A)
• wymienia właściwości
wody (B)
• wyjaśnia znaczenie wody
w przyrodzie, pary wodnej
w atmosferze (B)
Uczeń:
• wyjaśnia rolę procesu
fotosyntezy w życiu człowieka
(C)
• omawia efekt cieplarniany i
zagrożenia z nim związane (C)
Uczeń:
• podaje sposób otrzymywania
tlenku węgla(IV) z węglanów
(C)
• otrzymuje tlenek węgla(IV)
w reakcji węglanu wapnia
z kwasem solnym (C)
• uzasadnia na podstawie reakcji
magnezu z tlenkiem
węgla(IV), że tlenek
węgla(IV) jest związkiem
chemicznym węgla i tlenu (D)
• sprawnie posługuje się
pojęciem reakcji wymiany (C)
• wyróżnia reakcje wymiany
wśród innych reakcji
chemicznych (D)
Uczeń:
• potrafi wykazać obecność pary
wodnej w powietrzu (D)
• wymienia przykłady
wykorzystania
higroskopijności substancji (C)
1.5. Powietrze
1.7. Azot – główny
składnik powietrza
1.8. Gazy szlachetne
13. Stałe i zmienne składniki
powietrza
• stałe i zmienne składniki
powietrza
• azot − główny składnik
powietrza
• obieg azotu w przyrodzie
• zastosowania azotu
• gazy szlachetne
• występowanie
i zastosowania gazów
szlachetnych
1.11.
Zanieczyszczenia
powietrza
14. Zagrożenia cywilizacyjne
• najważniejsze zagrożenia
cywilizacyjne:
− dziura ozonowa,
− kwaśne opady,
− efekt cieplarniany,
− zanieczyszczenia
powietrza i wody
• sposoby usuwania,
ograniczania zagrożeń
cywilizacyjnych
• określa zachowanie się
substancji higroskopijnych
(C)
• wyjaśnia pojęcie
higroskopijności (B)
Uczeń:
• wie, co to są stałe i zmienne
składniki powietrza (B)
• wymienia stałe i zmienne
składniki powietrza (A)
• wymienia ważniejsze
właściwości i zastosowania
azotu (A)
• wie, co to są gazy
szlachetne (A)
• wymienia ważniejsze
właściwości i zastosowania
gazów szlachetnych (A)
• oblicza przybliżoną objętość
tlenu i azotu, np.
w pracowni chemicznej (C)
Uczeń:
• wymienia najważniejsze
zagrożenia cywilizacyjne
(A)
• wie, co to jest dziura
ozonowa, kwaśne opady,
efekt cieplarniany (B)
• wymienia źródła
zanieczyszczeń wód,
powietrza (B)
Uczeń:
• określa, które składniki
powietrza są stałe, a które
zmienne (C)
• opisuje obieg azotu
w przyrodzie (B)
• wykonuje obliczenia
dotyczące składu powietrza
(C)
Uczeń:
• wyjaśnia, skąd się biorą
kwaśne opady (B)
• określa, jakie zagrożenia
wynikają z powstania efektu
cieplarnianego, dziury
ozonowej, kwaśnych opadów
(C)
• wykazuje zależność między
rozwojem cywilizacji
a występowaniem zagrożeń
(D)
• proponuje sposoby
ograniczania zanieczyszczeń
wody i powietrza (D)
1.12. Wodór i jego
właściwości
15. Otrzymywanie wodoru
i badanie jego
właściwości
2. Poznajemy reakcje chemiczne i ich rodzaje
2.1. Reakcje
16. Reakcje utleniania
utleniania i redukcji
i redukcji
– szczególny rodzaj
reakcji wymiany
2.2. Energia
w reakcjach
chemicznych
17. Podsumowanie
wiadomości. Poznane
rodzaje reakcji
chemicznych
• otrzymywanie wodoru
• właściwości fizyczne
i chemiczne wodoru
• wykrywanie obecności
wodoru
Uczeń:
• wie, co to jest wodór (A)
• wie, jak otrzymać wodór
(B)
• określa właściwości
fizyczne i chemiczne
wodoru (C)
• identyfikuje wodór (C)
• wskazuje substraty,
produkty reakcji,
pierwiastki i związki
chemiczne w reakcji
chemicznej (C)
Uczeń:
• otrzymuje wodór (C)
• dowodzi (na podstawie reakcji
magnezu z parą wodną), że
woda jest związkiem
chemicznym wodoru i tlenu
(D)
• zapisuje słownie przebieg
reakcji związanych z wodorem
(C)
• reakcja utleniania
i reakcja redukcji
• utleniacz i reduktor
Uczeń:
• definiuje reakcje utleniania
i redukcji (A)
• definiuje utleniacz
i reduktor (A)
• wskazuje reakcje utleniania,
redukcji, utleniacz
i reduktor w zapisach
słownych przebiegu
prostych reakcji
chemicznych (C)
• zapisuje słownie przebieg
reakcji chemicznej (proste
przykłady) (C)
• podsumowanie
wiadomości dotyczących
działu
• typy reakcji chemicznych
• przykłady poszczególnych
typów reakcji
chemicznych
Uczeń:
• definiuje podstawowe typy
reakcji chemicznych (A)
• wie, co to jest spalanie,
utlenianie, redukcja (A)
• wymienia ważniejsze efekty
towarzyszące reakcjom
Uczeń:
• opisuje doświadczenie
przeprowadzone na lekcji
− schemat, obserwacje,
wnioski, zapis słowny
przebiegu reakcji chemicznej
(C)
• projektuje doświadczenie
z węglem jako reduktorem (D)
• zapisuje słownie przebieg
reakcji utleniania i redukcji
(C)
• wskazuje reakcję utleniania,
redukcji, utleniacz, reduktor
w zapisie słownym przebiegu
reakcji chemicznej(C)
• uzasadnia typ reakcji (D)
Uczeń:
• wyjaśnia pojęcia reakcji egzoi endotermicznej, wymienia
przykłady (C)
• określa typ podanej reakcji
chemicznej, uzasadnia swój
wybór (D)
Podsumowanie
działu
• energia w reakcjach
chemicznych − reakcje
endo- i egzoenergetyczne
chemicznym (A)
• wie, co to są reakcje endoi egzoenergetyczne (A)
• rozpoznaje typy reakcji
chemicznych na podstawie
zapisu słownego ich
przebiegu (C)
• zapisuje słownie przebieg
reakcji chemicznych różnego
typu (C)
• wewnętrzna budowa
materii
• założenia teorii
atomistyczno-cząsteczkowej
• dowody istnienia atomów
i cząsteczek
Uczeń:
• definiuje materię (A)
• wie, że materia ma budowę
ziarnistą (B)
• odróżnia atom od cząsteczki
(B)
• podaje przykłady poglądów
na temat budowy materii
(A)
• wymienia najważniejsze
założenia teorii
atomistyczno-cząsteczkowej
(A)
• wie, co to jest dyfuzja (A)
Uczeń:
• zna skalę wielkości atomów
i ich mas (A)
• definiuje jednostkę masy
atomowej, masę atomową
i cząsteczkową (A)
• wie, gdzie jest podawana
masa atomowa pierwiastka
chemicznego (A)
• potrafi odczytać masę
atomową pierwiastka (C)
• oblicza masę cząsteczkową
Uczeń:
• projektuje doświadczenie
potwierdzające ziarnistą
budowę materii (C)
• podaje obserwacje i formułuje
wnioski do doświadczeń (C)
18.−19. Sprawdzian
wiadomości. Omówienie
sprawdzianu
Dział II. Atom i cząsteczka
3. Poznajemy budowę atomu
3.1. Wewnętrzna
20. Poznajemy świat atomów
budowa materii
i cząsteczek
3.2. Historyczny
rozwój pojęcia
atomu
3.3. Masa i rozmiary
atomów
21. Masa i rozmiary atomów
•
•
•
•
rozmiary atomów
masy atomów
jednostka masy atomowej
masa atomowa i masa
cząsteczkowa
• pierwiastek chemiczny
jako zbiór atomów tego
samego rodzaju
Uczeń:
• wyjaśnia powody
wprowadzenia jednostki masy
atomowej (D)
• odczytuje masy atomowe
z układu okresowego
pierwiastków chemicznych (C)
• oblicza masę cząsteczkową (C)
• przelicza jednostkę masy
atomowej na gramy (D)
3.2. Historyczny
rozwój pojęcia
atomu
3.5. Budowa atomu
22. Rozwój poglądów na
budowę materii
3.5. Budowa atomu
23. Budowa atomu – jądro
i elektrony
• historyczny rozwój
poglądów na budowę
materii:
− poglądy Demokryta,
− teoria Daltona,
− model atomu
Thomsona,
− modele atomu
Rutherforda i Bohra
• współczesny model atomu
• jądro atomu – protony
i neutrony
• elektrony
• liczba atomowa (Z)
• liczba masowa (A)
• model atomu
(proste przykłady) (C)
• definiuje pierwiastek
chemiczny (A)
Uczeń:
• wymienia modele budowy
atomu (A)
• wymienia najważniejsze
cechy modeli atomu (B)
• omawia pojęcia − elektrony,
jądro atomowe (B)
Uczeń:
• wymienia i charakteryzuje
podstawowe cząstki
elementarne (C)
• opisuje budowę atomu
pierwiastka chemicznego
(B)
• wyjaśnia pojęcie powłoki
elektronowej (B)
• wie, co to są elektrony
walencyjne i w jakiej liczbie
mogą występować (A)
• wie, co określają liczba
atomowa i liczba masowa
(B)
• odczytuje z układu
okresowego liczbę atomową
podanego pierwiastka
chemicznego (C)
• podaje maksymalną liczbę
elektronów na 3 pierwszych
powłokach elektronowych
(A)
• oblicza liczby elektronów,
protonów i neutronów,
Uczeń:
• charakteryzuje poszczególne
modele atomu pierwiastka
chemicznego (B)
• wyjaśnia różnicę między
modelem atomu Thomsona,
Rutheforda, Bohra i obecnym
(C)
Uczeń:
• sprawnie odczytuje liczby
atomowe z układu okresowego
pierwiastków chemicznych (C)
• zna zasady obliczania
maksymalnej liczby
elektronów na powłokach
i stosuje je (C)
• oblicza liczby elektronów,
protonów, neutronów,
korzystając z liczb masowej
i atomowej (C)
• rysuje modele atomów
pierwiastków chemicznych (C)
• wskazuje rdzeń atomu
w modelu atomu (C)
3.6. Izotopy
24. Co to są izotopy?
• pojęcie izotopu
• izotopy wodoru
• występowanie izotopów
w przyrodzie
• rodzaje izotopów:
− trwałe
− nietrwałe
• zastosowania izotopów
25. Zjawisko
promieniotwórczości
• zjawisko
promieniotwórczości
• rodzaje promieniowania
naturalnego (α, β, γ) i jego
najważniejsze
właściwości
• pierwiastki
promieniotwórcze
• okres półtrwania (okres
połowicznego rozpadu)
• zagrożenia związane
ze zjawiskiem
promieniotwórczości
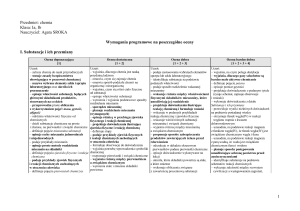
4. Poznajemy układ okresowy pierwiastków chemicznych
4.1. Układ okresowy 26. Układ okresowy
• próby klasyfikacji
pierwiastków
pierwiastków – historia
pierwiastków
znając liczby masową
i atomową (C)
• rysuje uproszczone modele
atomów pierwiastków
chemicznych (proste
przykłady) (C)
• definiuje izotopy (A)
• wyjaśnia podział izotopów
(B)
• wymienia ważniejsze
zastosowania izotopów (A)
• wymienia nazwy izotopów
wodoru oraz różnice między
nimi (A)
• oblicza liczby elektronów,
protonów i neutronów dla
izotopów (C)
Uczeń:
• opisuje zjawisko
promieniotwórczości (B)
• wie, czym się różni
promieniotwórczość
naturalna od sztucznej (B)
• wymienia rodzaje
promieniowania naturalnego
(A)
• definiuje okres półtrwania
(czas połowicznego
rozpadu) i pierwiastek
promieniotwórczy (A)
• wymienia najważniejsze
zagrożenia związane
z promieniotwórczością (C)
• zna zasługi Marii
Skłodowskiej-Curie (A)
Uczeń:
• wie, co to jest układ
• wyjaśnia, dlaczego często
masa atomowa nie jest liczbą
całkowitą (C)
• rozwiązuje zadania dotyczące
izotopów (C)
Uczeń:
• opisuje poznane rodzaje
promieniowania (B)
• wyjaśnia, co to jest reakcja
łańcuchowa (A)
• wyjaśnia pojęcie okresu
półtrwania (czasu
połowicznego rozpadu) (B)
• definiuje szereg
promieniotwórczy (A)
• podaje przykłady szeregów
promieniotwórczych (D)
• wymienia nazwiska uczonych
zasłużonych w badaniach nad
promieniotwórczością i ich
dokonania (A)
Uczeń:
• omawia próby klasyfikacji
chemicznych
powstania i budowa
chemicznych przez
Newlandsa i Döbereinera
• historia powstania układu
okresowego pierwiastków
Mendelejewa
• prawo okresowości
• budowa układu
okresowego pierwiastków
chemicznych
4.2. Zależność
między budową
atomu pierwiastka
a jego położeniem
w układzie
okresowym
4.3. Charakter
chemiczny
pierwiastków grup
głównych
27. Zależność między budową
atomu pierwiastka a jego
miejscem w układzie
okresowym pierwiastków
chemicznych
• położenie pierwiastka
chemicznego w układzie
okresowym – informacje
wynikające z:
− numeru grupy
− numeru okresu
− liczby atomowej
• charakter chemiczny
pierwiastków grup
głównych
okresowy pierwiastków
chemicznych (A)
• zna budowę układu
okresowego pierwiastków
chemicznych (B)
• wie, jakie informacje
o atomie pierwiastka
możemy uzyskać z układu
okresowego pierwiastków
chemicznych (B)
• podaje prawo okresowości
(A)
• wie, kto jest twórcą układu
okresowego pierwiastków
(A)
Uczeń:
• zna podstawowe zasady
korzystania z układu
okresowego pierwiastków
chemicznych (B)
• potrafi odnaleźć w układzie
okresowym symbole
chemiczne podstawowych
pierwiastków (C)
• potrafi korzystać z układu
okresowego pierwiastków
chemicznych (C)
• potrafi zastosować
informacje odczytane
z układu okresowego
pierwiastków chemicznych
(C)
• podaje maksymalną liczbę
elektronów na powłokach
(A)
• określa liczbę protonów,
elektronów, powłok
elektronowych, elektronów
pierwiastków chemicznych (B)
• wyjaśnia budowę układu
okresowego pierwiastków
chemicznych (B)
Uczeń:
• swobodnie korzysta
z informacji zawartych
w układzie okresowym
pierwiastków chemicznych (C)
• podaje rozmieszczenie
elektronów na powłokach
elektronowych (C)
• rysuje modele atomów
pierwiastków chemicznych (C)
walencyjnych, charakter
chemiczny pierwiastka
chemicznego, korzystając
z układu okresowego (C)
• rozpisuje rozmieszczenie
elektronów na powłokach
(proste przykłady) (C)
• rysuje modele atomów
pierwiastków chemicznych
(proste przykłady) (C)
5. Poznajemy sposoby łączenia się atomów w cząsteczki
5.1. Rodzaje wiązań 28. Wiązanie kowalencyjne
• mechanizm powstawania
chemicznych
(atomowe)
wiązania kowalencyjnego
niespolaryzowanego
• rola elektronów
walencyjnych w
tworzeniu wiązania
chemicznego
• oktet elektronowy
• powstawanie wspólnych
par elektronowych
• pojęcia:
− wzór sumaryczny
− wzór strukturalny
− wzór elektronowy
Uczeń:
• wie, co to jest wiązanie
chemiczne, jak powstają
cząsteczki (B)
• zna rolę elektronów
walencyjnych podczas
tworzenia się wiązań (B)
• podaje regułę oktetu
(dubletu) (A)
• definiuje wiązania
kowalencyjne
i kowalencyjne
niespolaryzowane (A)
• podaje, w jakich
cząsteczkach powstają
wiązania kowalencyjne
i kowalencyjne
niespolaryzowane (B)
• definiuje wzory
sumaryczny, elektronowy
i strukturalny (A)
• zapisuje wzory cząsteczek
pierwiastków chemicznych
i różne ich liczby (C)
Uczeń:
• wyjaśnia regułę oktetu
(dubletu) (B)
• wyjaśnia mechanizm
tworzenia się wiązania
kowalencyjnego
niespolaryzowanego
na przykładach (C)
29. Wiązania kowalencyjne
spolaryzowane
i niespolaryzowane
• mechanizm powstawania
wiązania kowalencyjnego
spolaryzowanego
30. Wiązanie jonowe
• jony – kationy, aniony
• mechanizm powstawania
jonów
• mechanizm powstawania
wiązania jonowego
31. Rodzaje wiązań
chemicznych − ćwiczenia
• rodzaje wiązań
chemicznych
Uczeń:
• definiuje wiązanie
kowalencyjne
spolaryzowane (A)
• określa wpływ obecności
tego wiązania na
właściwości niektórych
cząsteczek (C)
• podaje przykłady cząsteczek
o wiązaniu kowalencyjnym
spolaryzowanym (C)
• zapisuje wzory cząsteczek
związków chemicznych
i różne ich liczby (C)
Uczeń:
• definiuje jony,
kationy, aniony (A)
• wyjaśnia sposób
powstawania jonów
kationów, anionów (B)
• definiuje wiązanie jonowe
(A)
• podaje przykłady cząsteczek
z wiązaniem jonowym (C)
Uczeń:
• określa rodzaje wiązań
w cząsteczkach (proste
przykłady) (C)
• odróżnia wzory sumaryczne
od wzorów strukturalnych
(B)
• zapisuje wzory sumaryczne
i strukturalne (proste
przykłady) (C)
Uczeń:
• opisuje na przykładzie
mechanizm tworzenia się
wiązania spolaryzowanego (C)
• wyjaśnia różnice między
wiązaniem kowalencyjnym
niespolaryzowanym
a spolaryzowanym (C)
• analizuje, w jakich
cząsteczkach (substancjach)
występują wiązania
spolaryzowane
i niespolaryzowane (D)
Uczeń:
• wyjaśnia mechanizm
tworzenia się wiązania
jonowego (C)
• wskazuje substancje,
w cząsteczkach których
występuje wiązanie jonowe
(C)
Uczeń:
• wyjaśnia różnice między
różnymi typami wiązań (C)
• określa typy wiązań
w podanych cząsteczkach (C)
• umie powiązać właściwości
związku chemicznego
z występującymi w nim
wiązaniami (D)
• zapisuje wzory sumaryczne,
strukturalne i elektronowe (C)
5.2. Znaczenie
wartościowości przy
ustalaniu wzorów
związków
chemicznych
32. Wartościowość
pierwiastków w związkach
chemicznych
• pojęcie: wartościowość
pierwiastka chemicznego
• wartościowości
najważniejszych
pierwiastków
chemicznych
• zależność między
wartościowością
pierwiastka chemicznego
a jego miejscem
w układzie okresowym
Uczeń:
• definiuje wartościowość
pierwiastka chemicznego
(A)
• zna wartościowość
najważniejszych
pierwiastków chemicznych
(A)
• wie, że wartościowość
pierwiastków w stanie
wolnym to 0 (B)
• odczytuje wartościowość
z układu okresowego
pierwiastków (prostsze
przykłady) (C)
Uczeń:
• swobodnie posługuje się
pojęciem wartościowości (C)
• określa możliwe
wartościowości pierwiastka
chemicznego na podstawie
jego położenia w układzie
okresowym (D)
3.4. Prawo
zachowania masy
5.3. Prawo stałości
składu związku
chemicznego
33.−34. Ustalanie wzorów
związków chemicznych na
podstawie wartościowości
• sposoby tworzenia
wzorów sumarycznych
prostych związków
chemicznych
• wzory sumaryczne
i strukturalne
• modele cząsteczek
związków chemicznych
35. Prawo zachowania masy.
Prawo stałości składu związku
chemicznego
• treść prawa zachowania
masy i prawa stałości
składu związku
chemicznego
• znaczenie prawa
zachowania masy i prawa
stałości składu związku
chemicznego
Uczeń:
• wyznacza wartościowość
pierwiastków chemicznych
na podstawie wzoru
sumarycznego związku
chemicznego (C)
• zapisuje wzory sumaryczne
i strukturalne związków
chemicznych na podstawie
wartościowości (C)
• określa liczbę pierwiastków
w związku chemicznym,
liczbę i rodzaj atomów
w cząsteczce (C)
• zapisuje nazwę związku
chemicznego na podstawie
wzoru (C)
• zapisuje wzory związków
chemicznych na podstawie
ich nazw (C)
• odczytuje proste zapisy, np.
2 HCl (C)
• korzysta z modeli do
zapisywania wzorów (C)
Uczeń:
• podaje treść poznanych
praw (A)
Uczeń:
• podaje nazwy związków
chemicznych na podstawie
wzoru dla przykładów
o wyższym stopniu trudności
(C)
• zapisuje wzory związków
chemicznych na podstawie
nazwy dla przykładów
o wyższym stopniu trudności
(C)
• swobodnie wyznacza
wartościowość, zapisuje wzory
sumaryczne i strukturalne
związków chemicznych (C)
Uczeń:
• wyjaśnia znaczenie poznanych
praw (B)
liczba godzin
(1 lub 2)
uzależniona od
stopnia
opanowania
materiału
przez uczniów
36.−37. Obliczenia chemiczne
z zastosowaniem prawa
zachowania masy i prawa
stałości składu związku
chemicznego
• zadania z wykorzystaniem
poznanych praw
chemicznych
Uczeń:
• stosuje poznane prawa
w prostszych zadaniach (C)
6. Uczymy się pisać
równania reakcji
chemicznych
38.−39. Równania reakcji
chemicznych
• równanie reakcji
chemicznej
• uzgadnianie równań
reakcji chemicznych
• modelowe przedstawienie
przebiegu reakcji
chemicznej
Uczeń:
• wie, co to jest równanie
reakcji chemicznej
i współczynnik
stechiometryczny (A)
• zapisuje i odczytuje prostsze
równania reakcji
chemicznych (C)
Podsumowanie
działu
40.−41. Podsumowanie
wiadomości. Sprawdzian
wiadomości. Omówienie
sprawdzianu
Uczeń:
• rozwiązuje zadania na
podstawie poznanych praw
(o większym stopniu
trudności) (C)
• ustala wzór związku
chemicznego na podstawie
stosunku mas pierwiastków
w tym związku chemicznym
(D)
Uczeń:
• zapisuje równania reakcji
chemicznych i odczytuje je
(o większym stopniu
trudności) (C)
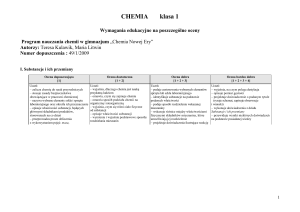
Propozycje norm ocen dla testu dwustopniowego (P + PP)1
Ocena
niedostateczny
dopuszczający
dostateczny
dobry
bardzo dobry
1
Poziom wymagań
podstawowe
(P)
ponadpodstawowe
(PP)
Opis wymagań
uczeń nie opanował nawet połowy wymagań podstawowych
(najbardziej elementarnych)
uczeń opanował większą część wymagań podstawowych
uczeń opanował wymagania podstawowe
uczeń opanował wymagania podstawowe i większą część
wymagań ponadpodstawowych
uczeń opanował pełne wymagania − podstawowe i
ponadpodstawowe
Normy ocen*/**
0%–49% P**
50%–74% P**
75%–100% P*
75% P + (50%–74%) PP**
75% P + (75%–100%) PP*
Ochenduszko Julian: Pomiar dydaktyczny w mierzeniu jakości pracy szkoły. Materiały edukacyjne Niepublicznej Placówki Doskonalenia Nauczycieli EKO-TUR, Warszawa 2001.
www.archiwum.literka.pl
*Ocenianie wg norm wymagań – oceny reprezentują odpowiednie wymagania.
** Ocenianie mieszane – wg norm wymagań i pseudonorm %.
Taksonomia celów nauczania:
A – zapamiętanie wiadomości
B – zrozumienie wiadomości
C – stosowanie wiadomości w sytuacjach typowych
D – stosowanie wiadomości w sytuacjach problemowych