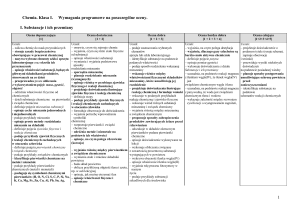
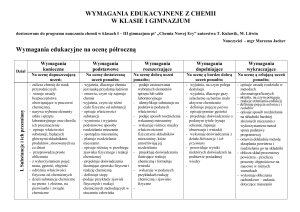
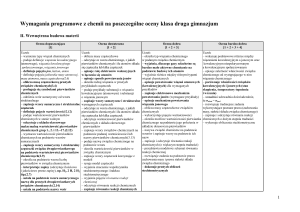
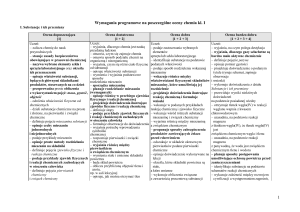
CHEMIA
I GIMNAZJUM
WYMAGANIA PODSTAWOWE
Uczeń:
wskazuje w środowisku substancje chemiczne
nazywa sprzęt i szkło laboratoryjne
opisuje podstawowe właściwości substancji będących głównymi składnikami stosowanych na co dzień
produktów (woda, sól kamienna, cukier, żelazo, tlenek węgla (IV)
dzieli substancje chemiczne na pierwiastki i związki chemiczne
definiuje mieszaninę substancji
wyjaśnia jaką mieszaninę nazywamy jednorodną a jaką niejednorodną
podaje przykłady mieszanin jednorodnych ( gazowych i ciekłych) i niejednorodnych
wybiera z konkretnych przykładów mieszaniny jednorodne i niejednorodne
sporządza mieszaninę wody i piasku, wody i soli kuchennej i rozdziela je na składniki
wymienia najprostsze metody rozdzielania mieszanin
dostrzega różnice między przemianą chemiczną a zjawiskiem fizycznym na konkretnym przykładzie
(stapianie parafiny, spalanie parafiny, powstawanie siarczku żelaza, mieszanie siarki z opiłkami żelaza)
podaje przykłady związków chemicznych
zna pojęcie gęstości
zna podział pierwiastków na metale i niemetale
podaje przykłady przedmiotów wykonanych z metali i niemetali
odróżnia metal od niemetalu na podstawie ich właściwości (węgiel i żelazo, siarka i miedź)
wie, że powietrze jest mieszaniną jednorodną
wymienia główne składniki powietrza
wymienia najważniejsze właściwości tlenu, wodoru, tlenku węgla (IV),
wie, co to jest woda
odróżnić tlen od innych pierwiastków
wymienia źródła, rodzaje zanieczyszczeń
opisuje rdzewienie żelaza
odróżnia tlen od innych gazów
określa , co to są tlenki
wybiera tlenki spośród różnych substancji i dokonuje podziału na tlenki metali i niemetali
wymienia zastosowanie tlenków wapnia, żelaza, glinu
wie, co to są gazy szlachetne
wyjaśnia dlaczego gazy szlachetne są bardzo mało aktywne chemicznie
wymienia zastosowanie gazów szlachetnych
określa znaczenie wody, powietrza ,tlenu
definiuje reakcje syntezy, analizy, wymiany
wie, na czym polega utlenianie, spalanie
wyjaśnia pojęcia: substrat, produkt, reagent
wskazuje substraty, produkty, reagenty reakcji
definiuje atomową jednostkę masy, masę atomową, masę cząsteczkową
oblicza masę cząsteczkową (proste przykłady)
wie, że atom zbudowany jest z jądra i krążących wokół niego elektronów
definiuje elektrony walencyjne
wie, co to jest liczba atomowa, liczba masowa
określa liczby protonów, elektronów, neutronów na podstawie liczby atomowej, i masowej
wie, co to jest układ okresowy pierwiastków
zna podstawowe zasady korzystania z układu okresowego pierwiastków
zna podstawowe symbole chemiczne pierwiastków ( H, O, N, Cl, S, C, P, Si, Na, K, Ca, Mg, Fe, Zn, Cu, Al.,
Pb, Sn, Ag, Hg)
potrafi odnaleźć podstawowe symbole pierwiastków w układzie okresowym pierwiastków
odczytuje z układu okresowego pierwiastków podstawowe informacje ( symbol, nazwa, masa atomowa,
liczba atomowa)
wie, co to jest wiązanie chemiczne
definiuje pojęcie wartościowości
1
definiuje pojęcie jonów
wymienia typy wiązań chemicznych
opisuje powstawanie wiązań atomowych ( kowalencyjnych) na przykładzie h2, h2o
wie, co to jest wzór sumaryczny i strukturalny
zapisuje wzory prostych cząsteczek (H2, Cl2, N2, H2O, CO2)
określa wartościowość pierwiastków na podstawie wzoru strukturalnego związku chemicznego
określa liczbę pierwiastków w związku chemicznym ( na podstawie wzoru)
odczytuje jakościowo i ilościowo proste zapisy, np. 5 Cl, 2 H2, 3 H2O
podaje nazwy prostych związków chemicznych na podstawie wzorów sumarycznych
zapisuje wzory sumaryczne prostych związków chemicznych na podstawie ich nazw
wymienia i rozróżnia podstawowe rodzaje reakcji chemicznych
podaje prawo zachowania masy i stałości składu związku chemicznego
zapisuje i odczytuje proste równania reakcji chemicznych
wie, co to jest równanie reakcji chemicznej, współczynnik stechiometryczny
definiuje pojęcia reakcja egzoenergetyczna i endoenergetyczna
podaje stany skupienia wody
wie na czym polega obieg wody w przyrodzie
opisuje budowę wody
podaje stany skupienia wody
nazywa przemiany stanów skupienia wody
wymienia właściwości wody
zapisuje wzory sumaryczny i strukturalny wody
określa co to jest rozpuszczalnik, substancja rozpuszczana
zna podział substancji na dobrze, słabo i praktycznie nierozpuszczalne w wodzie
podaje przykłady substancji które rozpuszczają się w wodzie i substancji które nie rozpuszczają się w wodzie
zna definicję rozpuszczalności
podaje, od czego zależy rozpuszczalność
wie, co to jest wykres rozpuszczalności
posługuje się wykresem rozpuszczalności substancji w wodzie tj. odczytuje ilość substancji rozpuszczonej w
danej temperaturze
wymienia czynniki wpływające na szybkość rozpuszczania się substancji stałej w wodzie
wyjaśnia pojęcie roztworu nasyconego i nienasyconego, stężonego i rozcieńczonego
definiuje pojęcia: roztwór właściwy, koloid, zawiesina
definiuje stężenie procentowe roztworu
prowadzi proste obliczenia z wykorzystaniem pojęć: stężenie procentowe, masa substancji, masa
rozpuszczalnika, masa roztworu (proste)
określa zawartość substancji rozpuszczonej i rozpuszczalnika w 100g np. 5% roztworu
wymienia sposoby racjonalnego gospodarowania wodą
2
CHEMIA
I GIMNAZJUM
WYMAGANIA ROZSZERZAJĄCE
Uczeń:
wie, co to jest materia
wyjaśnia czym się różni ciało fizyczne od substancji chemicznej
wymienia i wyjaśnia proste metody rozdziału mieszanin
wskazuje różnice między właściwościami fizycznymi składników mieszaniny, które umożliwiają ich
rozdzielenie
umie sporządzić i rozdzielić na składniki mieszaninę wody i piasku, wody i soli kamiennej, kredy i soli
kamiennej, siarki i opiłków żelaza, wody i oleju jadalnego
opisuje różnice w przebiegu zjawiska fizycznego reakcji chemicznej
podaje przykłady reakcji chemicznych i zjawisk fizycznych zachodzących w otoczeniu człowieka
projektuje doświadczenie ilustrujące zjawisko fizyczne i reakcję chemiczną
formułuje obserwacje do doświadczenia
zna wymagane symbole chemiczne pierwiastków
rozpoznaje pierwiastki i związki chemiczne
wyjaśnia różnice pomiędzy pierwiastkiem a związkiem chemicznym
wymienia stałe i zmienne składniki powietrza
bada skład powietrza
oblicza przybliżoną objętość tlenu i azotu, np. w sali lekcyjnej
wie, jak można otrzymać tlen
określa właściwości tlenu, tlenku węgla (IV) i azotu w przyrodzie
określa wykorzystanie tlenu, azotu , gazów szlachetnych
podaje sposób otrzymywania tlenku węgla (IV) (reakcja węgla z tlenem)
określa właściwości tlenku węgla (IV)
planuje doświadczenie umożliwiające wykrycie obecności tlenek węgla (IV) w powietrzu wydychanym z płuc
opisuje obieg tlenu, tlenku węgla (IV) i azotu w przyrodzie
opisuje właściwości fizyczne i chemiczne gazów szlachetnych
wymienia zastosowania tlenków wapnia, żelaza, glinu, azotu, gazów szlachetnych, tlenku węgla (IV), tlenu,
wodoru
zapisuje słownie przykład reakcji syntezy, analizy i wymiany
wskazuje substraty, produkty, pierwiastki, związki chemiczne
wie, jak otrzymać wodór (reakcja kwasu solnego z metalem)
wyjaśnia co to jest efekt cieplarniany
wyjaśnia pojęcie higroskopijności
opisuje, na czym polega powstawanie dziury ozonowej, kwaśnych opadów
wymienia źródła, rodzaje i skutki zanieczyszczeń powietrza
definiuje pojęcia reakcja egzo- i endotermiczna
omawia poglądy na temat budowy materii
wyjaśnia zjawisko dyfuzji
planuje doświadczenie potwierdzające ziarnistość budowy materii
oblicza masy cząsteczkowe
określa cechy charakterystyczne cząstek elementarnych (masy i ładunki)
wie, co to są izotopy
wymienia izotopy wodoru i podaje różnice między nimi
wymienia dziedziny życia, w których stosuje się izotopy
korzysta z układu okresowego pierwiastków
przedstawia model dowolnego atomu I i II okresu tablicy Mendelejewa z uwzględnieniem cząstek
elementarnych
odczytuje z układu okresowego pierwiastków wartościowość maksymalną dla pierwiastków grup: 1., 2.
(względem tlenu i wodoru)
opisuje rolę elektronów walencyjnych w łączeniu się atomów
opisuje sposób powstawania jonów
wyjaśnia istotę wiązania atomowego na przykładzie cząstek pierwiastka gazowego
3
zapisuje cząsteczki prostych związków chemicznych (tlenki, chlorki, siarczki) w postaci wzorów
sumarycznych i strukturalnych w oparciu o podane wartościowości pierwiastków
zapisuje, uzgadnia i odczytuje typowe równania reakcji chemicznych
przeprowadza proste obliczenia z wykorzystaniem pojęć: gęstość, masa i objętość
przeprowadza obliczenia z wykorzystaniem prawa zachowania masy i prawa stałości składu związku
chemicznego
bada zdolność do rozpuszczani się różnych substancji w wodzie
opisuje budowę cząsteczki wody
proponuje sposoby racjonalnego gospodarowania wodą
tłumaczy, na czym polega proces mieszania, rozpuszczania
wyjaśnia, dlaczego woda dla jednych substancji jest rozpuszczalnikiem, a dla innych nie
wyjaśnia , na czym polega proces rozpuszczania
odczytuje z wykresu rozpuszczalności i porównuje rozpuszczalność różnych substancji w tej samej
temperaturze
oblicza ilość substancji, którą można rozpuścić w określonej ilości wody w podanej temperaturze
opisuje różnice między roztworem rozcieńczonym, stężonym, nasyconym i nienasyconym
podaje przykłady roztworu właściwego, koloidu, zawiesiny
prowadzi obliczenia z wykorzystaniem pojęć: stężenie procentowe, masa substancji, masa rozpuszczalnika,
masa roztworu
potrafi obliczyć stężenie procentowe roztworu nasyconego w danej temperaturze ( z wykorzystaniem wykresu
rozpuszczalności)
oblicza ilość substancji, którą można rozpuścić w określonej ilości wody w podanej temperaturze
4
CHEMIA
I GIMNAZJUM
WYMAGANIA DOPEŁNIAJĄCE
Uczeń:
identyfikuje substancje na podstawie podanych informacji
projektuje doświadczenie (rysunek, obserwacje, wnioski) mając podany tytuł
wyjaśnia na czym polega destylacja
podaje sposób rozdzielenia wskazanej mieszaniny np. wody i atramentu
wskazuje różnice między właściwościami fizycznymi składników mieszaniny, które umożliwiają jej
rozdzielenie
wyjaśnia różnicę między mieszaniną a związkiem chemicznym
projektuje doświadczenia pokazujące reakcję chemiczną i formułuje wnioski
analizuje w podanych przykładach reakcję chemiczną i zjawisko fizyczne
proponuje sposoby zabezpieczania produktów zawierających żelazo przed rdzewieniem
wyjaśnia związek pomiędzy podobieństwem właściwości pierwiastków zapisanych w tej samej grupie układu
okresowego a budową atomów i liczbą elektronów walencyjnych
wyjaśnia różnice w budowie atomów izotopów wodoru
zapisuje elektronowo mechanizm powstawania jonów
opisuje na przykładzie Na, Mg, Al., Cl, S powstawanie wiązania jonowego
odczytuje z układu okresowego pierwiastków wartościowość maksymalną dla pierwiastków grup: 1., 2.,
13.,14., 15., 16., i 17. (względem tlenu i wodoru)
porównuje właściwości związków kowalencyjnych i jonowych (stan skupienia, temperatury topnienia i
wrzenia)
określa zagrożenia wynikające z efektu cieplarnianego, dziury ozonowej, kwaśnych deszczów
proponuje sposoby zapobiegania powiększaniu się dziury ozonowej
podaje przykłady różnych typów reakcji chemicznych
zapisuje i odczytuje równania reakcji chemicznych o dużym stopniu trudności
swobodnie korzysta z informacji zawartych w układzie okresowym pierwiastków
rozwiązuje trudniejsze zadania wykorzystujące poznane prawa
proponuje doświadczenie, że woda jest związkiem wodoru i tlenu
wyjaśnia polarną budowę cząsteczki wody
planuje i wykonuje doświadczenia wykazujące wpływ różnych czynników na szybkość rozpuszczania
substancji stałych w wodzie
rozwiązuje zadania rachunkowe na stężenie procentowe z wykorzystaniem gęstości
oblicza stężenie procentowe roztworu po zmieszaniu, rozcieńczeniu i odparowaniu
oblicza rozpuszczalność substancji w danej temperaturze, znają stężenie procentowe jej nasyconego roztworu
w tej temperaturze
5