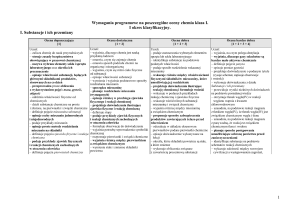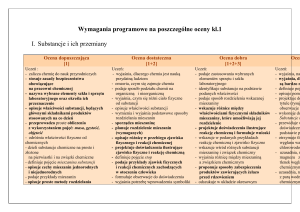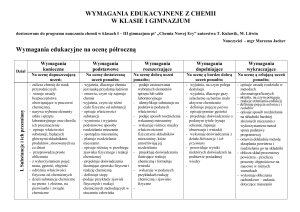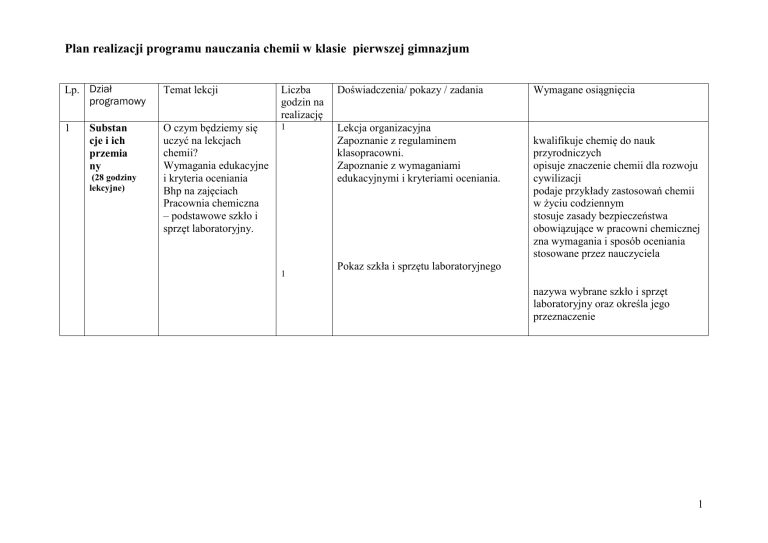
Plan realizacji programu nauczania chemii w klasie pierwszej gimnazjum
Lp. Dział
programowy
Temat lekcji
Liczba
godzin na
realizację
Doświadczenia/ pokazy / zadania
1
O czym będziemy się
uczyć na lekcjach
chemii?
Wymagania edukacyjne
i kryteria oceniania
Bhp na zajęciach
Pracownia chemiczna
– podstawowe szkło i
sprzęt laboratoryjny.
1
Lekcja organizacyjna
Zapoznanie z regulaminem
klasopracowni.
Zapoznanie z wymaganiami
edukacyjnymi i kryteriami oceniania.
Substan
cje i ich
przemia
ny
(28 godziny
lekcyjne)
1
Wymagane osiągnięcia
kwalifikuje chemię do nauk
przyrodniczych
opisuje znaczenie chemii dla rozwoju
cywilizacji
podaje przykłady zastosowań chemii
w życiu codziennym
stosuje zasady bezpieczeństwa
obowiązujące w pracowni chemicznej
zna wymagania i sposób oceniania
stosowane przez nauczyciela
Pokaz szkła i sprzętu laboratoryjnego
nazywa wybrane szkło i sprzęt
laboratoryjny oraz określa jego
przeznaczenie
1
2
3
4
Właściwości substancji
2
Zjawisko fizyczne a
reakcja chemiczna
1
Mieszaniny substancji
1
Doświadczenie 1. Badanie właściwości
wybranych substancji (miedzi, żelaza, soli
kuchennej, mąki, wody, chloru)
Doświadczenie 2. Porównanie gęstości
wody i oleju
Przykład 1. Obliczanie gęstości
Doświadczenie 3. Na czym polega
różnica między zjawiskiem fizycznym a
reakcją chemiczną?
Doświadczenie 4. Sporządzanie
mieszanin i rozdzielanie ich na składniki
opisuje właściwości substancji
będących głównymi składnikami
stosowanych na co dzień produktów,
np.: soli kamiennej, cukru, mąki,
wody, miedzi, żelaza
wykonuje doświadczenia, w których
bada właściwości wybranych
substancji
wymienia stany skupienia substancji
na przykładzie wody
wymienia nazwy procesów
zachodzących podczas zmian stanów
skupienia
przeprowadza obliczenia z
wykorzystaniem pojęć: masa, gęstość,
objętość
przelicza jednostkę objętości i masy
opisuje sposób pomiaru gęstości
cieczy
opisuje różnice w przebiegu zjawiska
fizycznego i reakcji chemicznej
podaje przykłady zjawisk fizycznych i
reakcji chemicznych zachodzących w
otoczeniu człowieka
mieszanin jednorodnych i
niejednorodnych
opisuje proste metody rozdzielania
mieszanin na składniki
2
wskazuje różnice między
właściwościami fizycznymi
składników mieszaniny
opisuje cechy mieszaniny, które
umożliwiają jej rozdzielenie
sporządza mieszaniny: wody i piasku,
wody i soli kamiennej, kredy i soli
kamiennej, siarki i opiłków żelaza,
wody i oleju jadalnego, wody i
atramentu; rozdziela je na składniki
5
Pierwiastek
chemiczny a 2
związek chemiczny
Doświadczenie5.
Pokaz pierwiastków i związków
chemicznych
wyjaśnia różnicę między
pierwiastkiem chemicznym a
związkiem chemicznym
wyjaśnia potrzebę wprowadzenia
symboli chemicznej
zna symbole pierwiastków
chemicznych: H, O, N, Cl, S, C, P, Si,
Na, K, Ca, Mg, Fe, Zn, Cu, Al, Pb,
Sn, Ag, Hg i posługuje się nimi
3
Doświadczenie6.Badanie właściwości
pierwiastków chemicznych(cyn ,sód,
magnez, siarka)
Doświadczenie 7.Badanie przewodnictwa
cieplnego metali
Doświadczenie8. Badanie przewodnictwa
elektrycznego metali
Doświadczenie 9.Porównywanie
aktywności chemicznej metali
Doświadczenie 10.Porównywanie
twardości cynku, mosiądzu i miedzi
6
Metale i niemetale
2
7
Związek chemiczny a
mieszanina
1
8
Powietrze
1
Doświadczenie11.
Jak najprościej zbadać skład powietrz?
9.
Tlen i jego właściwości
2
Doświadczenie 12.
Otrzymywanie tlenu z manganianu VJ
potasu
Doświadczenie 13.
Spalanie węgla , siarki i magnezu w
tlenie
klasyfikuje pierwiastki chemiczne na
metale i niemetale
odróżnia metale od niemetali na
podstawie ich właściwości
opisuje na przykładzie żelaza, na
czym polega korozja
proponuje sposoby zabezpieczania
przedmiotów zawierających w swoim
składzie żelazo przed rdzewieniem
opisuje cechy mieszanin jednorodnych
i niejednorodnych
wykonuje lub obserwuje
doświadczenie potwierdzające, że
powietrze jest mieszaniną
opisuje skład i właściwości powietrza
zapisuje słowny przebieg reakcji
otrzymywania tlenu z tlenku rtęci II
obserwuje doświadczenia ilustrujące
typy reakcji i formułuje wnioski
opisuje na czym polega reakcja
analizy i syntezy
wskazuje substraty i produkty reakcji
chemicznej
planuje i wykonuje doświadczenia
mające na celu badanie właściwości
tlenu
opisuje właściwości fizyczne i
chemiczne tlenu
4
wymienia zastosowania tlenków
wapnia, żelaza i glinu
10
Azot-główny składnik
powietrza
1
opisuje właściwości fizyczne,
chemiczne i zastosowanie azotu
11
Gazy szlachetne
1
12
Tlenek węgla(IV) –
właściwości i rola w
przyrodzie
2
wyjaśnia, dlaczego gazy szlachetne są
bardzo mało aktywne chemicznie
wymienia zastosowania gazów
szlachetnych
opisuje obieg tlenu i tlenku węgla IV
w przyrodzie
planuje i wykonuje doświadczenie
pozwalające wykryć obecność tlenku
węgla IV w powietrzu wydychanym z
płuc
opisuje właściwości fizyczne i
chemiczne tlenku węgla IV
opisuje na czym polega reakcja
wymiany
obserwuje doświadczenia ilustrujące
reakcję wymiany i formułuje wnioski
wskazuje substraty i produkty reakcji
Doświadczenie14
.Wykrywanie obecności tlenku węgla IV
Doświadczenie 15.
Otrzymywanie tlenku węgla IV
Doświadczenie 16.
Badanie właściwości tlenku węgla IV
5
wymiany
13
Rola pary wodnej w
powietrzu
1
14
Zanieczyszczenia
powietrza
2
15
Wodór i jego
właściwości
1
Doświadczenie 17.
Pochłanianie pary wodnej z powietrza
przez stały wodorotlenek sodu
Doświadczenie 18.
Otrzymywanie wodoru w reakcji cynku z
kwasem chlorowodorowym
Tłumacz na przykładzie wody, na
czym polegają zmiany skupieniaopisuje obieg wody w przyrodzie
opisuje zjawisko higroskopijności
wymienia źródła, rodzaje i skutki
zanieczyszczeń powietrza
opisuje, na czym polega powstawanie
dziury ozonowe
proponuje sposoby zapobiegania
powiększaniu się dziury ozonowej
planuje sposoby umożliwiające
ochronę powietrza przed
zanieczyszczeniami
zapisuje słownie przebieg reakcji
otrzymywania wodoru
wskazuje substraty i produkty
opisuje właściwości fizyczne i
chemiczne wodoru
wymienia zastosowania wodoru
6
16
Energia w reakcjach
chemicznych
1
Definiuje pojęcia reakcji
egzoenergetycznej i
endoenergetycznej
17
Reakcje syntezy,
analizy i
wymiany(lekcja
utrwalająca)
2
podaje przykłady różnych typów
reakcji chemicznych
wskazuje substraty i produkty
18
Podsumowanie wiadomości o
substancjach i ich
przemianach
1
19
Sprawdzian wiadomości 2
i jego omówienie
20
Wewnę
trzna
budowa
materii (31
godzin
lekcyjnych)
Ziarnista budowa
materii i historyczny
rozwój pojęcia atomu
1
Doświadczenie 19.
Obserwowanie zjawiska dyfuzji
opisuje ziarnistą budowę materii
tłumacz na czym polega zjawisko
dyfuzji
planuje doświadczenia potwierdzające
ziarnistość budowy materii
wyjaśnia różnicę między
pierwiastkiem a związkiem
chemicznym na podstawie założeń
teorii atomistyczno-cząsteczkowej
7
budowy materii
opisuje , czym się różni atom od
cząsteczki
21
Masa i rozmiary
atomów
2
22
Budowa atomu
2
23
Izotopy
3
Obliczanie masy cząsteczkowej wody i
tlenku węgla(IV)
definiuje pojęcie „jednostka masy
atomowej
oblicza masy cząsteczkowe prostych
związków chemicznych
opisuje i charakteryzuje skład atomu
pierwiastka chemicznego ( jądro:
protony i neutrony, elektrony)
definiuje pojęcie „ elektrony
walencyjne”
ustala liczbę protonów, neutronów i
elektronów w atomie danego
pierwiastka chemicznego, gdy znane
są liczby atomowa i masowa
zapisuje konfigurację elektronową
definiuje pojęcie izotopy
wyjaśnia różnicę w budowie atomów
izotopu wodoru
definiuje pojęcie „ masa atomowa”
jako średnia masa atomów danego
pierwiastka z uwzględnieniem jego
składu izotopowego
wymienia dziedziny życia, w których
stosuje się izotopy
8
24
Układ okresowy
pierwiastków
chemicznych
1
25
Zależność między
budową atomu
pierwiastka a jego
położeniem w układzie
okresowym, charakter
chemiczny
pierwiastków grup
głównych
2
Opisanie atomu pierwiastka chemicznego
na podstawie jego położenia w układzie
okresowym, przykład: węgiel, fluor, glin
26
Rodzaje wiązań
chemicznych
4
Sposoby łączenia się atomów, przykłady:
cząsteczka wodoru, chloru , cząsteczka
chlorowodoru, amoniaku, tlenku węgla
(IV), tlenku wodoru, chlorek sodu,
siarczek magnezu, chlorek glinu
Podaje treść prawa okresowości
Odczytuje z układu okresowego
podstawowe informacje o
pierwiastkach chemicznych ( symbol,
nazwa liczba atomowa , masa
atomowa, rodzaj pierwiastka
chemicznego- metal lub niemetal),
m.in. o azocie, tlenie, wodorze,
sodzie, magnezie
podaje informacje na temat budowy
atomu pierwiastka na podstawie
znajomości numeru grupy i okresu
wyjaśnia związek między
podobieństwem właściwości
pierwiastków chemicznych
zapisanych w tej samej grupie układu
a budową ich atomów i liczbą
elektronów walencyjnych
opisuje rilę elektronów walencyjnych
w łączeniu się atomów
Wyjaśnia dlaczego gazy szlachetne są
bardzo mało aktywne chemicznie na
podstawie budowy ich atomów
opisuje powstawanie wiązań
atomowych( kowalencyjnych) na
przykładzie cząsteczek:H2 ,Cl2, O2,
N2,CO2, H2O, HCl, NH3,zapisuje
wzory sumaryczne i strukturalne tych
cząsteczek
definiuje pojęcie jony,
zapisuje elektronowo mechanizm
powstawania jonów na przykładzie
9
:Na, Mg, Al ,Cl, S
opisuje mechanizm powstawania
wiązania jonowego
27
Znaczenie
wartościowości przy
ustalaniu wzorów
związków chemicznych
Co oznaczają symbole i
wzory?
2
Ustalanie wzorów związków
chemicznych ,takich jak:
tlenek żelaza (III), tlenek miedzi (I),
tlenek ołowiu(IV), tlenek siarki(VI) i inne
Nazewnictwo związków chemicznych
1
28
Prawo stałości składu
związku chemicznego
3
Obliczanie stosunku masowego,
obliczanie składu procentowego,
definiuje pojęcie wartościowość,
odczytuje z układu okresowego
maksymalną wartościowość
względem tlenu i wodoru,
pierwiastków chemicznych grup 1,2,
13,14,15,16,17; pisze wzory
strukturalne cząsteczek związków
dwupierwiastkowych ( o wiązaniach
kowalencyjnych) o znanych
wartościowościach pierwiastków
chemicznych, ustala nazwę związku
chemicznego na podstawi wzoru i
odwrotnie, interpretuje zapisy:H2 ,2H,
2H2 itp., zna symbole pierwiastków
chemicznych(20) i posługuje się nimi
do zapisywania wzorów
podaje treść prawa stałości składu
związku chemicznego , dokonuje
prostych obliczeń z zastosowaniem
tego prawa
10
29
Równania reakcji
chemicznych
4
Zapisywanie równań reakcji
chemicznych, takich jak:
Spalanie węgla a tlenie, otrzymywanie
tlenu z tlenku miedzi(II), spalanie
magnezu w tlenie, spalanie magnezu w
tlenku węgla(IV)
30
Prawo zachowania
masy
1
Obliczanie masy substratów i produktów
zgodnie z prawem zachowania masy
31
Obliczenia
stechiometryczne
2
Obliczanie masy produktów i substratów
32
Podsumowanie
wiadomości o
wewnętrznej budowie
materii
1
33
Sprawdzian wiadomości 2
i jego omówienie
wyjaśnia co to jest równanie reakcji
chemicznej ,definiuje pojęcie indeks i
współczynnik stechiometryczny,
zapisuje równania reakcji analizy ,
syntezy i wymiany, zapisuje rozkład
wody prądem elektrycznym i reakcję
magnezu z parą wodną, uzgadnia
równania reakcji chemicznych
dobierając odpowiednie
współczynniki stechiometryczne,
wskazuje substraty i produkty
podaje treść prawa zachowania masy,
dokonuje prostych obliczeń z
zastosowaniem prawa zachowania
masy
Zapisuje za pomocą symboli
pierwiastków i wznów związków
chemicznych równania reakcji i
dokonuje prostych obliczeń
stechiometrycznych
11
Woda – właściwości i
rola w przyrodzie.
Zanieczyszczenia wód.
1
Doświadczenie 20.
Odparowanie wody wodociągowej
Opisuje właściwości i znaczenie wody
w przyrodzie, proponuje sposoby
racjonalnego gospodarowania wodą
35
Woda jako
rozpuszczal -nik
1
Doświadczenie 21.
Rozpuszczanie substancji w wodzie
36
Szybkość rozpuszczania
się substancji
1
Doświadczenie 22.
Badanie wpływu różnych czynników na
szybkość rozpuszczania się substancji
stałej w wodzie
37
Rozpuszcza-lność
substancji w wodzie
2
Doświadczenie 23.
Badania rozpuszczalności siarczanu (VI)
miedzi(II) w wodzie
Bada zdolność do rozpuszczania się
różnych substancji, tłumacz na czym
polega rozpuszczanie, opisuje budowę
cząsteczki wody, wyjaśnia dlaczego
woda dla niektórych substancji jest
rozpuszczalnikiem, a dla niektórych
nie, porównuje rozpuszczalność
związków kowalencyjnych i
jonowych
wyjaśnia pojecie roztworu, tłumaczy
na czym polega proces mieszania
substancji, planuje i wykonuje
doświadczenia wykazujące wpływ
różnych czynników na szybkość
rozpuszczania substancji stałych w
wodzie
wyjaśnia pojęcie rozpuszczalność
substancji, roztwór nasycony,
odczytuje rozpuszczalność substancji
z wykresu jej rozpuszczalności,
analizuje wykresy rozpuszczalności
różnych substancji oblicza ilość
substancji, którą można rozpuścić w
określonej ilości wody o danej
temperaturze
34
Woda i
roztwory
wodne
(11 godzin
lekcyjnych)
12
38
Rodzaje roztworów
1
39
Stężenie procentowe
roztworu
2
40
Zwiększanie i
zmniejszanie stężenia
roztworów
2
Doświadczenie24.
Hodowla kryształów
Doświadczenie 25.
Sporządzanie roztworu właściwego,
koloidu i zawiesiny
wyjaśnia pojęcie roztwór
nienasycony, podaje przykłady
substancji , które rozpuszczają się w
wodzie tworząc roztwór właściwy,
podaje przykłady substancji, które nie
rozpuszczają się w wodzie , tworząc
koloidy i zawiesiny, opisuje różnice
między roztworem rozcieńczonym,
stężonym, nasyconym i nienasyconym
Sposoby obliczania stężenia
prowadzi obliczenia z
procentowego roztworu; obliczanie
wykorzystaniem pojęć: stężenie
stężenia przy dane masie roztworu i
procentowe, masa substancji masa
substancji rozpuszczonej, obliczanie
rozpuszczalnika, masa roztworu,
stężenia przy danej masie substancji
gęstość,
rozpuszczonej i rozpuszczalnika,
oblicza stężenie procentowe roztworu
obliczanie masy substancji rozpuszczonej, nasyconego w danej temperaturze (
obliczanie masy substancji rozpuszczonej wykorzystaniem wykresu
w roztworze o określonym stężeniu i
rozpuszczalności)
gęstości
Zwiększanie stężenia roztworu, obliczanie Prowadzi obliczenia z
stężenia procentowego po jego
wykorzystaniem pojęć jak wyżej,
rozcieńczeniu, obliczanie masy
podaje sposoby na zmniejszanie lub
rozpuszczalnika którą trzeba odparować, zwiększanie stężenia roztworów,
aby uzyskać roztwór o określonym
dokonuje obliczeń prowadzących do
stężeniu , obliczenie masy substancji,
otrzymania roztworów o innym
którą trzeba dodać, aby otrzymać roztwór stężeniu niż stężenie początkowe
o określonym stężeniu
13
41
Podsumowanie
wiadomości o wodzie i
roztworach wodnych
Razem 70 h
1
Razem 70h + 2h do dyspozycji
nauczyciela
2h do dyspozycji nauczyciela
14