Bóle brzucha, biegunka, wymioty, wysypka, depresja, rozdrażnienie, bóle głowy, bóle
stawów i mięśni, katar i kaszel…
Kiedy dowiadujemy się, że te objawy łączą się z jedną chorobą, zaskoczeni zastanawiamy
się, jak to możliwe, by jeden drobnoustrój powodował w naszym organizmie tak wiele
spustoszeń. Podświadome kojarzenie przez wielu z nas choroby z zarazkiem jako przyczyną
to prawdziwy hołd dla L. Pasteura, który ponad 150 lat temu sugerował, że bakterie są
przyczyną wielu chorób, a potem heroicznie torował drogę swojemu odkryciu przez wiele lat.
Pasteurowi i kontynuatorom jego idei, udało się tę prawdę tak ugruntować, że w świadomość
ludzi jako tako wykształconych łączyła automatycznie chorobę z drobnoustrojem, a
znalezienie sposobu zwalczenia zarazka dawało szansę wyleczenia. Równocześnie jednak
z rozwojem wiedzy o chorobach związanych z drobnoustrojami, w pracowniach uczonych,
zaczęto poznawać naturalne mechanizmy obrony przed drobnoustrojami, jak się wkrótce
okazało, zaangażowane również w „dyscyplinowanie” własnych komórek organizmu, w tym
odszczepieńców roszczących sobie prawo do nieograniczonego rozrostu, czyli komórek
nowotworowych. Uświadomiono sobie, że wyspecjalizowany układ odpornościowy pełni nie
tylko funkcje obronne - wojska lecz również porządkowe - policji. Rozwijając te analogie,
można przewidzieć, problemy organizmu, kiedy układ odpornościowy staje się zbyt opieszały
lub nadgorliwy. Skutki tej drugiej możliwość poznano jednak znacznie później.
Od wieków zdawano sobie sprawę z roli skóry jako opakowania chroniącego organizm.
Rozumując na dość opacznie, od XIV w. w Europie zaczęto unikać kąpieli, by zapobiec
„rozmiękczaniu” skóry, które miało ułatwiać wnikanie do ciała miazmatów odpowiedzialnych
za choroby, z czarną śmiercią na czele. Dziś mówimy, że skóra stanowi nieswoistą barierę
odpornościową organizmu.
Dla omawianych zagadnień istotne są jednakże wyspecjalizowane mechanizmy swoiste,
przedmiot badań immunologii. Są one uruchamiane, gdy drobnoustroje lub inne nieznane
dotąd układowi odpornościowemu substancje lub struktury (wszystkie nazywać będziemy
„obcymi”) w wyniku kontaktu z wyspecjalizowanymi komórkami-czujnikami, zostają
zauważone, przetworzone do postaci czytelnej dla systemu i zarejestrowane w pamięci jako
„obcy”. Teraz układ przystępuje do wytworzenia „na miarę”, skutecznej dla zwalczenia
„obcego broni”. Są nią cząsteczki swoistych przeciwciał swobodnie krążące we krwi,
krępujące „obcego” napotkanego w dowolnym miejscu organizmu, lub przymocowane do
wyspecjalizowanych komórek obronnych. Tak uzbrojone komórki angażują się w
bezpośrednie starcia z „obcymi” doprowadzając do ich rozpadu i usunięcia z organizmu.
Skuci przez przeciwciała „obcy” lub ich szczątki, usuwane są przez makrofagi,
wyspecjalizowane komórki obronne o funkcji odkurzaczy. Tak w dość poetycko
przestawionym zarysie przedstawia się pierwszy kontakt organizmu z obcym. Całe
wydarzenie zostaje zarchiwizowane przez komórki pamięci immunologicznej organizmu.
Kolejne wtargnięcie obcego do organizmu, powoduje bardzo szybką i skuteczną reakcję
układu, odtwarzającego stosowne siły i środki z gotowych zapisów. Czasem niestety zbyt
szybką i zbyt nasiloną.
Nadgorliwość układu odpornościowego: doszukiwanie się „obcego w swoich” prowadzi do
niszczenia własnych komórek - chorób autoimmunizacyjnych. Skutkiem „histerycznej” reakcji
na znikome ilości obcych substancji, lekceważonych przez „rozważny” układ odpornościowy
jest alergia (substancje ją wywołujące zwane są alergenami).
Nietolerancja pokarmowa przypomina pozornie alergię pokarmową. W jej przypadku jednak
trudno mówić j o „histerycznej reakcji”. System działa prawidłowo i w dobrej wierze.
Jednakże „obcy” są tak liczni, że służby porządkowe organizmu nie nadążają z ich
usunięciem po neutralizacji. W organizmie pozostają tłumy „immunologicznych zombi”
odpowiedzialnych z objawy chorobowe.
Przeciwciała są „szyte na miarę” z myślą o konkretnym „obcym”; rezygnując z takiej poetyki
powiemy, że są specyficzne. Powstając w wyniku kontaktu układu odpornościowego z
„obcym” (zwanym przez immunologów antygenem), mogą rozpoznawać i wiązać wyłącznie
elementy „macierzystego” antygenu, tworząc z nim kompleksy. Powstawanie kompleksów
neutralizuje antygen i ułatwia jego połknięcie przez komórki żerne, wspomniane już
makrofagi. Przeciwciała są białkami zwanymi immunoglobulinami, których podstawowa
struktura przypomina literę Y. Ramiona Y wiążą specyficznie antygen na zasadzie klucza i
zamka. Dostosowywanie przeciwciała do antygenu odbywa się stopniowo, jak dopiłowywanie
dorabianego klucza. Komórki odpornościowe produkujące przeciwciała – plazmocyty
wytwarzają kolejne generacje przeciwciał, z których każda następna jest doskonalsza wiąże antygen łatwiej i silniej. Przeciwciała dzielone są na 5 klas o różnej budowie (choć
zawsze podstawową jednostką jest litera Y) i funkcjach. W klasie IgA wyróżnia się dwie
podklasy, w IgG cztery. Za nietolerancję pokarmową odpowiada najważniejsza dla
odporności organizmu w ogóle klasa immunoglobulin: IgG. Podkreślmy, że we wspominanej
alergii pośredniczy inna klasa przeciwciał, mianowicie IgE. Wspólną istotę alergii i
nietolerancji pokarmowej ujął w złotą myśl 100 lat przed narodzinami immunologii genialny
poeta, z zawodu lekarz, Fryderyk Schiller, gdy zauważył, że „Szkodliwy czynnik wchłonięty
do organizmu nie powoduje takiego zagrożenia dla życia jak niepohamowana chęć do
obrony przed nim”. Nic dodać, nic ująć.
Nietolerancja pokarmowa zależna od IgG – początek
Jelito, kojarzone głównie z przetwarzaniem i wchłanianiem pokarmu, jest równocześnie
największym organem układu odpornościowego i, co zaskakujące, niezwykle istotnym
elementem układu nerwowego, zwanym niekiedy drugim mózgiem. Udział jelita w procesach
odpornościowych jest o tyle oczywisty, że jelito, obok płuc, jest naturalnym miejscem
kontaktu organizmu z przybyszami z zewnątrz. Na wielu schematach opisujących
rozmieszczenie flory bakteryjnej, organizm ludzki przedstawiany jest jako obły kształt z
zagłębieniami odpowiadającymi płucom, uszom, pochwie itd., przebity na wylot rurą
przewodu pokarmowego, jak góra tunelem. Wnętrze przewodu pokarmowego, mimo
środkowego umiejscowienia w organizmie, traktowane jest jako powierzchnia zewnętrzna.
Podstawowa funkcja jelita cienkiego - wybiórcze wchłanianie i przekazywanie do krwi i limfy
strawionego pokarmu w postaci drobnocząsteczkowych aminokwasów, glukozy i kwasów
tłuszczowych wykonywana jest przez komórki enterocyty, ściśle brukujące wewnętrzną
powierzchnię jelita. W ścianie jelita dyżurują różnorodne komórki układu odpornościowego
zdolne do wychwycenia czynników rozpoznawanych jako nieznane lub o statusie: znane,
lecz niepożądane. Ta druga reakcja jest szybka, gdyż wymaga jedynie mobilizacji
istniejących środków obronnych lub ich odtworzenia z pomocą komórek pamięci
immunologicznej. Nieznany „obcy” jest „preparowany” przez tzw. komórki prezentujące
antygen i „okazywany” kolejnym typom komórek odpornościowych w przystępnej dla nich
formie. Wśród nich znajdują się plazmocyty produkujące specyficzne przeciwciała IgG.
Enterocyty najeżone są cząsteczkami przeciwciał klasy IgA, stanowiącymi doraźną broń
nabłonka jelita. Sojusznikami układu odpornościowego jelita są bakterie jelitowe, mikrobiota.
Za sprzyjające ich egzystencji warunki rewanżują się organizmowi na wiele sposobów:
wypierają bakterie chorobotwórcze docierające do jelita cienkiego, stwarzając niekorzystne
dla nich środowisko chemiczne; wytwarzają substancje, gnagliozydy, niezbędne dla
rozwoju komórek nerwowych gospodarza itd. Ilość sojuszniczych bakterii przekracza ilość
komórek organizmu, a ich łączna waga oceniana jest na 1-3 kg. Niektórzy traktują mikrobiota
jako kolejny organ naszego ciała.
Ściśle przylegające do siebie prawidłowe enterocyty, dyżurne komórki odpornościowe,
przeciwciała IgA, prawidłowa flora bakteryjna, wszystkie te elementy składają się tzw. barierę
jelitową.
Sielanka
Nawet prawidłowa bariera jelitowa sporadycznie przepuszcza nietypowe produkty trawienia,
np. większe niż zwykle fragmenty białek (żadna granica nie jest w 100% szczelna). Są one
szybko rozpoznawane i wiązane przez przeciwciała IgG obecne już we krwi, ze względu na
uprzednie rzadkie, lecz powtarzające się, przypadki takich wtargnięć. Kompleksy są
usuwane przez makrofagi. Śladem incydentów granicznych w jelicie jest niewielkie stężenie
swoistych IgG, wykrywalne w specjalistycznych testach, nie wywołujące objawów
nietolerancji pokarmowej. Nieurozmaicona dieta, powodować może, że IgG swoiste dla
powtarzających się jej składników może być stosunkowo wysokie, nie powodując jednak
objawów klinicznych.
Burza
Wiemy już co się dzieje w jelicie zdrowym, w stanie prawidłowym, czyli fizjologicznym. Teraz
czas na opis najczęstszego scenariusza prowadzących do patologii jaką jest nietolerancja
pokarmowa, wiążącego się z uszkodzeniem bariery jelitowej, przy prawidłowo działającym
układzie odpornościowym.
Istnieje sporo czynników, zakłócających delikatną fizjologiczną równowagę jelita i
uszkadzających barierę jelitową. Najpowszechniejszym jest antybiotykoterapia, niszcząca
wszystko co staje na jej drodze, nie wyłączając prawidłowej mikroflory. Wykorzystując wolną
przestrzeń życiową pozostawioną przez przetrzebione mikrobiota, w jelicie mnożą się
niepożądane drobnoustroje. Ich toksyny rozszczelniają nabłonek jelita i po wniknięciu przez
utworzone wyłomy pobudzają organizm do gwałtownej interwencji układu odpornościowego:
w miejscu wniknięcia i całym organizmie. Nowa flora bakteryjna jelit rozwija się tak
intensywnie, że uniemożliwia powrót i regenerację gatunków pożądanych. Rujnujące
ciągłość nabłonka jelita są także zmiany wywołane przez ostre zatrucia pokarmowe, ostre
bakteryjne i wirusowe zakażenia przewodu pokarmowego. Fatalny wpływ wywiera terapia
onkologiczna. Zagrożeniem dla stanu nabłonka są wszechobecne konserwanty żywności,
alkohol, nikotyna, leki przeciwbólowe i …. stres. Wszystkie te czynniki upośledzają
wybiórczość wchłaniania jelitowego, prowadząc do zespołu nieszczelnego jelita, LSG (ang.
leaky gut syndrome) – otwarcia organizmu na substancje niepożądane. LSG ma charakter
chroniczny, a objawy nasilają się z czasem.
W LSG wnikające przez nieszczelności jelita duże zbyt duże produkty strawionego pokarmu
(na ogół tylko niektórych rodzajów pokarmu) i toksyny bakteryjne już w obrębie tkanek jelita
rozpoznawane są jako „obcy”. Dla zduszenia inwazji w zarodku nasila się tzw. reakcja
miejscowa. Komórki odpornościowe, pierwszej linii wysyłają chemiczne sygnały
przyzywające towarzyszy broni. Inne ich sygnały rozszczelniają śródbłonki naczyń
krwionośnych jelita, by ułatwić dotarcie komórek dążących z odsieczą. Wszystkie te
działania, zwane odpowiedzią komórkową, są taktycznie uzasadnione, jednakże przez
gospodarza odczuwane jako stan zapalny jelita z wszystkimi jego konsekwencjami. Do akcji
włączane są kolejne komórki - plazmocyty produkujące „specjalistyczną” broń, przeciwciała
IgG, które jak drony, skuteczne nie tylko w miejscu wnikania intruzów – jelicie, ale wszędzie
tam gdzie zdołają dotrzeć z krwią. To istotne, gdyż intruzi, którzy pokonali pierwszą linię
obrony z krwią i limfą roznoszeni są po całym organizmie.
IgG posiadają cztery podklasy,oznaczane cyframi. Trzy z nich: IgG1-3, wzmagają stan
zapalny,stąd ich nazwa: przeciwciała IgG prozapalne. Czwarta podklasa: IgG4 takich
właściwości nie posiada. Zapalne - IgG1-3 w stosunkowo krótkim czasie po pierwszym
kontakcie układu odpornościowego z nowym antygenem, a natychmiast po kolejnym, wdają
się awanturę, potęgując ostry, miejscowy stan zapalny jelita. Krążące jak drony w całym
organizmie przeciwciała IgG4 uczestniczą w wydarzeniach przebiegających w miejscach
odległych od miejsca wniknięcia antygenu i nieco później. IgG4 wiążą napotkane antygeny,
tworząc z nimi krążące w dalszym ciągu kompleksy. Te kompleksy, jak wiemy powinny stać
się łatwym łupem makrofagów i rzeczywiście tak się dzieje. Niestety makrofagów jest zbyt
mało, dla stale przybywających kompleksów. Kompleksy osadzają się w różnych miejscach
organizmu, wywołując w nich kolejne stany zapalne. Zrozumiała jest więc tak szeroka gama
objawów: od zapalenia stawów do depresji. Jak w tkankach jelita, tak w pobliżu miejsc
osiedlenia kompleksów, stykające się z nimi makrofagi wydzielają sygnały alarmowe
przyzywające kolejne komórki odpornościowe. Osiadłe kompleksy aktywują kolejny czynnik
zapalenia – dopełniacz, aktywacji ulegają płytki krwi i białe krwinki, dochodzi do
rozszczelnienia śródbłonków naczyń. Zapalenie o nowej lokalizacji się nasila i przechodzi w
stan chroniczny. Ogniska zapalne tworzą się w miejscach na tyle niespodziewanych i w
czasie na tyle odległym od momentu uszkodzenia bariery jelitowej, że połączenie w całość
przyczyn i przebiegu procesu chorobowego jest trudne lub niemożliwe.
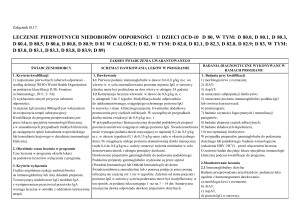
Diagnostyka
Szczęśliwie od pewnego czasu istnieją metody pozwalające na rozpoznawanie nietolerancji
pokarmowej zależnej od IgG i ustalenie czynników, który ją stymulują i opracowanie
postępowanie leczniczego i profilaktycznego – na przyszłość. Wspomniany na początku
Pasteur opracował dla chorób zakaźnych kilka postulatów, których spełnienie umożliwiało
identyfikację drobnoustroju jako czynnika wywołującego (patogenu) chorobę. W skrócie,
zarazek należało wyizolować, przenieść na kolejnego osobnika i sprawdzić, czy taki transfer
spowoduje identyczne objawy chorobowe. Oczywiście procedura dotyczyła wyłącznie
zwierząt laboratoryjnych.
Powiedzieliśmy, że czynnikiem wywołującym omawianą nietolerancję pokarmową są
przeciwciała IgG specyficzne dla niektórych nietypowych składników pokarmowych
(antygenów pokarmowych), a dokładniej nadmiar ich kompleksów z „macierzystymi”
antygenami, które osadzając się w różnych miejscach i powodują objawy zapalne. Jest więc
zupełnie logiczne, że dla ustalenia istnienia nietolerancji u pacjenta, należy stwierdzić, czy
jego krew zawiera takie swoiste przeciwciała. Badanie swoistości przeciwciał przeprowadza
się oceniając in vitro (w laboratorium) ich zdolność wiązania (reaktywność) ze składnikami
pokarmowymi. Do testu wybiera się najbardziej reprezentatywne składniki diety, lub takie, o
których wiadomo, że są często źle tolerowane. Układa się je w zestawy – panele, na tyle
liczne by przynajmniej statystycznie uwzględniały większość możliwych nietolerancji. Jest
oczywiste, że im panel większy, tym większa szansa, by wykazać pokarm nietolerowany i
jego bezpieczne, tolerowane zamienniki. Do tych celów wystarczają panele z ok. 90 lub 280
elementów. Krótsze sprawdzają się w oznaczeniach wstępnych. Dalsza procedura jest
prostsza niż sugerowana przez postulaty Pasteura. Zamiast przenosić czynnik choroby i
porównywać objawy, wystarczy z diety badanego wyeliminować pokarm indukujący IgG w
wysokich stężeniach, zastępując go tolerowanym (dieta eliminacyjna) lub ograniczyć jego
spożywanie (dieta rotacyjna). Potem należy już tylko obserwować zmiany nasilenia objawów
nietolerancji. Stosowanych jest kilka rodzajów testów diagnostycznych nietolerancji
pokarmowej: testy mierzące stężenie specyficznej IgG, uwzględniające wszystkie klasy
(czasami nazywane Total IgG) , testy oznaczające zapalne IgG (klasy 1 do 3) i testy
oznaczające IgG4. Testy mierzące swoiste IgG wydają się mieć zastosowanie w pierwszych
etapach rozwoju nietolerancji, którym towarzyszy ostry stan zapalny jelit, powiązany z
łatwymi do identyfikacji objawami w przewodzie pokarmowym. Testy takie dają bardzo
często wyniki nisko dodatnie, powodowane sporadycznymi „wpadkami” prawidłowo
działającej bariery jelitowej przepuszczającej nietypowe produkty trawienia. Dla
rozpoznawania trudnych przypadków nietolerancji pokarmowej, o objawach nie mających
pozornie nic wspólnego z przewodem pokarmowym, manifestujących się w czasie odległym
od momentu uszkodzenia jelit, optymalne wydaje się oznaczanie specyficznych IgG4. One
bowiem są składnikami kompleksów immunologicznych stymulujących stany zapalne w
odległych od jelita miejsca organizmu, a ich poziom nie wzrasta w trakcie słabej reakcji
systemu odpornościowego na sporadycznie przepuszczane antygeny. Porównania wyników
oznaczeń IgG i IgG4 dokonane w laboratorium Diagnostyki u tych samych osób,
potwierdzają dane z piśmiennictwa, mówiące o bardziej klarownych diagnostycznie obrazie
uzyskiwanym w oznaczeniach IgG4, gdzie przeważają wyniki zerowe i bardzo silnie dodanie.
Taki rozkład wyników i analiza mechanizmów prowadzących do nietolerancji pokarmowej
zależnej od IgG zdecydowanie przemawiają za większą przydatnością diagnostyczną
pomiarów IgG4.