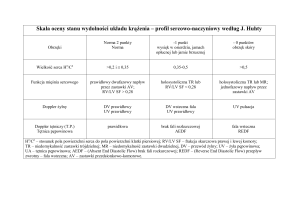
Kalcyfikacja (wapnienie) biomateriałów
Awarie niektórych implantów, w szczególności w układzie krwionośnym powodowane
są przez powstawanie sferoidalnych
osadówwarunki
fosforamu wapnia i innych soli wapnia.
Pozornie łagodne
Proces ten nazywany jest kalcyfikacją lub mineralizacją.
Proces mineralizacji przebiega naturalnie w organizmie np. w kościach, zębach itp. W
przypadku biomateriałów jest to zjawisko niekorzystne, gdyż może negatywnie
wpływać na funkcjonowanie wszczepionych elementów.
Przypadki kalcyfikacji mogą mieć charakter dystroficzny lub metastatyczny.
Kalcyfikacja dystroficzna polega na odkładaniu soli wapnia w miejscach zniszczonych
lub tkankach objętych chorobą lub u pacjentów z normalnym metabolizmem wapnia.
Kalcyfikacja metastatyczna polega na odkładaniu soli wapnia we wcześniej zdrowych
tkankach, jako rezultat zachwianego metabolizmu minerałów, zazwyczaj
zwiększonego poziomu wapnia we krwi.
Może występować efekt synergiczny, czyli połączenie kalcyfikacji dystroficznej i
metastatycznej. Odkładanie soli wapnia w uszkodzonych miejscach będzie
przebiegało szybciej w warunkach podwyższonego stężenia jonów wapnia.
Biomaterials Science An Introduction to Materials in Medicine Academic Press San Diego London Boston New York Sydney Tokyo Toronto
Przykłady materiałów ulegających kalcyfikacji
Kalcyfikacja dotyczy
syntetycznych
zarówno
materiałów
pochodzenia
naturalnego,
jak
i
Kalcyfikacja implantów
Zastawki serca
Zastawki serca pochodzenia zwierzęcego
glutarowym i dezaktywowane.
(świńskie, cielęce) sterylizowane aldehydem
Średni czas funkcjonowania 12-15 lat.
Operacyjnie usunięte zastawki wykazywały rozdarcia i sztywność spowodowane przez kalcyfikację
Kalcyfikacja implantów
Pompy krwi i sztuczne serce
Urządzenia te wykonane są najczęściej z poliuretanów
Wytrącanie się kryształów na wewnętrznej powierzchni materiału powoduje jego usztywnienie i
spadek sprawności pompy.
Zjawisko występuje niezależnie od rodzaju użytego poliuretanu w okolicach elementów ruchomych,
co wskazuje, że czynniki mechaniczne mają również znaczenie przy powstawaniu kryształów
Powstawanie kryształów związane jest najczęściej z zarodkowym działaniem mikropęknięć, które
mogły powstać w trakcie produkcji lub w wyniku działania urządzenia.
Kalcyfikacja implantów
Miękkie szkła kontaktowe
Miękkie soczewki kontaktowe wykonywane są z
poli(metakrylanu
2-hydroksyetylu)
(poliHEMA). Problem dotyczy również soczewek z innych
materiałów.
Krystalizacja fosforanu wapnia powoduje zmętnienie
soczewek. Kryształy rosną z upływem czasu i są praktycznie
nieusuwalne bez zniszczenia soczewek
Źródłem soli nieorganicznych są łzy.
http://www.nature.com/eye/journal/v17/n3/fig_tab/6700341f1.html#figure-title
Ocena procesu kalcyfikacji
Wykorzystywane są ocena morfologii i metody chemiczne
Każda z metod posiada pewne szczególne zalety, które razem mogą służyć do ogólnej oceny
struktury i składu krystalitów.
Metody chemiczne – ocena zawartości wapnia i fofsoru.
Stosuje się próbki w postaci sproszkowanej.
Wapń oznacza się metodą ASA (atomowa spektroskopia absorpcyjna), fosfor – najczęściej
technikami spektrofotometrycznymi.
Ocena procesu kalcyfikacji
Zdjęcia rentgenowskie – implant kładzie się na kliszy rentgenowskiej o poddaje naświetlaniu
promieniowaniem X. Obszary objęte kalcyfikacją są nieprzezroczyste i na zdjęciu wychodzą jako
białe plamy.
Mikroskop optyczny – identyfikacja minerału, często z zastosowaniem barwnika (czerwień
alizarynowa, odczynnik von Kossa)
Mikroskopia elektronowa – pozwala na identyfikację miejsc, gdzie zaczęła się krystalizacja.
Przyczyny kalcyfikacji
Mineralizacja martwych membran komórkowych – zawierają duże ilości forforanów obecnych w
ścianach komórkowych i kwasach nukleinowych.
Osadzanie białek zdolnych do wiązania jonów wapnia- mogą brać udział w inicjowaniu
powstawania kryształów
Naprężenia mechaniczne – mogą być przyczyną większej ilości zniszczonych komórek
Strategie zapobiegania kalcyfikacji
1.
2.
3.
Terapia systemowa z użyciem leków zapobiegających kalcyfikacji
Terapia lokalna z zastosowaniem implantowalnych systemów dozowania leków
Modyfikacja biomateriału
The anticalcium agent can be any pharmaceutically acceptable compound which inhibits calcification
in biological tissue. A number of such compounds are known, e.g., diphosphonate compounds such
as ethanehydroxydiphosphonate (EHDP) and aminopropanediphosphonate (APDP), described in
Kramsch et al., Circ. Res. 42: 562-571, 1978; calcium channel blockers such as nifedipine (Merck
Index 10th ed.-#9747) and verapamil (Merck Index 10th ed.-#6374) , described in Henry et al., J.
Clin. Invest. 68: 1366-1369, 1981; calcium chelating agents such as EDTA, described in Wartman et
al., J. Atheroscler. Res. 7: 331-341, 1967; ionic antagonists such as lanthanum trichloride, described
in Kramsch, id.; thiophene compounds, described in Kramsch, id.; and phosphocitrate analogues
such as 2-aminotricarballylate. The most preferred anticalcium agent is EHDP.
difosfoniany
Zastosowanie biomateriałów w medycynie i stomatologii
Zastawki
Sztuczne naczynia krwionośne
Kontrolowane dozowanie leków z udziałem polimerów
Stenty
Cewniki
Rozruszniki serca
Sztuczne serce
Preparaty zastępujące krew
Atrombogenne powierzchnie polimerów
Implanty i wypełnienia zębowe
Kleje do tkanek
Szkła kontaktowe
Nici chirurgiczne
Opatrunki na oparzenia
Zastawki serca
Zastawki – różnego typu błoniaste fałdy występujące głównie w układzie krwionośnym i limfatycznym;
warunkują jednokierunkowy przepływ krwi (na granicy przedsionków i komór serca, w ujściu aorty i pnia
płucnego, w żyłach lub naczyniach limfatycznych).
Sztuczne zastawki serca wykonuje się z materiałów metalicznych i tworzyw sztucznych. Są wszczepiane
do serca w przypadku nieodwracalnych zmian zastawek naturalnych. Stosowane są także zastawki z
materiałów pochodzenia biologicznego.
Wykonane są najczęściej z elastomerów silikonowych, stopów
kobaltowo-chromowych, tytanu, węgla pirolitycznego
(materiału o strukturze grafitu posiadającego wiązania
chemiczne pomiędzy warstwami), teflon, Dacron (PET),
Element ruchomy reaguje pasywnie na zmiany ciśnienia i
przepływ krwi.
Figure 1: Types of heart valves (first and second row: historic
mechanical valves; third row: tissue valve (swine, bovine); fourth
row: actual mechanical valve)
http://pl.wikipedia.org/wiki/Zastawki
Różne typy konstrukcji sztucznych zastawek
„kulka w klatce” – krew opływa kulkę, kulka powoduje duże opory przepływu,
organiczona aktywność pacjenta z implantem, duża objętość, niezawodność
działania (do 20 lat).
„rozchylane drzwi”
„odchylana płytka”
Mechaniczne zastawki są bardzo trwałe, ale istnieje ryzyko powstawania skrzepów (ryzyko udaru),
należy stosować leki antyzakrzepowe.
Zastawki pochodzenia zwierzęcego – sterylizowane aldehydem
glutarowym i dezaktywowane, aby system immunologiczny
ich nie atakował, nie powodują ryzyka zakrzepów.
http://www.scientificamerican.com/slideshow.cfm?id=artificial-heart-valves&photo_id=D4F0E1B9-086C-4563-7440E815DE5AC18A
Różne typy konstrukcji sztucznych zastawek
„zastawki wmontowane w stent” – pozwalają na wprowadzenie zastawki bez
operacji na otwartym sercu..
„pierścienie korygujące” – zmiana geometrii naturalnej zastawki może
poprawić jej dotykalność.
http://www.scientificamerican.com/slideshow.cfm?id=artificial-heart-valves&photo_id=D4F0E1B9-086C-4563-7440E815DE5AC18A
Wymagania stawiane sztucznym zastawkom serca
1.
Szybkie działanie – zapobiegające cofaniu się krwi
podczas zamykania zastawki
2.
Minimalne opory przepływu przy otwartej zastawce.
(optymalizacja kształtu, zapobieganie turbulencjom
i
naprężeniom
ścinającym).
Konieczność
stosowania cieńszych „skrzydełek” o większej
wytrzymałości
3.
Atrombogenność. Skrzepy, poza zagrożeniem,
jakie stanowią mogą również być siedliskiem
bakterii i źródłem zakażeń. Zastosowanie
materiałów polimerowych mogłoby zlikwidować
konieczność stosowania leków antyzakrzepowych.
Podejmowane są próby wyhodowania zastawek
serca z własnych komórek pacjenta.
4. Zdolność do samonaprawy
rozwiązania nie istnieją.
–
obecnie
takie
Proces produkcyjny
Materiały: tytan, grafit, wegiel pirolityczny, poliestry.
Tytan – obudowa lub pierścień zewnętrzny.
Tytan pokryty grafitem lub węglem pirolitycznym – ruchome skrzydełka
zastawki.
100% węgiel pirolityczny – wewnętrzny (mający kontakt z krwią) pierścień.
Poliester – zewnętrzna warstwa tkaniny służąca do łatwego wszycia
zastawki do serca
Węgiel pirolityczny często impregnuje się wolframem aby elementy były
dobrze widoczne przy implantacji.
Tytan jest używany ze względu na swoją wytrzymałość i biokompatybilność.
Pokrycia z węgla pirolitycznego otrzymuje się przez osadzanie gazowych
węglowodorów (metanu) na powierzchni ogrzewanego grafitu w
temperaturze 1800-2300C. Większe elementy otrzymuje się z węgla
pirolitycznego otrzymywanego w procesie fluidalnym.
http://www.madehow.com/Volume-6/Artificial-Heart-Valve.html
Proces produkcyjny
1.
Elementy tytanowe i węglowe są zamawiane u wytwórców i w razie konieczności polerowane.
Mankiet zewnętrzny tka się z nici poliestrowych.
2.
Montaż odbywa się w „clean room’ach” aby uniknąć zanieczyszczenia.. Skrzydełka łączy się
Z pierścieniem wewnętrznym, który następnie umieszcza się w pierścieniu zewnętrznym.
3.
Kształt mankietu nadaje się w procesie formowania ciśnieniowego, podczas którego tkanina
jest ogrzewana do wysokich temperatur (kilkaset stopni).
4.
Testowanie działania
5.
Sterylizacja parą wodną (132°C) pod ciśnieniem przez minimum 15 minut. Opakowanie
zawiera wskaźnik biologiczny, który informuje o ewentualnym wzroście bakterii itp.
6. Pakowanie
Sztuczne naczynia krwionośne
Główna przyczyna stosowania – choroby układu krążenia
Główne zadanie sztucznych naczyń krwionośnych – przywrócenie krążenia krwi.
Przewaga materiałów sztucznych nad naturalnymi – nie ma konieczności wykonywania dwóch
operacji chirurgicznych.
Główną trudnością w zastosowaniu tworzyw sztucznych
jako protez naczyń krwionośnych jest powstawanie
skrzepów w kontakcie krwi z protezą. Do dzisiaj nie
udało się otrzymać tworzywa, które trwale i całkowicie
nie powodowałoby krzepnięcia krwi.
Prowadzone są badania nad poprawą biozgodności
protez z krwią, które polegają na modyfikacji ich
powierzchni za pomocą warstewki polimerów
syntetycznych, zawierających odpowiednie grupy
funkcyjne lub tez poprzez pokrycie hydrożelem.
Najczęściej stosowanymi materiałami są liniowe
nasycone polimery (np. poli(tereftalan) etylenu oraz
poli(tetrafluoroetylen)). Zwykle protezy te wytwarzane
są w postaci dzianin, rzadziej tkanin.
Dacron (PET) i expandowany ePTFE stosowane są
najszerzej. Nadają się na sztuczne naczynia o dużej
średnicy (>6mm) o szybkim przepływie krwi.
W mniejszych naczyniach często dochodzi do
powstawania skrzepów.
Szuczne naczynie wymuszające ruch
spiralny krwi – mniejsze zużycie
materiału, większy prawdopodobieństwo
samooczyszczenia w przypadku
zatykania.
Compliant poly(carbonate-urea)urethane serves
as an elastic scaffold that gives the artificial graft
its shape. (Credit: Courtesy S. Tawqeer Rashid)
http://www.tworzywasztuczne.yoyo.pl/zastosowanie.html#protezy_naczyn
Właściwości idealnego sztucznego naczynia
krwionośnego
wytrzymałe
biozgodne
odporne na zginanie i skręcanie
łatwo zszywalne
nietoksyczne
nie wywołujące odpowiedzi immunologicznej
atrombogenne
Łatwe do produkcji w różnych długościach
O niskich kosztach produkcji
Tissue engineering of blood vessels
Naczynia krwionośne otrzymywane z wykorzystaniem inżynierii tkankowej
http://gupea.ub.gu.se/dspace/bitstream/2077/21217/1/gupea_2077_21217_1.pdf
Stenty
Stent niewielki element w kształcie rurki umieszczany wewnątrz naczynia w celu
jego udrożnienia. Najbardziej popularne są stenty naczyń krwionośnych, układu
moczowego i oddechowego.
http://www.akinainc.com/images/ustent-scheme.jpg, mycardiacwebsite.com, drsvenkatesan.wordpress.com
Aplikacja Stentów
Metoda z balonikiem
http://www.medgadget.com/archives/img/abbottstent.jpg
introtoccnursing.com, balton.pl
Aplikacja stentów
Stenty samorozprężalne
Nitinol – pamięć kształtu, aby rozprężenie
stentu nie następowało zbyt szybko, przed
aplikację się go chłodzi.
http://www.c2i2.org/autumn2004/gallery/Lomb-Fig-2(a-b-c-d).jpg
Stenty
Restenoza
Restenoza – zjawisko obserwowane niekiedy po zabiegach wszczepienia stentu polegające na
nawrocie zwężenia leczonej tętnicy.
Rozprężenie balonu (angioplastyka balonowa) lub implantacja stentu wewnątrznaczyniowego
powoduje uszkodzenie ściany tętnicy i wyzwala z jej strony naturalną odpowiedź fizjologiczną, czyli
gojenie. W części przypadków proces gojenia przebiega jednak nadmiernie.
http://blogs.wsj.com/health/2007/07/17/jj-stent-sales-plummet/
http://www.evgn.org/home/imagesnew/stentv2web.jpg
http://pl.wikipedia.org/wiki/Restenoza
Stenty
Restenoza, stenty uwalniające leki, stenty biodegradowalne
Sirolimus
Paclitaxel
Rozruszniki (stymulatory) serca
Rozrusznik serca – skomplikowane urządzenie
elektroniczne służące do elektrycznego pobudzania
rytmu
serca,
umożliwiające
programowanie
częstotliwości rytmu, napięcie i czas trwania impulsu.
Urządzenie stymulujące serce składa się z generatora
impulsów (stymulatora) posiadającego hermetycznie
zamknięte w obudowie z materiałów biologicznie
obojętnych (pudełko tytanowe) baterie i moduł
eketroniczny. Jest ono wszczepiane pod skórę.
Stymulator
jest
jednocześnie
detektorem
i
generatorem impulsów elektrycznych. Impulsy mają
napięcie rzędu 0,5–5 woltów i czas trwania ok. 0,2–1
milisekundy. W mięśniach serca umieszczane są
metalowe elektrody (od 2 do 4) pokryte tworzywem
sztucznym (najczęściej poliuretanem na bazie MDI i
butanodiolu). Na ich zakończeniach znajdują się
zwykle wypustki, umożliwiające zakotwiczenie ich w
odpowiednim miejscu.
Miejsce stymulacji: przedsionek, komora, obie jamy
Odczyt potencjału: przedsionek , komora, obie jamy
Sposób odpowiedzi: stymulacja, hamowanie, oba typy
Możliwość adaptacji stymulacji np. do wysiłku
http://www.odec.ca/projects/2007/torr7m2/images/pacemaker.gif
A. Szczeklik Choroby Wewnętrzne, Medycyna Praktyczna, Kraków 2005
Rozruszniki (stymulatory) serca
Generator impulsów posiada hermetycznie zamknięte
baterie i moduł elektroniczny. Zwykle zamknięty jest w
pojemniku tytanowym wszczepionym pod skórą.
Elektrody wykonane są z platyny, srebra, tytanu stali
nierdzewnej lub stopów kobaltu.
Większość rozruszników zawiera baterie litowe.
Żywotność baterii wynosi ok. 6-8 lat
Przewody muszą być wytrzymałe, elastyczne, nie
korodować i być dobrym przewodnikiem. Muszą
wytrzymać ok.30-40 milionów zgięć na rok. wykonane
są z poliuretanów na podstawie MDI i 1,4-butanodiolu,
przewód najczęściej wykonany jest z tytanu.
Poliuretany – duża wytrzymałość mechaniczna
pozwalająca na użycie cieńszych izolacji i cieńszych
przewodów.
Opis zabiegu – Przy znieczuleniu miejscowym
elektrody wprowadza się przez żyłę dogłowową lub
podobojczykową, a następnie do serca. W czasie
zabiegu dokonuje się pomiaru sygnału uzyskanego z
elektrody, oporności i progu stymulacji.
Stymulator zwykle nie powoduje problemów, bo
jest umieszczony poza krwioobiegiem. Natomiast
przewody mogą powodować powstawanie
skrzepów. Mogą ulegać również degradacji, jeśli
wykonane są z poliuretanu. Przewody izolowane
silikonem nie ulegają degradacji.
Stymulator wszczepia się najczęściej poniżej lewego
obojczyka.
Wymaga kontroli co najmniej raz w roku.
http://www.heart.org.in/diseases/images/pacemaker.jpg
http://mykentuckyheart.com/images/pictures/pacemaker.jpg
http://www.odec.ca/projects/2007/torr7m2/images/pacemaker.gif
A. Szczeklik Choroby Wewnętrzne, Medycyna Praktyczna, Kraków 2005
Sztuczne serce
Masa 300-350g
Objętość 300 cm3
2,5 litra krwi/min/m2 (powierzchnia ciała)
100 000 uderzeń na dobę
Serce składa się układu 2 pomp. Przez prawy
przedsionek i komorę krew kierowana jest w
celu natlenienia do płuc. Przez lewą część serca
natleniona krew rozsyłana jest po organizmie.
Wymagania:
Musi zapewnić dobrą cyrkulację i natlenienie
krwi.
Musi bezobsługowo i bez smarowania
zapewnić ok. 100000 uderzeń na dobę.
Musi posiadać stabilne źródło zasilania.
Musi dostosowywać się do aktywności
organizmu.
Nie może powodować infekcji, czy krzepnięcia
krwi.
Istnieją dwa typy urządzeń :
płuco-serce (służy zwykle do przejęcia funkcji
natleniania i pompowania krwi w czasie
operacji). Może pracować maksymalnie przez
kilka godzin, gdyż krew ulega zniszczeniu.
mechaniczne sztuczne serce – zastępuje
serce
w oczekiwaniu na przeszczep
http://knowledge.allianz.com/nopi_downloads/images/artificial_heart_q.jpg
Kiedy stosuje się sztuczne serce:
1. W przypadku całkowitego uszkodzenia serca
2. Przy prognozowanym czasie życia do 30 dni.
3. Przy braku możliwości transplantacji
4. Przy braku innych mozliwości leczenia
http://www.syncardia.com/images/stories/pressreleases/theartificialandhumanheartssm1.jpg
http://www.madehow.com/Volume-6/Artificial-Heart.html
Sztuczne serce
Materiały: metal, tworzywa sztuczne, ceramika, tkanki
zwierzęce
Części metalowe wykonane są ze stopu tytanu,
aluminium i wanadu ze względu na biokompatybilność i
odpowiednie właściwości strukturalne.
Części mające kontakt z krwią pokryte są tytanowymi
mikrosferami związanymi na skałę z powierzchnią.
Komórki krwi mogą się na nich adsorbować stanowiąc
naturalną warstwę na powierzchni materiału.
Membrany mające kontakt z krwią wykonane są z
poliuretanu, którego powierzchnia również posiada
odpowiednią teksturę, która pozwala na przyleganie
komórek krwi.
Elementy służące do przyłączenia do naczyń
krwionośnych wykonane są z poliestru.
Zastawki serca najczęściej są pochodzenia
zwierzęcego.
Części silnika wykonane są z tytanu i innych metali
oraz ceramiki
http://www.texasheart.org/Research/Devices/abiocor.cfm
http://1.bp.blogspot.com/_Lr1zER5zo3k/SQiLAL8qDJI/AAAAAAAAEA0/NsMXzT3P2yE/s200/heart_1_421062a2.jpg
Sztuczne serce
Pompy wspomagające pracę serca
„Booster pump”
Tego typu urządzenia nie zachowują się jak naturalny
organ (nie „biją”). Posiadają obracający się rotor, który
przepompowuje krew z lewej komory do aorty.
Naturalne serce pracuje w tym czasie normalnie. Ilość
krwi przemieszczana prze obracający się rotor jest
dopasowana do rytmu serca (maleje i rośnie
synchronicznie).
Pompy wspomagające pracę serca zwiększają wyrzut
krwi z serca. Urządzenie wspomaga pracę serca bez
zakłócania jego pracy i stabilizują ciśnienie krwi.
Urządzenie jest sterowane ręcznie. Sterowanie
odbywa się przez zmianę obrotów rotora.
http://emsstaff.buncombecounty.org/inhousetraining/jarvik/jarvik_overview.htm
Powierzchnie atrombogenne
Procesy zachodzące na powierzchni materiału
po umieszczeniu we krwi:
1. Adhezja białek
2. Adhezja i aktywacja płytek krwi
3. Tworzenie skrzepu
Powierzchnie atrombogenne potrzebne są wszędzie tam, gdzie powierzchnia wyrobów z tworzyw
sztucznych, metali (trwałe lub czasowe implanty, klapki sztucznych zastawek dosercowych,
powierzchnie drenów i cewników angioplastycznych, pojemniki do przechowywania krwi) przez pewien
czas kontaktuje się z krwią.
Koagulacja krwi jest spowolniona, gdy obecne są dekstryny, pochodne poli(tlenku etylenu), pochodne
alkilowe perfluorowane i heparyna .
Własności atrombogenne powierzchni czyli brak adhezji erytrocytów są wyznaczane nie tylko przez
brak specyficznych oddziaływań pomiędzy substratem a komórką erytrocytu (ang. key-lock forces) ale
też przez pewną mobilność substratu i komórki - rodzaj falowania, które pozwala na pokonanie
oddziaływań
http://www.chem.uni.torun.pl/FIZ/ChemZM/MTiP/MTiPI/monowarstwy.pdf
Powierzchnie atrombogenne
PEO
Zwiększenie hydrofilowości powierzchni (zastosowane poli(tlenku etylenu) PEO)
- Rozpuszczalny w wodzie
- Duża elastyczność łańcuchów
- Duży promień hydrodynamiczny (możliwość odpychania biocząsteczek od powierzchni)
- Możliwość modyfikacji na końcach łańcucha cząsteczkami o działaniu antyzakrzepowym.
HEPARYNA
Heparyna zapobiega tworzeniu zakrzepów przez tworzenie
kompleksu z atrombiną III (ATIII) oraz katalizą neutralizacji trombiny
przez ATIII, co zapobiega przekształceniu fibrynogenu w fibrynę:
a) Heparyna wiąże ATIII zwiększając prawdopodobieństwo
przyłączenia trombiny
b) Heparyna wiąże się z trombiną przed przyłączeniem ATIII
c) Łączenie następuje jednocześnie
Obecnie istnieje wiele rozwiązań polegających na wprowadzeniu
heparyny na powierzchnię biomateriału.
Powierzchnie atrombogenne
Heparyna
Heparyna – polisacharyd zbudowany z około 80 pochodnych glukozy i kwasu
glukuronowego, połączonych w nierozgałęziony łańcuch. Cząsteczka ma
ładunek ujemny.
– systemy uwalniające heparynę
– powierzchnie zawierające immobilizowaną heparynę
– kopolimery heparyny
A - jonowe wiązanie do dodatnio
naładowanej powierzchni
B - heparyna jonowo związana z
dodatnio naładowanym żelem na
powierzchni polimeru
C - polimer zwierający
zdyspergowaną heparynę
(mechanizm dyfuzyjny)
D – powierzchnia z
termoresponsywnym hydrożelem
zawierającym heparynę
E – kompleks heparyny z
polikationem – rozpad pod wpływem
pola elektrycznego
http://pl.wikipedia.org/w/index.php?title=Plik:Heparin-2D-skeletal.png&filetimestamp=20070124180106
Powierzchnie atrombogenne
Systemy uwalniające heparynę
Ilość heparyny w polimerze ograniczona – ograniczony czas użycia materiału,
zwykle do kilku – kilkunastu godzin
Powierzchnie atrombogenne
Heparyna immobilizowana na polimerze
Ilość heparyny w polimerze stała – wiązanie kowalencyjne z wykorzystaniem
grup karboksylowych lub hydroksylowych. Reakcja na powierzchni polimeru
poliuretany
Powierzchnie atrombogenne
Heparyna immobilizowana na polimerze
Rozpuszczalne polimery triblokowe zawierające immobilizowaną heparynę
1. Łatwiejsza synteza na dużą skalę
2. Możliwość pokrywania istniejących urządzeń
Powierzchnie atrombogenne
Tlenek azotu
Diolany diazoniowe
Kontrolowane dozowanie leków z udziałem polimerów
Zmiany stężenia leku po dawce jednorazowej,
Dawka toksyczna
System kontrolowanego uwalniania leku
http://www.pharmainfo.net/raghanaveen/biodegradable-polymers-controlled-drug-delivery
Biomaterials Science An Introduction to Materials in Medicine Academic Press San Diego London Boston New York Sydney Tokyo Toronto
Kontrolowane dozowanie leków z udziałem polimerów
Zalety i wady
1.
Czynnik terapeutyczny może być uwalniany przez długi czas na stałym poziomie
2.
Większa efektywność podawania leku
3.
Mniejsze prawdopodobieństwo podania za małej lub za dużej dawki
4.
Większa kontrola stężenia leku
5.
Dłuższy czas pomiędzy przyjmowaniem leku
6.
Większa kontrola nad pacjentem
1.
Możliwa toksyczność lub brak biokompatybilności użytych materiałów
2.
Możliwość pojawienia się niespodziewanych produktów degradacji
3.
Możliwa operacja chirurgiczna w celu wszczepienia urządzenia
4.
Możliwy dyskomfort pacjenta z powodu obecności urządzenia
5.
Większy koszt wytworzenia w stosunku do tradycyjnych farmaceutyków
Klasyfikacja systemów kontrolowanego dozowania leków
Trzy główne mechanizmy:
1.
2.
3.
dyfuzja,
pęcznienie połączone z dyfuzją,
degradacja
Biomaterials Science An Introduction to Materials in Medicine Academic Press San Diego London Boston New York Sydney Tokyo Toronto
Systemy dozowania leków kontrolowane dyfuzyjnie
Monolityczne – substancja aktywna rozproszona jest w
matrycy polimerowej.
Szybkość jej uwalniania jest uzależniona od szybkości dyfuzji
z matrycy.
Substancja aktywna może być rozpuszczalna w matrycy lub
nierozpuszczalna (zdyspergowana w matrycy). Szybkości
dyfuzji w obu przypadkach są różne.
Dyfuzja może następować na skalę makroskopową, gdy
polimer ma strukturę porowatą lub na poziomie molekularnym,
gdy cząsteczki leku dyfundują pomiędzy łańcuchami
polimerowymi
Systemy takie charakteryzują się spadkiem szybkości
uwalniania w czasie, ze względu na to, że cząsteczki leku
umieszczone głębiej mają dłuższą drogę do pokonania przed
opuszczeniem matrycy.
http://www.pharmainfo.net/raghanaveen/biodegradable-polymers-controlled-drug-delivery
Systemy dozowania leków kontrolowane dyfuzyjnie
Membranowe – substancja aktywna znajduje się w
cienkiej otoczce polimerowej.
Szybkość jego uwalniania zależy od szybkości dyfuzji
przez tę membranę polimerową.
Membrana może być lita lub porowata.
Szybkość uwalniania leków w takich systemach jest z
reguły stała. Wewnątrz matrycy lek znajduje się w postaci
stałej, stężonego roztworu lub rozcieńczonego roztworu.
Ponieważ membrana ma zwykle jednolitą grubość i nie
zmienia swoich wymiarów szybkość dyfuzji pozostaje
stała. Elementy kuliste stosowane są zwykle w doustnych
systemach podawania leków, płaskie zaś w przypadku
systemów transdermalnych.
http://www.pharmainfo.net/raghanaveen/biodegradable-polymers-controlled-drug-delivery
Systemy dozowania leków kontrolowane dyfuzyjnie
Membranowe - przykłady
Podawanie leku przez skórę
Leczenie jaskry
Aby lek dotarł do organizmu musi dyfundować
przez warstwy skóry
Biomaterials Science An Introduction to Materials in Medicine Academic Press San Diego London Boston New York Sydney Tokyo Toronto
http://www.pharmainfo.net/raghanaveen/biodegradable-polymers-controlled-drug-delivery
Systemy dozowania leków kontrolowane szybkością penetracji wody
Pompy osmotyczne
Pompy osmotyczne posiadają półprzepuszczalne membrany,
przez które woda może być wciągana do środka. Przyczyną
pojawienia się ciśnienia osmotycznego jest różnica stężeń
związków chemicznych lub jonów w roztworach po obu stronach
membrany i dążenie układu do ich wyrównania.
Zwiększenie objętości fazy wodnej powoduje wypchnięcie
substancji aktywnej na zewnątrz urządzenia.
http://images.pennnet.com/articles/ils/thm/th_0709ilspill01.gif
Systemy dozowania leków kontrolowane szybkością penetracji wody
Urządzenia kontrolowane szybkością pęcznienia
Systemy takie wykorzystują polimery, które pęcznieją bez
rozpuszczania po umieszczeniu w wodzie lub płynach
ustrojowych (hydrożele).
Pęcznieniu może ulegać cała matryca polimerowa lub tylko
membrana wokół rezerwuaru zawierającego lek.
Typowo po spęcznieniu układ składa się w 60-90% z wody (3010% polimeru).
Polimery tego typu mogą również być wrażliwe na bodźce
zewnętrzne (pH, temperatura itp.)
Zapewnienie stałej szybkości dozowania
Biomaterials Science An Introduction to Materials in Medicine Academic Press San Diego London Boston New York Sydney Tokyo Toronto
http://www.pharmainfo.net/raghanaveen/biodegradable-polymers-controlled-drug-delivery
http://images.pennnet.com/articles/ils/thm/th_0709ilspill01.gif
Systemy dozowania leków kontrolowane chemicznie
Mechanizmy uwalniania leku
Mechanizm A czynnik aktywny jest związany chemicznie z łańcuchem głównym polimeru
biodegradowalnego. Jego uwolnienie następuje najczęściej w wyniku hydrolizy wiązania A. Reaktywność
wiążąń B musi być odpowiednio mniejsza, aby fragmenty polimeru nie były uwalniane do organizmu.
Mechanizm B – czynnik aktywny znajduje się w przestrzeniu zamkniętej biodegradowalną membraną,
która limituje szybkość dozowania, a następnie ulega biodegradacji
Biomaterials Science An Introduction to Materials in Medicine Academic Press San Diego London Boston New York Sydney Tokyo Toronto
http://www.pharmainfo.net/raghanaveen/biodegradable-polymers-controlled-drug-delivery
Systemy dozowania leków kontrolowane chemicznie
Mechanizmy uwalniania leku
Mechanizm C – czynnik aktywny jest zdyspergowany w biodegradowalnym polimerze. Szybkość jego
uwalniania może być kontrolowana w wyniku dyfuzji, degradacji (erozji) lub połączenia oby tych
procesów.
Polimer może degradować powierzchniowo lub w masie.
Biomaterials Science An Introduction to Materials in Medicine Academic Press San Diego London Boston New York Sydney Tokyo Toronto
http://www.pharmainfo.net/raghanaveen/biodegradable-polymers-controlled-drug-delivery
Systemy dozowania leków kontrolowane chemicznie
Leki chemicznie związane z łańcuchem polimerowym
1.
Układ polimer – lek jest nierozpuszczalny w wodzie i może np. stosowany jako implant
domięśniowy
2.
Układ polimer – lek jest rozpuszczalny w wodzie i można go wykorzystać w systemach zdolnych
do rozpoznawania miejsc zmienionych chorobowo. Zwykle zawiera on również elementy
receptorowe, które pozwalają na rozpoznanie np. komórek rakowych.
Biomaterials Science An Introduction to Materials in Medicine Academic Press San Diego London Boston New York Sydney Tokyo Toronto
http://www.pharmj.com/Editorial/19990904/education/parenteral2.html
http://www.nae.edu/File.aspx?ID=7809