fizyka sciaga.doc
(3792 KB) Pobierz
Ogólna charakterystyka jądra atomowego- prawie całą masa atomu jest jego dodatni ładunek skupione są w wewnętrznej części atomu ( jądra atomu ) o promieniu 10 -14 do
10-15 m mniejszym około 10 tyś razy od atomu jako całość. Jądro składa się z nukleonów ( protonów i neutronów ) mp=1,6*10-27kg, mn =1,6*10-27kg. Z-liczba protonów jądrze, Nliczba neutronów
A=Z+N- liczba masowa jądra. Izotopy-odmiany tego samego pierwiastka o stałej wartości liczny Z i różnej wartości N.
Ładunek jądra- można określić na podstawie analizy rozpraszana cząsteczek a cząsteczek polu kulombowskim. Można też otrzymać ze wzoru Moseleya E=hn
Masa jądra - określane są w spektrometrach masowych.Zwykle w oparciu o metodę odchylania masy jonów danego pierwiastka w polu magnetycznym i elektrycznym.
Rozmiar jąder – określa się z oddziaływani magnetycznych ładunku elektrycznego elektrycznego bombardującego go cząstkami naładowanymi lub korzystając z oddziaływani
jądrowych –promień jądra R=ro A1/3 (A- liczba masowa)
Spin jądra- moment pędu jądra dookoła własnej osi. Równ się on sumie spinó nukleonó wchodzących w skład jadra. Liczbie kwantowej odpowiada moment pędu.
Moment magnetyczny
Energia wiązania nukleonów- energia jaką trzeba dostarczyć aby usunąć okresloną liczbę nukleonów jądra bądź jaką się otrzymuje podczas ich przyłączania
DE=Dmc2
Dm=(∑m p+∑mn )-Mj -- defekt masy
Reaktor jądrowy
Reakcje jądrowe- jest to proces oddziaływania między atomem a cząstką elementarną lub innym atomem prowadzący do przemiany jądra lub jąder. Trzeba uwzględnić w tych
reakcjach zależność między masą i energią.
X+x→ Y+y---------X-jądro poddane bombardowaniu, x-cząsta bombardująca, Y-jądro końcowe, y- cząstka emitowana w wyniku reakcji.
Przykład
Li + 11H→48Be→24He+24He,,,
ROZPAD
Promieniowanie (przemiana) ßDo przemiany tej dochodzi, kiedy jądra atomowe posiadają nadwyżkę neutronów nad protonami. Następuje przemiana neutronu w proton i wypromieniowany zostaje elektron.
Emisja elektronu z jądra, z przemianą neutronu w proton powoduje zmianę liczby atomowej (Z), podwyższając ją o 1 przy zachowaniu tej samej liczby masowej (A).
3
7
Promieniowanie ß+
Tę przemianę stwierdzono tylko w przemianach sztucznych izotopów promieniotwórczych. Jeżeli istnieje w jądrze atomowym nadwyżka protonów nad neutronami wówczas
zostaje wypromieniowany pozyton.
Powstający pierwiastek posiada obniżoną o 1 liczbę atomową (Z) i nie zmieniona liczba masowa (A).
Czynnikiem decydującym o trwałości jądra jest jego masa. U większości jąder, których liczba masowa jest większa lub równa 210 dochodzi do promieniowania alfa.
W przemianie tej oddziela się od jądra cząstka
. Emisje cząsteczki alfa prowadzi do zmiejszenia liczby atomowej (Z) o 2 jednostki, a liczby masowej (A) o 4 jednostki.
Kiedy przy przemianie pierwiastka promieniotwórczego powstaje ponownie pierwiastek promieniotwórczy, to ma miejsce kolejna przemiana.
Wiekszość pierwiastków promieniotwórczych w przyrodzie zaliczyć można do trzech szeregów promieniotwórczych:
1. szereg uranowo-radowy, wywodzący się od izotopu uranu 23892U
2. szereg torowy, wywodzący się od izotopu toru 23290Th
3. szereg uranowo-aktynowy, wywodzący się od izotopu uranu 23592U
Każdy z tych szeregów zakończony jest jednym ze stabilnych izotopów ołowiu. Dla każdego pierwiastka promieniotwórczego charakterystyczny jest tzw. okres półtrwania (t0,5),
okres czasu po którym ulegnie rozpadowi połowa jądra danego izotopu.
BUDOWA JĄDRA ATOMOWEGO
Jądro atomowe otaczają elektrony, poruszające się w przestrzeni kulistej o promieniu ok. 10 -9 cm. Liczba elektronów jest równa ładunkowi jądra (liczbie atomowej), ale tylko w
atomie obojętnym.
Elektron posiada właściwości korpuskularne (jest cząstką materii o określonej masie) i falowe (może zachowywać się, jakby był falą). Strukturą elektronową atomów i
cząsteczek zajmuje się teoria kwantowa, która opiera się na zasadzie nieoznaczoności Heisenberga: nie można równocześnie określić dokładnie położenia i pędu elektronu.
Teoria ta pozwala na określenie prawdopodobieństwa znalezienia elektronu w danym obszarze.
Elektron nie krąży po torach wokół jądra, można go znaleść w przestrzeni otaczającej jądro. Najmniejszy obszar przestrzeni charakteryzujący się dużym prawdopodobieństwem
znalezienia elektronu nosi nazwę orbitalu atomowego.
Dla oznaczenia funkcji falowej (orbitalu), która odpowiada określonemu stanowi energetycznemu elektronu w atomie podaje się cztery liczby kwantowe:
Główna liczba kwantowa (n) przyjmuje wartości kolejnych liczb naturalnych 1, 2, 3... (wg Bohra K, L, M...). Od niej zależy energia danego elektronu. W miarę oddalnia się
elektronu od jądra jego energia rośnie. W odległości nieskończenie wielkiej równa jest zeru.
E = - 1/n2 * E1
gdzie:
n - główna liczba kwantowa
E1 - bezwzględna wartość elektronu wodoru w stanie podstawowym (13,6 eV)
Oprócz stanu podstawowego, o najniższej energii elektron może występować w stanie wzburzonym, do którego przychodzi poprzez doprowadzenie energii z zewnątrz.
Główna liczba kwantowa decyduje o rozmiarach orbitalu - im większa wartość n, tym większy jest orbital.
Zbiór wszystkich stanów kwantowych (elektronów) o tej samej wartości głównej liczby kwantowej tworzą tę samą powłokę elektronową atomu. Maksymalna ilość elektronów w
powłoce wynosi 2 n2.
Poboczna liczba kwantowa (l) przyjmuje wartości liczb całkowitych od 0 do n-1 włącznie.
Precyzuje dokładnie stan energetyczny danej powłoki. Od niej zależy moment pędu elektronu i kształt orbitalu.
Jeżeli n=4 to
1=0 s
1=1 p
1=2 d
1=3 f
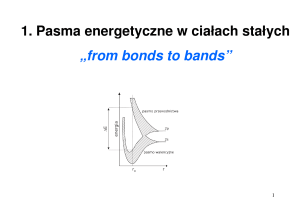
Wszystkie orbitale s są kulisto-symetryczne. (rysunek poniżej)
Trzy orbitale p mają kształt hantli (ósemek). Kształty przestrzenne pięciu orbitali d i siedmiu orbitali f są skomplikowane.
Zbiór stanów kwantowych o tych samych wartościach n i l stanowi tę samą podpowłokę elektronową. Liczba stanów kwantowych wyraża się wzorem 4l +
2.
Magnetyczna liczba kwantowa (m) przyjmuje wartości liczb całkowitych, takich że:
Określa rzut moment pędu na wyrózniony kierunek, decyduje o wzajemnym ułożeniu orbitali w przestrzeni. Wartość tej liczby mówi równocześnie o liczbie orbitali w danej
podpowłoce.
Jeżeli :
1=0 to m=0 i dlatego istnieje jeden orbital kulisty S
1=0 to m przyjmuje wartość - 1,0, +1 i dlatego istnieją trzy orbitale p. Ich nazwy są określane według osi, na której znajduje się przestrzeń największego prawdopodobieństwa
występowania elektronów.
1=2 to m przyjmuje wartość -2,-1,0, +1,+2 i dlatego podpowłoka d składa się z pięciu orbitali
1=3 to m przyjmuje wartość -3, -2, -1, 0, 1, 2, 3 i dlatego podpowłoka f posiada siedem orbitali
Zbiór stanów kwantowych o tych samych wartościach n,1,m znajdują się na tym samym poziomie orbitalnym. Każda podpowłoka zawiera 2l +1 poziomów orbitalnych.
Magnetyczna spinowa liczba kwantowa (ms) charakteryzuje rzut spinu na wyróżniony kierunek w przestrzeni. Moża przyjmować tylko dwie wartości: +1/2 lub -1/2 i dlatego
określa liczbę stanów kwantowych w poziomie orbitalnym.
Przy opisie stanu kwantowego elektronu pomija się piątą liczbę kwantową, zwaną spinową liczbą kwantową (s), gdyż wszystkie elektrony mają identyczną wartość spinowej
liczby kwantowej (s=1/2)
Powyższe rozważania dotyczyły stanu podstawowego i wzbudzonego w atomie wodoru. W atomach wieloelektronowych należy rozpatrywać nie tylko siły elektrostatycznego
przyciągania elektronu przez jądro, jak ma to miejsce w przypadku elektronu atomu wodoru, ale także elektrostatyczne siły odpychania przez inne elektrony. W tym przypadku
stosuje się tzw. przybliżenie jednoelektronowe, polegające na tym, że rozpatruje się oddzielnie każdy elektron. Elektrony otaczają jądro kulistą chmurą ładunku ujemnego,
zminiejszając tym samym siłę przyciągania jądro - wybrany elektron.
Plik z chomika:
acallk
Inne pliki z tego folderu:
egzamin.zip (85 KB)
fiz-egz.pdf (4077 KB)
fizyka sciaga.doc (3792 KB)
fizyka sciąga fifo.doc (408 KB)
fizyka-praca-domowa-2-1.jpg (191 KB)
Inne foldery tego chomika:
Zgłoś jeśli naruszono regulamin
Strona główna
Aktualności
Kontakt
Dla Mediów
Dział Pomocy
Opinie
Program partnerski
cw 1
cw 11
cw 19
cw 2
cw 20
Regulamin serwisu
Polityka prywatności
Ochrona praw autorskich
Platforma wydawców
Copyright © 2012 Chomikuj.pl