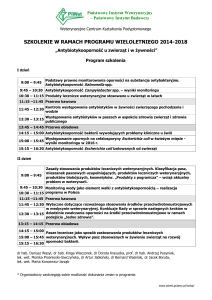
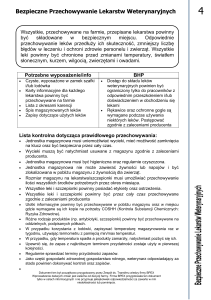
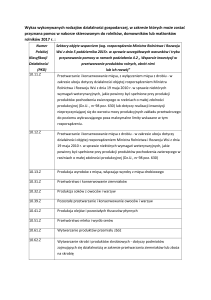
ROZPORZĄDZENIE W SPRAWIE LEKÓW
WETERYNARYJNYCH
TEMAT: INFORMACJE OGÓLNE
Co i kiedy?
Propozycja COM (2014) 558 Rozporządzenia w sprawie weterynaryjnych produktów
leczniczych została złożona w Parlamencie Europejskim w październiku 2014 r.
Postanowienia Rozporządzenia obejmują zarówno wymagania w zakresie danych, jak i
procedury dopuszczenia do obrotu weterynaryjnego produktu leczniczego. Rozporządzenie
zawiera również przepisy w zakresie produkcji, etykietowania, sprzedaży/dystrybucji oraz
monitorowania bezpieczeństwa w ramach rynku (nadzoru nad bezpieczeństwem
farmakoterapii).
Jakie są cele Komisji?
Zwiększenie dostępności weterynaryjnych produktów leczniczych.
Ograniczenie obciążeń administracyjnych dla przedsiębiorstw i organów
regulacyjnych.
Stymulowanie konkurencyjności i innowacji.
Poprawa funkcjonowania rynku wewnętrznego.
Podniesienie kwestii zagrożenia dla zdrowia publicznego, jakim jest oporność na leki
przeciwbakteryjne.
Jaka jest stawka?
Zdrowie i dobrostan zwierząt.
Dostępność szerokiej gamy leków weterynaryjnych w całej Europie.
Innowacyjne leki do zapobiegania chorobom i leczenia zwierząt.
Funkcjonowanie europejskiej branży weterynaryjnej.
Na co wpłynie ta propozycja?
Zwiększenie znaczenia inicjatywy One World – One Health (zwalczanie chorób
odzwierzęcych, tzn. takich, które przenoszą się ze zwierząt na ludzi) oraz
bezpieczeństwo żywności.
Zdolność do (szybkiej) reakcji na pojawiające się choroby zwierząt.
Rolnictwo – zrównoważona produkcja żywności i zapobieganie stratom w wyniku
chorób.
Leki dla zwierząt domowych.
Jakie są główne problemy dla branży?
Propozycja COM częściowo odpowiada na problemy i zawiera dobre propozycje, ale w
dwóch najważniejszych rozdziałach nie realizuje celów:
Stymulowania innowacji (np. poprzez odpowiednio długą ochronę dokumentacji
naukowej przed wykorzystaniem przez strony trzecie) i stymulowania badań nad
nowymi lekami przeciwdrobnoustrojowymi.
Poprawy funkcjonowania rynku wewnętrznego poprzez harmonizację informacji o
produktach i możliwości uzyskania zezwoleń na istniejące weterynaryjne produkty
lecznicze na terenie całej UE.
Najważniejsze kwestie do poparcia i poprawy są wyjaśnione szczegółowo w
osobnych arkuszach informacyjnych. Na odwrocie znajdują się informacje ogólne.
Informacje ogólne:
Podobnie jak produkty lecznicze przeznaczone dla ludzi, leki weterynaryjne wymagają
autoryzacji przed dopuszczeniem do obrotu. Dla leków tych należy dostarczyć dane
potwierdzające ich wysoką jakość wykonania, bezpieczeństwo (dla zwierząt, użytkowników i
środowiska) oraz skuteczność kliniczną. Ponadto, dla produktów przeznaczonych dla
zwierząt produkujących żywność należy podać dane dotyczące bezpieczeństwa dla
konsumentów.
Rynek leków weterynaryjnych różni się znacznie od rynku leków dla ludzi pod
względem ilości zasobów oraz scenariuszy korzyści/ryzyka. Dlatego też należy zachować
„ogólne zasady”, natomiast sposób ich wdrażania należy dostosować do warunków sektora
leków weterynaryjnych.
Najistotniejszymi cechami rynku weterynaryjnych produktów leczniczych są:
• Duże zróżnicowanie gatunków zwierząt, z których każdy ma określone potrzeby,
fizjologię i choroby. Produkt opracowany dla krów nie będzie się nadawał dla kotów. Dla
każdego gatunku należy opracować osobne produkty.
• Rozmiar rynku: Rynek leków weterynaryjnych ma rozmiar 1/40 rozmiaru rynku leków
dla ludzi. Dlatego też wykorzystanie zasobów i system rejestracji muszą wykazywać
wysoką wydajność.
• Niezbędne są dodatkowe dane dla ochrony zdrowia konsumentów i środowiska.
• Mechanizmy ustalania cen kierują się zupełnie inną logiką, ponieważ właściciele
zwierząt w pełni pokrywają koszty leczenia – nie istnieje państwowy system opieki
weterynaryjnej. W związku z tym ceny leków weterynaryjnych są znacznie niższe,
znacznie mniej jest też leków odtwórczych (generyków).
• Sektor rolniczy jest wrażliwy na koszty, takie jak cena leków.
Wynika to z zupełnie innych motywacji dla inwestycji w sektorze weterynaryjnych produktów
leczniczych.
Istnieją 4 drogi uzyskania dopuszczenia leku weterynaryjnego do obrotu:
• Procedura scentralizowana: odbywa się za pośrednictwem Europejskiej Agencji
Leków, a jej efektem jest dopuszczenie do obrotu na terenie całej UE.
• Procedury zdecentralizowane, w których uczestniczą co najmniej dwa państwa
członkowskie:
1) Procedura zdecentralizowana dla nowych produktów.
2) Procedura wzajemnego uznania, jeżeli w jednym z państw członkowskich produkt
został już dopuszczony do obrotu.
• Procedura krajowa: odbywa się za pośrednictwem właściwych władz krajowych, jeżeli
wymagane jest dopuszczenie do obrotu tylko w jednym państwie.
Więcej informacji na temat procedur dopuszczenia do obrotu można znaleźć na stronie internetowej
http://www.ifaheurope.org/regulatory-affairs/bringing-veterinary-medicines-to-market.html, natomiast
infografikę ilustrującą obciążenia administracyjne można znaleźć pod adresem
http://www.ifaheurope.org/regulatory-affairs/efficient-regulation.html