Cykl Kwasów
Tri-karboksylowych
=
TCA
=
Cykl Krebsa
=
Cykl Kwasu Cytrynowego
Miejsce
cyklu Krebsa
na mapie
metabolicznej
Uproszczony
schemat cyklu
Krebsa
(8 etapów)
Dwie drogi wejścia pirogronianu do cyklu
kwasów trikarboksylowych (wątroba)
Pirogronian
Szczawiooctan
Acetylo-CoA
Karboksylaza pirogronianowa
Karboksylaza pirogronianowa używa kowalencyjnie przyłączonej
biotyny jako kofaktora dwuetapowej reakcji karboksylacji pirogronianu.
Biotyna jest najpierw łączona z CO2 pochodzącym od węglanu, (przy
zużyciu ATP). Grupa karboksylowa jest następnie przenoszona przez
karboksybiotynę na drugie miejsce katalityczne, gdzie pirogronian jest
przekształcany w szczawiooctan.
Reakcja katalizowana przez
dehydrogenazę pirogronianową
Kompleks dehydrogenazy pirogronianowej składa się z
trzech białek o różnych aktywnościach. Zwróć uwagę
na 5 różnych kofaktorów tego złożonego procesu.
Pirogronian
Acetylo-CoA
Kwas Liponowy pełni tu funkcję ramienia
przenoszącego pozostałą po dekarboksylacji
pirogronianu resztę hydroksyetylową, pomiędzy
podjednostkami E1 i E3, katalizującymi kolejne etapy
reakcji
fragment pirgronianu
Utleniony Liponian
Tiamina
Syntaza Cytrynianowa
Cytrynian powstaje w reakcji katalizowanej przez syntazę
cytrynianową ze szczawiooctanu i acetylo-CoA.
Mechanizm polega na ataku nukleofilowym karboanionu
acetylo-CoA na węgiel karbonylowy szczawiooctanu, po
czym dochodzi do hydrolizy wiązania tioestrowego.
Reakcje katalizowane przez Akonitazę
-H2O
Kwas Cytrynowy
+ H2O
Kwas akonitowy
Kwas izocytrynowy
Akonitaza (Hydrataza akonitanowa; EC 4.2.1.3 ) jest enzymem
katalizującym stereo-specificzną izomeryzację cytrynianu do
izocytrynianu poprzez związek pośredni – kwas cis-akonitowy.
Kofaktorem Akonitazy jest zespół Fe3S4
Akonitaza (kont.)
Akonitaza zawiera zespół żelazowo-siarkowy złożony z
trzech atomów żelaza i czterech atomów siarki, ułożonych
w strukturę bliską kubicznej. Zespół ten jest umocowany w
białku przez grupy tiolowe trzech reszt cysteiny. Brak mu
jednego z narożników sześcianu. W tym właśnie miejscu
wiązany jest jon F2+, odpowiedzialny za aktywację
akonitazy. Ten atom koordynacyjnie wiąże C-3 karboksylu
oraz grupę hydroksylową cytrynianu. Działa więc jako kwas
Lewisa: przyłączając parę elektronów grupy hydroksylowej,
ułatwia odłączenie całej reszty.
Reakcja netto nie jest typu redoksowego!
Dehydrogenaza Isocytrynianowa
(pierwsza reakcja redoksowa cyklu)
Dehydrogenaza Isocytrynianowa (IDH) jest enzymem cyklu pośrednio
współdziałającym z łańcuchem oddechowym. Jest odpowiedzialna za
odwracalne przekształcanie izocytrynianu w -ketoglutaran i CO2, w
dwuetapowej reakcji. Pierwszym etapem jest utlenienie izocytrynianu
do szczawiobursztynianu. W drugim etapie reakcji szczawiobursztynian
traci swój -karboksyl jako CO2 .
Tlenowa dekarboksylacja ketoglutaranu
Kompleks dehydrogenazy
-ketoglutaranowej
-Ketoglutaran jest oksydacyjnie dekarboksylowany do
bursztynylo-CoA przez dehydrogenazę ketoglutaranową. W tej reakcji powstaje druga już
cząsteczka CO2 cyklu Krebsa, oraz cząsteczka NADH. Ten
kompleks wielo-enzymatyczny jest bardzo podobny do
kompleksu dehydrogenazy pirogronianowej zarówno pod
względem składu białkowego, rodzaju kofaktorów, jak i
mechanizmu działania.
Tak samo jak PDH, reakcja -KGDH przebiega z
wysoką standardową zmianą energii swobodnej Gibbsa.
Reakcja jest regulowana proporcjami stężeń NAD+/NADH
oraz ATP/ADP.
Reakcja i kofaktory tlenowej
dekarboksylacji -ketoglutaranu
Tiokinaza bursztynianowa
(reakcja)
Tiokinaza bursztynylowa
(Syntetaza bursztynylo - CoA)
Konwersja wysokoenergetycznego bursztynylo-CoA do
wolnego bursztynianu biegnie z udziałem enzymu
zdolnego do syntezy wysokoenergetycznego nukleotydu
trifosforanowego. Taki proces zwiemy fosforylacją
substratową. Powstaje wtedy połączenie enzym wysokoenergetyczny związek pośredni. Dopiero z niego
„wysoko energetyczna reszta fosforanowa” jest
przenoszona na GDP. Powstały w ten sposób
mitochondrialy GTP podlega trans-fosforylacji
katalizowanej przez nukleozydo-difosfo-kinazę z
cząsteczką ADP, i wytworzenie ATP. Cząsteczka GTP jest
odtwarzana potem w kolejnym obrocie cyklu.
Dehydrogenaza Bursztynianowa
(SDH)
Katalizuje utlenienie bursztynianu do fumaranu z równoczesną
redukcją kowalencyjnie związanego z białkiem FAD, oraz
żelaza niehemowego. W komórkach ssaków końcowym
akceptorem elektronów jest koenzym Q.
Dehydrogenaza bursztynianowa
(SDH, Kompleks II)
Skład: Cztery
podjednostki białkowe
(A,B,C,D) oraz
następujące
przenośniki
elektronów:
FADH2,
zespoły Fe-S,
hem b560,
ubichinon.
Fumaraza (hydrataza fumaranowa)
Katalizuje katalizuje uwodnienie fumaranu do kwasu
jabłkowego.
Dehydrogenaza jabłczanowa (MDH)
Katalizuje odwracalną reakcję utlenienia
jabłczanu do szczawiooctanu przy
standardowej zmianie energii swobodnej około
+7 kcal/mol. Natomiast syntaza cytrynianowa,
katalizująca reakcję kondensacji acetylo-CoA
ze szczawiooctanem, zachodzi przy
standardowej wielkości g równej około -8
kcal/mol. Zatem to ten enzym „ciągnie”
reakcję MDH w kierunku szczawiooctanu.
Reacja dehydrogenazy jabłczanowej
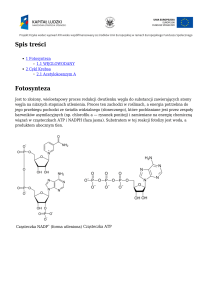
Sumaryczne równanie cyklu kwasów
trikarboksylowych:
Acetylo-CoA + 3NAD+ + FAD + GDP + Pi + 2H2O
2CO2 + 3NADH + FADH2 + GTP + 2H+ + HSCoA
Energetyka cyklu Krebsa w sprzężeniu z łańcuchem
oddechowym. Obliczanie energii zmagazynowanej w
postaci ATP
W całym cyklu są: 3 utlenienia z NAD
1 utlenienie z FAD
1 fosforylacja substratowa
Produkcja ATP sprzężona z tymi procesami
wynosi odpowiednio:
3 x 2,5 = 7,5 cząsteczek ATP
1 x 1,5 = 1,5 cząsteczek ATP
1 x 1 = 1 GTP (= 1 cząsteczka ATP)
W sumie = 10 cząsteczek ATP
(utworzone z ADP) przy spaleniu jednej
reszty octanowej do H2O i CO2
Jest to równoważne 310 kJ w warunkach
standardowych.
Cykl kwasów trikarboksylowych jest
przemianą amfiboliczną, czyli
zarówno:
Kataboliczną
jak i
Anaboliczną
Związki z wielu przemian są katabolizowane lub
Cykl cytrynianowy jako źródło
prekursorów szlaków biosyntezy
Regulacja cyklu cytrynianowego
Regulacja tego cyklu odbywa się zarówno na wejściu
jak i na poziomie samego cyklu. „Paliwo” dla tej
przemiany wchodzi głównie pod postacią acetylo-CoA.
Pochodzi on ze wszystkich trzech szlaków
katabolicznych: lipidów, węglowodanów, aminokwasów.
Jednak najistotniejszym jest źródło węglowodanowe,
czyli kompleks dehydrogenazy pirogronianowej.
PDH jest hamowana przez wysokie stężenia acetyloCoA i NADH, aktywowana przez wolny CoA (CoASH)
and NAD+. Mechanizm tej regulacji polega na użyciu
odpowiedniej kinazy i fosfatazy. Fosforylacja PDH
hamuje aktywność kompleksu, prowadząc do obniżenia
tempa utleniania pirogronianu. PDH kinaza jest
aktywowana przez NADH i acetyl-CoA, a hamowana
przez pirogronian, ADP, CoASH, Ca2+ i Mg2+. PDH
fosfataza, jest aktywowana jonami Mg2+ i Ca2+.