Załącznik nr 1
do zarządzenia Rektora nr 97/2012
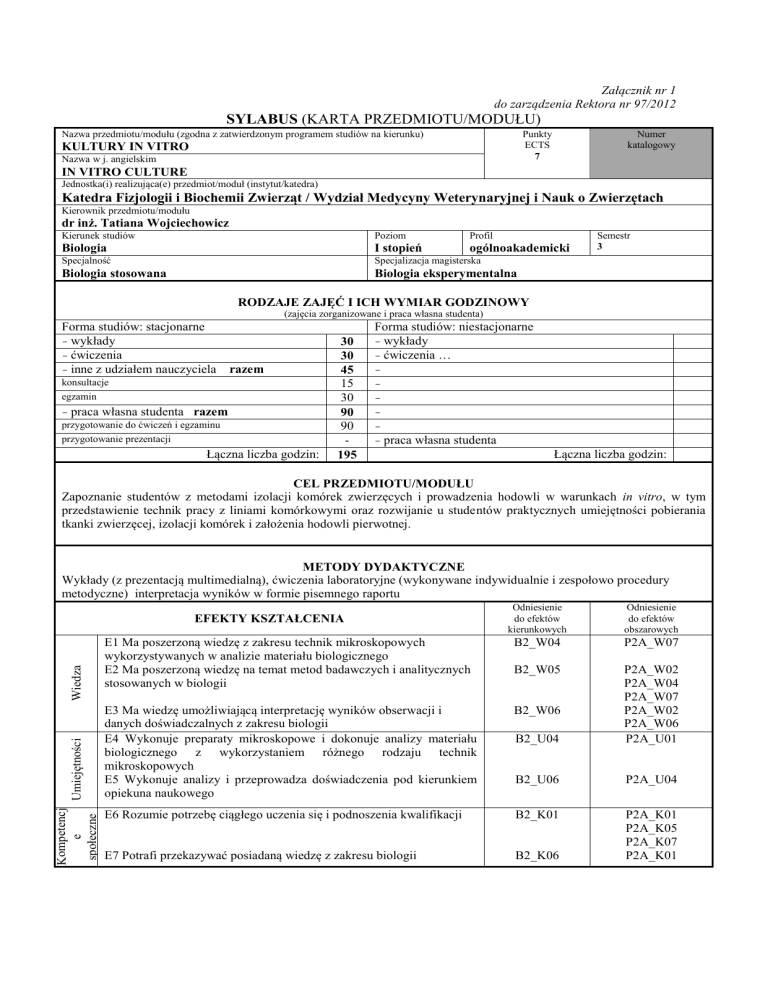
SYLABUS (KARTA PRZEDMIOTU/MODUŁU)
Nazwa przedmiotu/modułu (zgodna z zatwierdzonym programem studiów na kierunku)
Punkty
ECTS
7
KULTURY IN VITRO
Nazwa w j. angielskim
Numer
katalogowy
IN VITRO CULTURE
Jednostka(i) realizująca(e) przedmiot/moduł (instytut/katedra)
Katedra Fizjologii i Biochemii Zwierząt / Wydział Medycyny Weterynaryjnej i Nauk o Zwierzętach
Kierownik przedmiotu/modułu
dr inż. Tatiana Wojciechowicz
Kierunek studiów
Poziom
Profil
Biologia
I stopień
ogólnoakademicki
Specjalność
Specjalizacja magisterska
Biologia stosowana
Biologia eksperymentalna
Semestr
3
RODZAJE ZAJĘĆ I ICH WYMIAR GODZINOWY
(zajęcia zorganizowane i praca własna studenta)
Forma studiów: stacjonarne
­ wykłady
­ ćwiczenia
­ inne z udziałem nauczyciela
razem
konsultacje
egzamin
­ praca własna studenta razem
przygotowanie do ćwiczeń i egzaminu
przygotowanie prezentacji
Łączna liczba godzin:
30
30
45
15
30
90
90
195
Forma studiów: niestacjonarne
­ wykłady
­ ćwiczenia …
­
­
­
­
­
­ praca
własna studenta
Łączna liczba godzin:
CEL PRZEDMIOTU/MODUŁU
Zapoznanie studentów z metodami izolacji komórek zwierzęcych i prowadzenia hodowli w warunkach in vitro, w tym
przedstawienie technik pracy z liniami komórkowymi oraz rozwijanie u studentów praktycznych umiejętności pobierania
tkanki zwierzęcej, izolacji komórek i założenia hodowli pierwotnej.
METODY DYDAKTYCZNE
Wykłady (z prezentacją multimedialną), ćwiczenia laboratoryjne (wykonywane indywidualnie i zespołowo procedury
metodyczne) interpretacja wyników w formie pisemnego raportu
Odniesienie
do efektów
kierunkowych
Odniesienie
do efektów
obszarowych
E1 Ma poszerzoną wiedzę z zakresu technik mikroskopowych
wykorzystywanych w analizie materiału biologicznego
E2 Ma poszerzoną wiedzę na temat metod badawczych i analitycznych
stosowanych w biologii
B2_W04
P2A_W07
B2_W05
E3 Ma wiedzę umożliwiającą interpretację wyników obserwacji i
danych doświadczalnych z zakresu biologii
E4 Wykonuje preparaty mikroskopowe i dokonuje analizy materiału
biologicznego z wykorzystaniem różnego rodzaju technik
mikroskopowych
E5 Wykonuje analizy i przeprowadza doświadczenia pod kierunkiem
opiekuna naukowego
B2_W06
B2_U04
P2A_W02
P2A_W04
P2A_W07
P2A_W02
P2A_W06
P2A_U01
B2_U06
P2A_U04
E6 Rozumie potrzebę ciągłego uczenia się i podnoszenia kwalifikacji
B2_K01
E7 Potrafi przekazywać posiadaną wiedzę z zakresu biologii
B2_K06
P2A_K01
P2A_K05
P2A_K07
P2A_K01
Kompetencj
e
Umiejętności
społeczne
Wiedza
EFEKTY KSZTAŁCENIA
Numery efektów
Metody weryfikacji efektów kształcenia
E1, E2, E3, E4, E5, E6, E7
Dyskusja na ćwiczeniach laboratoryjnych; Ocena raportów; Kolokwia;
Zaliczenia ćwiczeń
Egzamin
TREŚCI KSZTAŁCENIA
Wykłady: Wprowadzenie, rys historyczny. Organizacja i wyposażenie pracowni hodowli komórkowych. Środowisko
hodowlane, skład i charakterystyka. Przedstawienie substratów (podłoży) oraz pożywek hodowlanych. Zapoznanie ze
składem pożywek podstawowych, bez surowicy oraz pożywek złożonych. Rola surowicy w prowadzeniu hodowli, zalety i
wady stosowania surowicy. Pożywki bez surowicy. Substytuty surowicy. Metody pozyskiwania, rozdzielania i identyfikacji
komórek. Rodzaje hodowli komórek zwierzęcych. Przykłady i charakterystyka klasyfikacji hodowli komórek. Pasażowanie
komórek – technika, metody i znaczenie. Linie komórkowe: charakterystyka linii komórkowych ciągłych, o określonym
czasie życia oraz linii klonalnych. Wyprowadzanie linii komórkowych. Linie komórkowe transformowane. Metody
transformacji komórek. Charakterystyka banków komórek zwierzęcych (ECACC, ATCC). Przykłady linii komórkowych i
ich zastosowanie w pracach badawczych. Zachowanie się komórek w środowisku hodowlanym. Krioprezerwacja i
przechowywanie komórek. Hodowle przestrzenne i inżynieria tkankowa - hodowle narządowe, hodowle agregatów i
sferoidów, hodowle w kapsułkach i kokultury organotypowe (inżynieria tkankowa). Rusztowania stosowane w inżynierii
tkankowej. Komórki STEM: porównanie cech komórek macierzystych osobników dorosłych i pierwotnych komórek
zarodkowych. Pozyskiwanie komórek zarodkowych z węzła zarodkowego lub trofoektodermy. Potencjalne zastosowanie
komórek macierzystych w medycynie – zalety, wady i aspekty etyczne. Biotechnologia kultur komórkowych i tkankowych.
Hodowla in vitro w immunologii. Źródła izolacji komórek immunokompetentnych użyteczne do zakładania hodowli in
vitro. Hodowle narządowe tkanek limfatycznych. Sposoby pozyskiwania leukocytów otrzewnowych osiadłych i
wysiękowych. Sposoby oceny aktywności komórek odpornościowych w hodowli in vitro. Hodowle in vitro w toksykologii.
Różnicowanie się komórek w hodowli in vitro. Proliferacja a różnicowanie. Markery różnicowania. Sposoby indukcji
różnicowania in vitro. Rola interakcji komórek w stanie konfluencji a różnicowanie – parakrynne czynniki wpływające
pozytywnie i negatywnie na proces różnicowania in vitro. Rola białek ECM a różnicowanie – specyficzność tkankowa.
Problemy w prowadzeniu hodowli in vitro (powolny wzrost komórek, kroskontaminacje, słaba żywotność komórek na
rożnych etapach hodowli: izolacja, hodowla, mrożenie/rozmrażanie, problemy z różnicowaniem komórek). Zakażenia i
sposoby ich zapobiegania.
Ćwiczenia laboratoryjne: Zapoznanie studentów z pracownią biologii komórki i urządzeniami używanymi do hodowli
komórek. Przygotowanie buforowanej soli fizjologicznej i pożywki DMEM/F12 z 10% dodatkiem surowicy płodowej FBS
do izolacji i hodowli fibroblastów. Sterylizacja przygotowanych płynów metodą filtracji. Izolacja fibroblastów z embrionów
szczurów. Założenie hodowli izolowanych komórek w różnych naczyniach hodowlanych. Zapoznanie studentów z
odwróconym mikroskopem stosowanym przy obserwacji komórek rosnących w monowarstwie. Obserwacja fibroblastów w
jasnym polu oraz w kontraście fazowym. Pasażowanie komórek adheretnych metodą trypsynizacji i zakładanie kolejnych
subpasaży. Zamrażanie fibroblastów w pożywce krioprotekcyjnej z dodatkiem DMSO. Rozmrażanie fibroblastów i
zakładanie hodowli wtórnej. Utrwalanie i barwienie preparatów fibroblastów. Przyżyciowe barwienie fluorescencyjne jąder
komórkowych i wizualizacja z zastosowaniem mikroskopii konfokalnej. Zapoznanie studentów z mikroskopem
konfokalnym ZEISS LSM 510 Meta. Przygotowanie jałowych pożywek wzrostowych i różnicujących dla linii komórkowej
3T3-L1. Rozmrażanie komórek i zakładanie hodowli. Inicjacja różnicowania komórek linii oraz 3T3-L1. Przygotowywanie
preparatów płytki metafazalnej oraz barwienie preparatów znacznikiem fluorescencyjnym DAPI. Mikroskopowa
obserwacja fluorescencji chromosomów płytki metafazalnej. Pasażowanie i zamrażanie w ciekłym azocie oraz przyżyciowe
obserwacje mikroskopowe różnicowanych komórek linii 3T3-L1. Barwienie różnicowanych komórek linii 3T3-L1
czerwienią olejową O i hematoksyliną.
Formy i kryteria zaliczenia przedmiotu/modułu
Obecność na zajęciach jest obowiązkowa.
Zaliczenie (praktyczne i teoretyczne) ćwiczeń na ocenę pozytywną uprawnia do
przystąpienia do egzaminu
Część teoretyczna ćwiczeń (kolokwium, pisemne)
Egzamin końcowy (pisemny)
Procentowy udział w końcowej ocenie
30 % ZALICZENIE ĆWICZEŃ
70% EGZAMIN
WYKAZ LITERATURY
Literatura podstawowa:
Stokłosowa S (red) 2004 Hodowla komórek i tkanek, Wydawnictwo Naukowe PWN
Literatura uzupełniająca:
Freshney RI. (2000) Culture of Animal Cells – a manual of basic technique, Wiley-Liss Publication