Tomasz Czonstke
Przemysław Drywa
SUCHiKL sem. 8
Niezwykłe właściwości zwykłej wody, konieczność jej uzdatniania w
układach chłodzenia np. skraplaczy.
1) Niezwykłe właściwości zwykłej wody.
Zdolność wody do bycia cieczą - Najbardziej zaskakującą i korzystną dla natury cechą
wody jest jej zdolność bycia cieczą. Cząsteczki analogów wody z okresowego układu
pierwiastków Mendelejewa, czyli wodorków (H2S, H2Se, H2Te) są istotnie cięższe, natomiast
w tych samych warunkach znajdują się w stanie gazowym. Gdyby woda zachowywała się tak
samo jak cząsteczki analogów musiałaby mieć temperaturę zamarzania około -90oC, a
wrzenia -70oC. Wątpliwym jest, aby takie warunki sprzyjały rozwojowi życia na Ziemi.
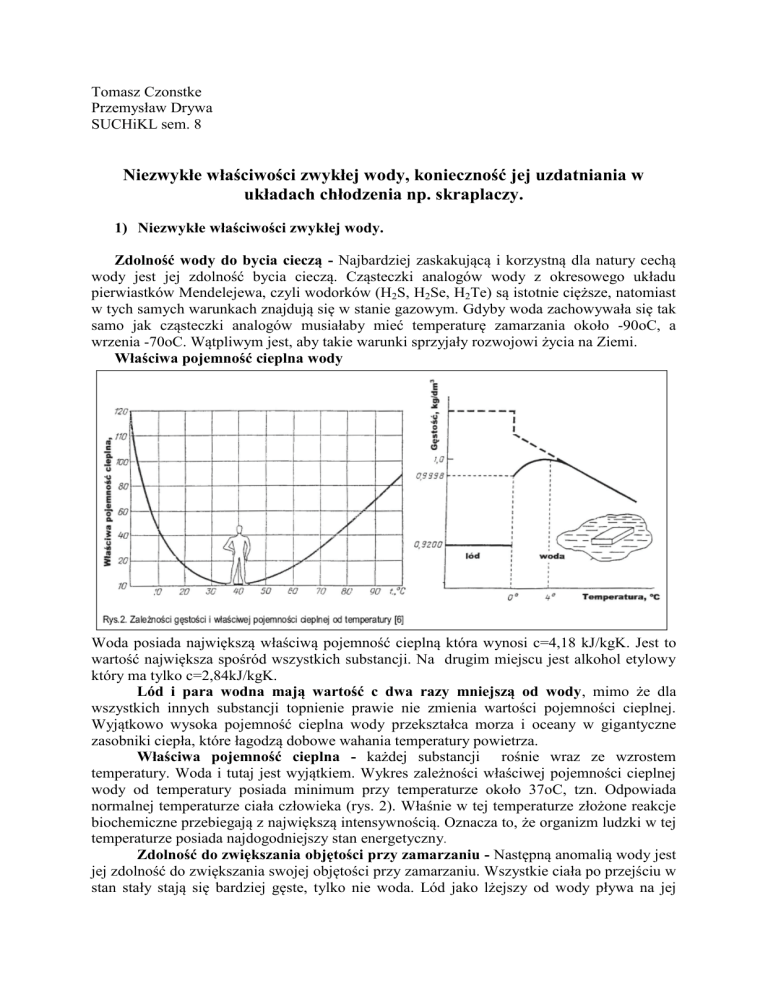
Właściwa pojemność cieplna wody
Woda posiada największą właściwą pojemność cieplną która wynosi c=4,18 kJ/kgK. Jest to
wartość największa spośród wszystkich substancji. Na drugim miejscu jest alkohol etylowy
który ma tylko c=2,84kJ/kgK.
Lód i para wodna mają wartość c dwa razy mniejszą od wody, mimo że dla
wszystkich innych substancji topnienie prawie nie zmienia wartości pojemności cieplnej.
Wyjątkowo wysoka pojemność cieplna wody przekształca morza i oceany w gigantyczne
zasobniki ciepła, które łagodzą dobowe wahania temperatury powietrza.
Właściwa pojemność cieplna - każdej substancji rośnie wraz ze wzrostem
temperatury. Woda i tutaj jest wyjątkiem. Wykres zależności właściwej pojemności cieplnej
wody od temperatury posiada minimum przy temperaturze około 37oC, tzn. Odpowiada
normalnej temperaturze ciała człowieka (rys. 2). Właśnie w tej temperaturze złożone reakcje
biochemiczne przebiegają z największą intensywnością. Oznacza to, że organizm ludzki w tej
temperaturze posiada najdogodniejszy stan energetyczny.
Zdolność do zwiększania objętości przy zamarzaniu - Następną anomalią wody jest
jej zdolność do zwiększania swojej objętości przy zamarzaniu. Wszystkie ciała po przejściu w
stan stały stają się bardziej gęste, tylko nie woda. Lód jako lżejszy od wody pływa na jej
powierzchni, co chroni akweny Ziemi przed wymrożeniem w srogie zimy. Konkretnie, woda
osiąga maksymalną gęstość przy temperaturze +4oC.
Lepkość wody, to jeszcze jedna oryginalna cecha. Zwykle ze wzrostem ciśnienia
lepkość dowolnej substancji rośnie, a ze wzrostem temperatury maleje. Lepkość wody
zachowuje się inaczej: znacznie zmniejsza się przy obniżaniu ciśnienia w zakresie temperatur
poniżej 30 oC, lecz w miarę podnoszenia ciśnienia zależność przechodzi przez minimum i
rozpoczyna się jej trend wzrostowy.
W tabeli zestawiono omawiane przeze mnie właściwości wody.
Przechłodzenie wody - Woda może istnieć w stanie ciekłym, osiągając jednocześnie
temperaturę poniżej 0oC. Jest to tak zwany stan przechłodzenia. Zwykłą wodę z kranu w
objętości około litra można przechłodzić do -5oC natomiast przy zmniejszeniu objętości i
oczyszczeniu z domieszek aż do –40oC. Proces ten ulega zakłóceniu przy pojawieniu się w
wodzie zarodka lodu o objętości rzędu 10-6 mm3. W charakterze zarodka może wystąpić
cząsteczka kurzu, domieszka mechaniczna, obecność w wodzie fazy stałej lub
najdrobniejszych pęcherzyków powietrza. Zakłócenie niestabilnego stanu przechłodzenia
wody obserwuje się również przy jej wstrząsaniu mechanicznym.
Zeszklenie wody - jest to proces w pewnym sensie przeciwny do przechłodzenia.
Obserwuje się go, kiedy prędkość chłodzenia przewyższa prędkość wzrostu kryształu lodu.
Woda nie nadąża zmieniać swojej struktury w heksagonalną lub inną krystaliczną strukturę
lodu i pozostaje bezpostaciowa w stanie zamrożonym. Taką wodę można uzyskać
wpuszczając kroplę wody do naczynia z ciekłym azotem.
Woda z topniejącego lodu - Po stopieniu woda posiada bardziej uporządkowaną
strukturę, zawiera zarodki klatratów lodu, co pozwala jej na aktywniejsze oddziaływanie ze
składnikami biologicznymi i rozpuszczonymi substancjami. Po spożyciu takiej wody, do
organizmu dostają się drobne ośrodki struktury lodopodobnej, które następnie mogą się
rozrosnąć i sprowadzić wodę do stanu lodopodobnego i tym samym wywołać działanie
uzdrawiające. Na przykład w celu przyspieszenia wzrostu roślin zaleca się ich podlewanie
taką wodą.
Czwarty stan skupienia wody- Woda zawarta w komórkach organizmów żywych, w
tym również u człowieka, w temperaturze około 4oC może przejść w czwarty stan skupienia,
który różni się zasadniczo od lodu tym, że komórki żywego organizmu nie są przy tym
rozrywane. Stan człowieka, którego komórki zawierają wodę w czwartym stanie skupienia
nazwa się „skamieniałym”, lub mówi się że jest on w stanie anabiozy. W stanie tym, jak w
śpiączce, człowiek może się znajdować dowolnie długo, przy czym procesy fizjologiczne w
organizmie ustają. Występuje to również u wodnych form życia.
Informatyczne właściwości wody. Woda jak taśma czy płyta Cd może być nośnikiem
informacji. Dzięki istnieniu struktury w wiązaniach wodorowych, woda jest bardzo pojemna
energetycznie substancja. Czyli woda ma jakby budowę krystaliczną. Na każdej ściance
takiego kryształka wody może powstać, przypadkowy rozkład elektrycznych plusów i
minusów – są to dipole wody tworzące ściankę kryształka i wystające z niej biegunem
dodatnim lub ujemnym- tworzy się więc kod dwójkowy. Gdy do wody dostanie się
cząsteczka jakiegoś związku chemicznego odbije ona na ściance kryształka wody swój wzór.
Co tłumaczy fenomen rozpuszczalności wody, która rozpuszcza prawie wszystko gdyż w
wodzie zawsze znajduje się odpowiednia ilość kryształków z odpowiednim wzorem który
działa jak wytrych na rozpuszczana substancje.
Dlaczego woda jest tak niezwykła cieczą?
- Podstawową przyczyną wszystkich wyróżniających się właściwości wody jest obecność
wiązań (mostków) wodorowych pomiędzy cząsteczkami wody. Dzięki tym wiązaniom
pojedyncze cząsteczki łączą się w asocjaty, te z kolei tworzą jeszcze bardziej złożone
struktury, klatraty, które stawiają opór jakimkolwiek zewnętrznym oddziaływaniom:
cieplnym, mechanicznym i elektrycznym. Obecność tych wiązań jest niezbędnym,
aczkolwiek nie wystarczającym warunkiem niezwykłych właściwości wody. Mostki
wodorowe mogą również tworzyć cząsteczki innych związków wodoru takie jak amoniak
(NH3) lub kwas fluorowodorowy (HF). Jednak one nie maja takich właściwości jak woda.
- Druga tajemnica wody tkwi w kształcie jej cząsteczki. Umownie można ją przedstawić w
postaci czworościanu foremnego, w środku którego znajduje się atom tlenu, w dwóch
wierzchołkach - atomy wodoru, a do dwóch innych wierzchołków sięgają orbity elektronów
atomu tlenu. Mimo prawidłowości kształtu domniemanego przez nas czworościanu,
cząsteczka wody jest pod każdym względem niesymetryczna. Atomy wodoru tworzą na
jednym z jej końców ładunek dodatni, natomiast elektrony atomu tlenu na innym końcu ładunek ujemny. Dzięki temu cząsteczka wody jest dipolem elektrycznym, posiadającym
istotny moment dipolowy. Dwie cząsteczki wody mogą połączyć się w tzw. dimer (rys. 3b),
którego moment dipolowy w określonych warunkach może wzrosnąć ponad dwukrotnie.
Warunki te powstają w pobliżu granicy podziału faz ciecz- ciało stałe (czyli woda-lód) i w
błonach komórkowych istot żywych. Z tego wynika, że woda związana, tzn. woda zawarta
wewnątrz tkanek, jest już zupełnie inną wodą w porównaniu z tą, która znajduje się przed
nami w szklance.
Przy zamarzaniu trójścienne ostrosłupy cząsteczek wody łączą się w swoistą przestrzenną
super strukturę, która obejmuje całą objętość. Tworzą się wielokąty z liczbą ścian zawsze
równą sześciu. Lód nie jest ściśle upakowanym kryształem; jego struktura jest bardzo
pulchna, występuje w niej sporo pustych miejsc, częściowo wypełnionych cząsteczkami
wody. Dlatego lód jest lżejszy od wody. Co więcej, wspomniane cząsteczki wody wędrują po
sieci krystalicznej. W tym przypadku specjaliści mówią, że w fazie stałej jest obecna faza
ciekła, podobnie jak w stopniałej wodzie częściowo zachowują się resztki struktury
krystalicznej lodu.
Współczesne spektroskopowe metody badań, np. rezonans jądrowy, magnetyczny,
rentgenowski i inne, pozwoliły naukowcom ustalić, że woda - podobnie jak lód - jest
substancją strukturalną, przy czym istnieje nie jedna, lecz kilka struktur wody.
2) Konieczność uzdatniania wody w układach chłodzenia
Chłodzenie wodne polega na chłodzeniu elementów mechanicznych lub
elektronicznych przy użyciu układu, w którym medium transportującym ciepło jest woda.
Systemy chłodzenia wodnego są stosowane m.in. w samochodach, elektrowniach, czasami w
komputerach a także w układach chłodniczych do chłodzenia skraplaczy.
System chłodzenia wodnego, niezależnie od miejsca zastosowania składa się zawsze z
trzech podstawowych elementów:
bloków chłodzących - wymienników ciepła, w których przepływająca woda ogrzewa się od
elementów, odbierając od nich tym samym ciepło; zwykle mają postać żłobkowanych
kształtek lub zestawu cienkich rurek, wykonanych z metali dobrze przewodzących ciepło (np.
miedź lub mosiądz) i posiadających dużą powierzchnię wymiany, przez które cyrkuluje woda,
chłodnicy - która również jest wymiennikiem ciepła, zbudowanym z kształtek lub rurek, w
której dochodzi do oddawania ciepła z wody do otoczenia; chłodnice są często zaopatrywane
w wentylatory, które zwiększają intensywność wymiany ciepła przez wymuszanie ruchu
powietrza,
pompy - która wymusza kontrolowany obieg wody w całym układzie - pompy te miewają
różną konstrukcję zależną od zastosowania i potrzebnej wydajności pracy
zbiornika wyrównującego z zaworami - automatycznie uzupełniającego niedobory wody,
które powstają na skutek nieszczelności i parowania,
układu rur, które łączą z sobą pompę, bloki chłodzące, chłodnicę, zbiornik wyrównawczy i
ewentualnie elementy dodatkowe takie jak wskaźniki przepływu, ciepła, ciśnienia i
temperatury.
Podstawową zaletą chłodzenia wodnego, jest niska cena wody - najtańszego z
możliwych ciekłego medium chłodzącego. W porównaniu z układami powietrznymi, wodne
układy chłodzące są zwykle dużo bardziej efektywne. Występują także wady takiego
rozwiązania. Należy w trakcie eksploatacji liczyć się ze zjawiskami osadotwórczymi na
powierzchniach wymiany ciepła (powstawanie różnego rodzaju kamieni wodnych), korozją,
rozwojem organizmów żywych oraz zamulaniem instalacji wody chłodzącej. Dlatego też
wraz z upływającym czasem eksploatacji urządzenia chłodnicze wyposażone w skraplacz
chłodzony wodą mają coraz mniejszą wydajność cieplną. Obniżenie intensywności
chłodzenia skraplacza jest bezpośrednio spowodowane odkładaniem się osadów na
powierzchni rur, co wpływa na zmniejszenie współczynnika przenikania ciepła wskutek
pojawienia się dodatkowego oporu cieplnego (kamień wodny posiada ok. 20-krotnie mniejszą
przewodność od stali i ok. 100-krotnie mniejszą od miedzi). Z obliczeń wynika, że już
warstwa kamienia wodnego o grubości 0,6 mm wiąże się ze spadkiem wydajności cieplnej
skraplacza o 25% , powodując jednoczesny wzrost temperatury skraplania oraz zużycia
energii napędowej sprężarek o ok. 2÷4% na 1 K wzrostu tej temperatury.
Pogorszenie wymiany ciepła w skraplaczu następuje dodatkowo w sposób pośredni,
gdyż odkładające się zanieczyszczenia zapoczątkowują proces zmniejszania przekroju rur,
powodując wzrost oporów przepływu .
Zmniejszenie wydajności pompy prowadzi do zmniejszenia prędkości przepływu wody,
czego skutkiem jest znaczny spadek wartości współczynnika przenikania ciepła - k , z drugiej
strony należy pamiętać, że zbyt duża prędkość wody powoduje erozję rur i przedwczesne ich
zużycie. W ostatecznym rozrachunku proces ten powoduje duży spadek wydajności cieplnej
skraplacza.
Uwzględniając powyższe, utrzymanie jak najwyższej jakości wody chłodzącej jest
bardzo ważnym zagadnieniem eksploatacyjnym. Fakt ten ma szczególne znaczenie w
układach chłodniczych o dużej wydajności cieplnej skraplacza (np. amoniakalne układy
chłodnicze w browarach, sztucznych lodowiskach, itp.), gdzie wymaga się, aby temperatura
wody na wlocie do tego wymiennika była możliwie najniższa. Pociąga to za sobą mniejsze
zapotrzebowanie (uzupełnianie) na wodę, a jednocześnie narzuca na personel obsługujący
obowiązek zapewnienia jej odpowiednich właściwości chemicznych i fizycznych.
Należy zaznaczyć, że we wszystkich układach wymiany ciepła, w których mogą
zachodzić zjawiska osadotwórcze i korozyjne, istotne jest takie prowadzenie obiegu wodnego,
aby jak najmniej uzdatniać wodę. Fakt ten jest w dużej mierze zależny od rodzaju obiegu
chłodzącego, który może być obiegiem chłodzącym zamkniętym lub otwartym. W obiegu
chłodzącym zamkniętym, część wody stale odparowuje, stąd też powstałe ubytki należy
uzupełniać wodą uzdatnioną stosownie do obiegu. Natomiast w obiegu chłodzącym otwartym
świeża woda jest przetłaczana cały czas, pobierana w zależności od dostępności źródła, tj. z
morza, rzeki, studni lub innego zbiornika wodnego (staw, jezioro, itp.). W takim przypadku
chłodzenie wody następuje przez naturalne jej odparowanie do atmosfery, a uzupełnianie
ubytków odbywa się także w sposób naturalny (opady atmosferyczne, dopływy, itp.). Z
ekologicznego (mniejsze zużycie wody) oraz ekonomicznego (m.in. niższe koszty uzdatniania
wody) punktu widzenia, korzystniejsze są obiegi zamknięte, w których łatwiej jest
wyrugować wszelkiego rodzaju zanieczyszczenia
Istotnym warunkiem dobrej jakości wody jest utrzymanie jej zasolenia na
odpowiednim poziomie, ponieważ jego wzrost wpływa na zanieczyszczenie osadami
powierzchni wymiany ciepła skraplacza oraz prowadzi do zjawiska korozji. Woda chłodząca
nie powinna zawierać jonów żelaza Fe2+ i manganu Mn2+, gdyż po ewentualnym utlenienu,
zwiększają one ilość zawiesin w wodzie i mogą przyczyniać się do rozwoju flory bakteryjnej
(bakterie żelaziste i manganowe). Stwierdzono, że poziom zawiesin większy od 50 mg/dm3
wiąże się z obrastaniem powierzchni wymiany ciepła, co również ułatwia rozwój życia
biologicznego oraz przyspiesza wypadanie osadów mineralnych.
Warto w tym miejscu wspomnieć o szkodliwym działaniu jonów siarczanowych SO4
2-, bowiem przyczyniają się one do powstania dużych kryształów rozsadzających
powierzchnie betonowe, tzw. korozja siarczanowa betonów.
Poniżej w tabeli zamieszczone są podstawowe wymagania stawiane wodzie
stosowanej na cele chłodnicze.
•
•
•
•
Uogólniając woda chłodząca skraplacz urządzenia chłodniczego powinna posiadać:
możliwie najniższą temperaturę
wykazywać stabilność
być niekorozjogenną
nie powinna zawierać zawiesin i mikroorganizmów.
Literatura:
• www.wentylacja.com.pl
• www.wikipedia.pl
• „Technika Chłodnicza i Klimatyzacyjna”, nr. 8/2005










