1
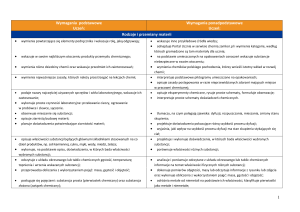
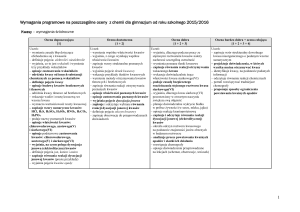
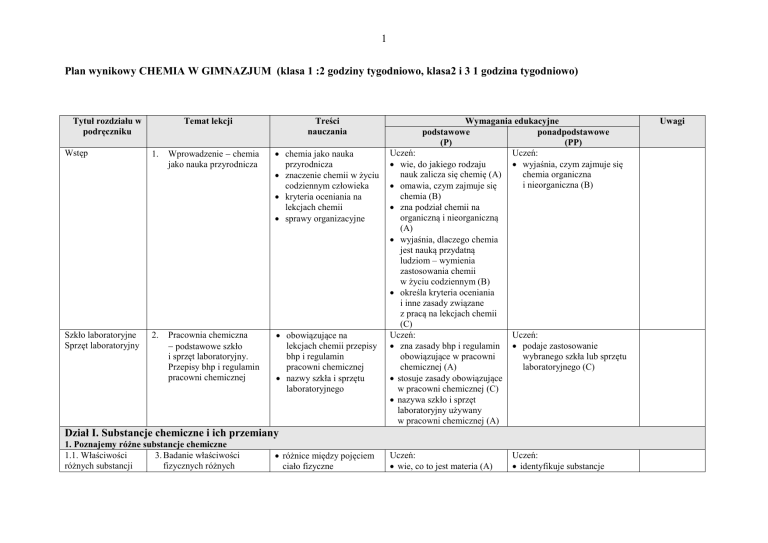
Plan wynikowy CHEMIA W GIMNAZJUM (klasa 1 :2 godziny tygodniowo, klasa2 i 3 1 godzina tygodniowo)
Tytuł rozdziału w
podręczniku
Treści
nauczania
Temat lekcji
Wstęp
1.
Wprowadzenie chemia
jako nauka przyrodnicza
chemia jako nauka
przyrodnicza
znaczenie chemii w życiu
codziennym człowieka
kryteria oceniania na
lekcjach chemii
sprawy organizacyjne
Szkło laboratoryjne
Sprzęt laboratoryjny
2.
Pracownia chemiczna
podstawowe szkło
i sprzęt laboratoryjny.
Przepisy bhp i regulamin
pracowni chemicznej
obowiązujące na
lekcjach chemii przepisy
bhp i regulamin
pracowni chemicznej
nazwy szkła i sprzętu
laboratoryjnego
Wymagania edukacyjne
podstawowe
ponadpodstawowe
(P)
(PP)
Uczeń:
Uczeń:
wie, do jakiego rodzaju
wyjaśnia, czym zajmuje się
nauk zalicza się chemię (A)
chemia organiczna
i nieorganiczna (B)
omawia, czym zajmuje się
chemia (B)
zna podział chemii na
organiczną i nieorganiczną
(A)
wyjaśnia, dlaczego chemia
jest nauką przydatną
ludziom – wymienia
zastosowania chemii
w życiu codziennym (B)
określa kryteria oceniania
i inne zasady związane
z pracą na lekcjach chemii
(C)
Uczeń:
Uczeń:
zna zasady bhp i regulamin podaje zastosowanie
obowiązujące w pracowni
wybranego szkła lub sprzętu
chemicznej (A)
laboratoryjnego (C)
stosuje zasady obowiązujące
w pracowni chemicznej (C)
nazywa szkło i sprzęt
laboratoryjny używany
w pracowni chemicznej (A)
Dział I. Substancje chemiczne i ich przemiany
1. Poznajemy różne substancje chemiczne
1.1. Właściwości
3. Badanie właściwości
różnych substancji
fizycznych różnych
różnice między pojęciem
ciało fizyczne
Uczeń:
wie, co to jest materia (A)
Uczeń:
identyfikuje substancje
Uwagi
2
substancji chemicznych
a substancja chemiczna
właściwości fizyczne
wybranych substancji
1.2. Mieszaniny
substancji
4. Mieszaniny substancji
mieszaniny substancji:
jednorodna
niejednorodna
sposoby rozdzielania
mieszanin
podział substancji
chemicznych
1.3. Zjawisko
fizyczne a reakcja
chemiczna
5.
zjawisko fizyczne
reakcja chemiczna
Zjawisko fizyczne
a reakcja chemiczna
wyjaśnia, czym się różni
ciało fizyczne od substancji
chemicznej (B)
wie, że substancje
charakteryzują się
określonymi
właściwościami (A)
określa właściwości
substancji (C)
dzieli substancje na
pierwiastki i związki
chemiczne (A)
Uczeń:
definiuje mieszaninę (A)
wyjaśnia różnice między
mieszaniną jednorodną
a niejednorodną (B)
podaje przykłady mieszanin
(C)
wymienia metody
rozdzielania mieszanin (A)
wyjaśnia, na czym polegają
podstawowe sposoby
rozdzielania mieszanin (B)
przygotowuje mieszaninę
(C)
dokonuje rozdzielenia
prostych mieszanin na
składniki (sól kuchenna
+ woda, piasek + woda) (C)
Uczeń:
definiuje zjawisko fizyczne
i reakcję chemiczną (A)
wymienia różnice między
zjawiskiem fizycznym
a reakcją chemiczną (C)
podaje przykłady zjawisk
fizycznych i reakcji
na podstawie podanych
informacji (D)
Uczeń:
wyjaśnia, na czym polega
destylacja (C)
proponuje różne sposoby
rozdzielenia podanej
mieszaniny (C)
Uczeń:
przeprowadza doświadczenia
pokazujące reakcję chemiczną
i zjawisko fizyczne (C )
analizuje podane przykłady
pod względem reakcji
chemicznej i zjawiska
fizycznego (D)
3
chemicznych (A)
formułuje obserwacje do
doświadczeń i wykonuje
proste doświadczenia (C)
dotyczy całości
1.4. Pierwiastek
chemiczny
a związek
chemiczny
6.
Poznajemy język
chemiczny
podział substancji
chemicznych
przypomnienie
pierwiastki chemiczne
metale i niemetale
symbole pierwiastków
chemicznych
związek chemiczny
podstawowe różnice
między mieszaniną
a związkiem chemicznym
1.5. Powietrze
7.
Czym jest powietrze?
co to jest powietrze
podstawowy skład
powietrza
właściwości fizyczne
powietrza
zastosowanie i rola
powietrza
Uczeń:
definiuje pierwiastek
i związek chemiczny (A)
zna podział pierwiastków
chemicznych (A)
podaje przykłady
pierwiastków chemicznych
należących do metali
i niemetali (C)
podaje przykłady związków
chemicznych (C)
zna symbole chemiczne
najważniejszych
pierwiastków chemicznych
(A)
wyjaśnia potrzebę
wprowadzenia symboliki
chemicznej (B)
rozpoznaje pierwiastki,
związki chemiczne (C)
Uczeń:
wie, że powietrze jest
mieszaniną jednorodną (A)
wymienia główne składniki
powietrza (A)
bada skład powietrza (C)
opisuje doświadczenia,
wykonuje doświadczenia (C
lub D), formułuje wnioski,
przewiduje wyniki
niektórych doświadczeń na
podstawie swojej wiedzy (D),
projektuje doświadczenia
(D) dotyczy całości
Uczeń:
wskazuje wśród różnych
substancji mieszaninę
i związek chemiczny (D)
wyjaśnia różnicę między
mieszaniną a związkiem
chemicznym (C)
odszukuje w układzie
okresowym podane pierwiastki
chemiczne (C)
Uczeń:
zapisuje obserwacje
i formułuje wnioski
z doświadczenia – badanie
składu powietrza (C)
4
1.6. Tlen i jego
właściwości
8.
Otrzymywanie tlenu
i badanie jego
właściwości fizycznych
tlen – najważniejszy
składnik powietrza
(historia odkrycia,
otrzymywanie,
właściwości fizyczne)
substraty i produkty
reakcji chemicznej
reagenty
reakcja rozkładu (analizy)
9.
Badanie właściwości
chemicznych tlenu
właściwości chemiczne
tlenu
reakcja syntezy (łączenia)
utlenianie i spalanie
tlenki
obieg tlenu w przyrodzie
rola tlenu w życiu
człowieka i innych
organizmów
Uczeń:
wie, co to jest tlen (A)
opisuje sposoby
otrzymywania tlenu (C)
określa właściwości
fizyczne tlenu (C)
wyjaśnia pojęcia: substrat,
produkt, reagent (B)
definiuje reakcję analizy (A)
zapisuje słownie przebieg
reakcji analizy (C)
określa substraty, produkty,
reagenty, pierwiastki
i związki chemiczne
w reakcji chemicznej (C)
Uczeń:
określa właściwości
chemiczne tlenu (C)
definiuje reakcję syntezy,
utlenianie i spalanie (A)
odróżnia utlenianie od
spalania (B)
zapisuje słownie przebieg
reakcji syntezy (C)
określa substraty, produkty,
reagenty, pierwiastki,
związki chemiczne w
reakcji chemicznej (C)
definiuje tlenki (A)
dokonuje podziału tlenków
(A)
wie, na czym polega obieg
tlenu w przyrodzie (B)
wyjaśnia znaczenie tlenu dla
człowieka (B)
Uczeń:
opisuje sposoby otrzymywania
tlenu (C)
zapisuje słownie przebieg
reakcji analizy (C)
wyóżnia reakcje analizy wśród
innych reakcji chemicznych
(D)
Uczeń:
określa rolę tlenu w życiu
człowieka i innych
organizmów (C)
zapisuje słownie przebieg
reakcji syntezy (C)
wyróżnia reakcje syntezy
wśród innych reakcji
chemicznych (D)
5
1.9. Tlenek
węgla(IV)
właściwości i rola
w przyrodzie
1.11.
Zanieczyszczenia
powietrza
1.10. Rola pary
wodnej w powietrzu
10. Tlenek węgla(IV) jako
składnik powietrza
występowanie i obieg
tlenku węgla(IV)
w przyrodzie
rola tlenku węgla(IV)
w przyrodzie
(fotosynteza), efekt
cieplarniany
11. Otrzymywanie tlenku
węgla(IV) i badanie jego
właściwości
otrzymywanie tlenku
węgla(IV)
badanie właściwości
tlenku węgla(IV)
wykrywanie obecności
tlenku węgla(IV)
reakcja wymiany
reakcja charakterystyczna
12. Woda – jej właściwości
i rola w przyrodzie
dowody obecności pary
wodnej w powietrzu
higroskopijność
Uczeń:
wie, co to jest tlenek
węgla(IV) (A)
omawia obieg tlenku
węgla(IV) w przyrodzie (B)
rozumie, na czym polega
proces fotosyntezy (B)
wie, na czym polega efekt
cieplarniany (B)
Uczeń:
określa właściwości
fizyczne i chemiczne tlenku
węgla(IV) (C)
definiuje reakcję wymiany
(A)
podaje sposób
otrzymywania tlenku
węgla(IV), np. reakcja
węgla z tlenem (B)
wie, co to jest reakcja
charakterystyczna (A)
określa sposób wykrywania
tlenku węgla(IV) (B)
zapisuje słownie przebieg
prostych reakcji wymiany
(C)
określa substraty, produkty,
reagenty, pierwiastki
i związki chemiczne
w reakcji chemicznej (C)
Uczeń:
wie, co to jest woda (A)
wymienia właściwości
wody (B)
wyjaśnia znaczenie wody
w przyrodzie, pary wodnej
w atmosferze (B)
Uczeń:
wyjaśnia rolę procesu
fotosyntezy w życiu człowieka
(C)
omawia efekt cieplarniany i
zagrożenia z nim związane (C)
Uczeń:
podaje sposób otrzymywania
tlenku węgla(IV) z węglanów
(C)
otrzymuje tlenek węgla(IV)
w reakcji węglanu wapnia
z kwasem solnym (C)
uzasadnia na podstawie reakcji
magnezu z tlenkiem
węgla(IV), że tlenek
węgla(IV) jest związkiem
chemicznym węgla i tlenu (D)
sprawnie posługuje się
pojęciem reakcji wymiany (C)
wyróżnia reakcje wymiany
wśród innych reakcji
chemicznych (D)
Uczeń:
potrafi wykazać obecność pary
wodnej w powietrzu (D)
wymienia przykłady
wykorzystania
higroskopijności substancji (C)
6
1.5. Powietrze
1.7. Azot – główny
składnik powietrza
1.8. Gazy szlachetne
13. Stałe i zmienne składniki
powietrza
stałe i zmienne składniki
powietrza
azot główny składnik
powietrza
obieg azotu w przyrodzie
zastosowania azotu
gazy szlachetne
występowanie
i zastosowania gazów
szlachetnych
1.11.
Zanieczyszczenia
powietrza
14. Zagrożenia cywilizacyjne
najważniejsze zagrożenia
cywilizacyjne:
dziura ozonowa,
kwaśne opady,
efekt cieplarniany,
zanieczyszczenia
powietrza i wody
sposoby usuwania,
ograniczania zgrożeń
cywilizacyjnych
określa zachowanie się
substancji higroskopijnych
(C)
wyjaśnia pojęcie
higroskopijności (B)
Uczeń:
wie, co to są stałe i zmienne
składniki powietrza (B)
wymienia stałe i zmienne
składniki powietrza (A)
wymienia ważniejsze
właściwości i zastosowania
azotu (A)
wie, co to są gazy
szlachetne (A)
wymienia ważniejsze
właściwości i zastosowania
gazów szlachetnych (A)
oblicza przybliżoną objętość
tlenu i azotu, np.
w pracowni chemicznej (C)
Uczeń:
wymienia najważniejsze
zagrożenia cywilizacyjne
(A)
wie, co to jest dziura
ozonowa, kwaśne opady,
efekt cieplarniany (B)
wymienia źródła
zanieczyszczeń wód,
powietrza (B)
Uczeń:
określa, które składniki
powietrza są stałe, a które
zmienne (C)
opisuje obieg azotu
w przyrodzie (B)
wykonuje obliczenia
dotyczące składu powietrza
(C)
Uczeń:
wyjaśnia, skąd się biorą
kwaśne opady (B)
określa, jakie zagrożenia
wynikają z powstania efektu
cieplarnianego, dziury
ozonowej, kwaśnych opadów
(C)
wykazuje zależność między
rozwojem cywilizacji
a występowaniem zagrożeń
(D)
proponuje sposoby
ograniczania zanieczyszczeń
wody i powietrza (D)
7
1.12. Wodór i jego
właściwości
15. Otrzymywanie wodoru
i badanie jego
właściwości
2. Poznajemy reakcje chemiczne i ich rodzaje
2.1. Reakcje
16. Reakcje utleniania
utleniania i redukcji
i redukcji
– szczególny rodzaj
reakcji wymiany
2.2. Energia
w reakcjach
chemicznych
17. Podsumowanie
wiadomości. Poznane
rodzaje reakcji
chemicznych
otrzymywanie wodoru
właściwości fizyczne
i chemiczne wodoru
wykrywanie obecności
wodoru
Uczeń:
wie, co to jest wodór (A)
wie, jak otrzymać wodór
(B)
określa właściwości
fizyczne i chemiczne
wodoru (C)
identyfikuje wodór (C)
wskazuje substraty,
produkty reakcji,
pierwiastki i związki
chemiczne w reakcji
chemicznej (C)
Uczeń:
otrzymuje wodór (C)
dowodzi (na podstawie reakcji
magnezu z parą wodną), że
woda jest związkiem
chemicznym wodoru i tlenu
(D)
zapisuje słownie przebieg
reakcji związanych z wodorem
(C)
reakcja utleniania
i reakcja redukcji
utleniacz i reduktor
Uczeń:
definiuje reakcje utleniania
i redukcji (A)
definiuje utleniacz
i reduktor (A)
wskazuje reakcje utleniania,
redukcji, utleniacz
i reduktor w zapisach
słownych przebiegu
prostych reakcji
chemicznych (C)
zapisuje słownie przebieg
reakcji chemicznej (proste
przykłady) (C)
podsumowanie
wiadomości dotyczących
działu
typy reakcji chemicznych
przykłady poszczególnych
typów reakcji
chemicznych
Uczeń:
definiuje podstawowe typy
reakcji chemicznych (A)
wie, co to jest spalanie,
utlenianie, redukcja (A)
wymienia ważniejsze efekty
towarzyszące reakcjom
Uczeń:
opisuje doświadczenie
przeprowadzone na lekcji
schemat, obserwacje,
wnioski, zapis słowny
przebiegu reakcji chemicznej
(C)
projektuje doświadczenie
z węglem jako reduktorem (D)
zapisuje słownie przebieg
reakcji utleniania i redukcji
(C)
wskazuje reakcję utleniania,
redukcji, utleniacz, reduktor
w zapisie słownym przebiegu
reakcji chemicznej(C)
uzasadnia typ reakcji (D)
Uczeń:
wyjaśnia pojęcia reakcji egzoi endotermicznej, wymienia
przykłady (C)
określa typ podanej reakcji
chemicznej, uzasadnia swój
wybór (D)
8
Podsumowanie
działu
energia w reakcjach
chemicznych reakcje
endo- i egzoenergetyczne
chemicznym (A)
wie, co to są reakcje endoi egzoenergetyczne (A)
rozpoznaje typy reakcji
chemicznych na podstawie
zapisu słownego ich
przebiegu (C)
zapisuje słownie przebieg
reakcji chemicznych różnego
typu (C)
wewnętrzna budowa
materii
założenia teorii
atomistyczno-cząsteczkowej
dowody istnienia atomów
i cząsteczek
Uczeń:
definiuje materię (A)
wie, że materia ma budowę
ziarnistą (B)
odróżnia atom od cząsteczki
(B)
podaje przykłady poglądów
na temat budowy materii
(A)
wymienia najważniejsze
założenia teorii
atomistyczno-cząsteczkowej
(A)
wie, co to jest dyfuzja (A)
Uczeń:
zna skalę wielkości atomów
i ich mas (A)
definiuje jednostkę masy
atomowej, masę atomową
i cząsteczkową (A)
wie, gdzie jest podawana
masa atomowa pierwiastka
chemicznego (A)
potrafi odczytać masę
atomową pierwiastka (C)
oblicza masę cząsteczkową
Uczeń:
projektuje doświadczenie
potwierdzające ziarnistą
budowę materii (C)
podaje obserwacje i formułuje
wnioski do doświadczeń (C)
19. Sprawdzian
wiadomości. Omówienie
sprawdzianu
Dział II. Atom i cząsteczka
3. Poznajemy budowę atomu
3.1. Wewnętrzna
20. Poznajemy świat atomów
budowa materii
i cząsteczek
3.2. Historyczny
rozwój pojęcia
atomu
3.3. Masa i rozmiary
atomów
21. Masa i rozmiary atomów
rozmiary atomów
masy atomów
jednostka masy atomowej
masa atomowa i masa
cząsteczkowa
pierwiastek chemiczny
jako zbiór atomów tego
samego rodzaju
Uczeń:
wyjaśnia powody
wprowadzenia jednostki masy
atomowej (D)
odczytuje masy atomowe
z układu okresowego
pierwiastków chemicznych (C)
oblicza masę cząsteczkową (C)
przelicza jednostkę masy
atomowej na gramy (D)
9
3.2. Historyczny
rozwój pojęcia
atomu
3.5. Budowa atomu
22. Rozwój poglądów na
budowę materii
3.5. Budowa atomu
23. Budowa atomu – jądro
i elektrony
historyczny rozwój
poglądów na budowę
materii:
poglądy Demokryta,
teoria Daltona,
model atomu
Thomsona,
modele atomu
Rutherforda i Bohra
współczesny model atomu
jądro atomu – protony
i neutrony
elektrony
liczba atomowa (Z)
liczba masowa (A)
model atomu
(proste przykłady) (C)
definiuje pierwiastek
chemiczny (A)
Uczeń:
wymienia modele budowy
atomu (A)
wymienia najważniejsze
cechy modeli atomu (B)
omawia pojęcia elektrony,
jądro atomowe (B)
Uczeń:
wymienia i charakteryzuje
podstawowe cząstki
elementarne (C)
opisuje budowę atomu
pierwiastka chemicznego
(B)
wyjaśnia pojęcie powłoki
elektronowej (B)
wie, co to są elektrony
walencyjne i w jakiej liczbie
mogą występować (A)
wie, co określają liczba
atomowa i liczba masowa
(B)
odczytuje z układu
okresowego liczbę atomową
podanego pierwiastka
chemicznego (C)
podaje maksymalną liczbę
elektronów na 3 pierwszych
powłokach elektronowych
(A)
oblicza liczby elektronów,
protonów i neutronów,
Uczeń:
charakteryzuje poszczególne
modele atomu pierwiastka
chemicznego (B)
wyjaśnia różnicę między
modelem atomu Thomsona,
Rutheforda, Bohra i obecnym
(C)
Uczeń:
sprawnie odczytuje liczby
atomowe z układu okresowego
pierwiastków chemicznych (C)
zna zasady obliczania
maksymalnej liczby
elektronów na powłokach
i stosuje je (C)
oblicza liczby elektronów,
protonów, neutronów,
korzystając z liczb masowej
i atomowej (C)
rysuje modele atomów
pierwiastków chemicznych (C)
wskazuje rdzeń atomu
w modelu atomu (C)
10
3.6. Izotopy
24. Co to są izotopy?
pojęcie izotopu
izotopy wodoru
występowanie izotopów
w przyrodzie
rodzaje izotopów:
trwałe
nietrwałe
zastosowania izotopów
25. Zjawisko
promieniotwórczości
zjawisko
promieniotwórczości
rodzaje promieniowania
naturalnego (α, β, γ) i jego
najważniejsze
właściwości
pierwiastki
promieniotwórcze
okres półtrwania (okres
połowicznego rozpadu)
zagrożenia związane
ze zjawiskiem
promieniotwórczości
4. Poznajemy układ okresowy pierwiastków chemicznych
4.1. Układ okresowy 26. Układ okresowy
próby klasyfikacji
pierwiastków
pierwiastków – historia
pierwiastków
znając liczby masową
i atomową (C)
rysuje uproszczone modele
atomów pierwiastków
chemicznych (proste
przykłady) (C)
definiuje izotopy (A)
wyjaśnia podział izotopów
(B)
wymienia ważniejsze
zastosowania izotopów (A)
wymienia nazwy izotopów
wodoru oraz różnice między
nimi (A)
oblicza liczby elektronów,
protonów i neutronów dla
izotopów (C)
Uczeń:
opisuje zjawisko
promieniotwórczości (B)
wie, czym się różni
promieniotwórczość
naturalna od sztucznej (B)
wymienia rodzaje
promieniowania naturalnego
(A)
definiuje okres półtrwania
(czas połowicznego
rozpadu) i pierwiastek
promieniotwórczy (A)
wymienia najważniejsze
zagrożenia związane
z promieniotwórczością (C)
zna zasługi Marii
Skłodowskiej-Curie (A)
Uczeń:
wie, co to jest układ
wyjaśnia, dlaczego często
masa atomowa nie jest liczbą
całkowitą (C)
rozwiązuje zadania dotyczące
izotopów (C)
Uczeń:
opisuje poznane rodzaje
promieniowania (B)
wyjaśnia, co to jest reakcja
łańcuchowa (A)
wyjaśnia pojęcie okresu
półtrwania (czasu
połowicznego rozpadu) (B)
definiuje szereg
promieniotwórczy (A)
podaje przykłady szeregów
promieniotwórczych (D)
wymienia nazwiska uczonych
zasłużonych w badaniach nad
promieniotwórczością i ich
dokonania (A)
Uczeń:
omawia próby klasyfikacji
11
chemicznych
powstania i budowa
chemicznych przez
Newlandsa i Döbereinera
historia powstania układu
okresowego pierwiastków
Mendelejewa
prawo okresowości
budowa układu
okresowego pierwiastków
chemicznych
4.2. Zależność
między budową
atomu pierwiastka
a jego położeniem
w układzie
okresowym
4.3. Charakter
chemiczny
pierwiastków grup
głównych
27. Zależność między budową
atomu pierwiastka a jego
miejscem w układzie
okresowym pierwiastków
chemicznych
położenie pierwiastka
chemicznego w układzie
okresowym – informacje
wynikające z:
numeru grupy
numeru okresu
liczby atomowej
charakter chemiczny
pierwiastków grup
głównych
okresowy pierwiastków
chemicznych (A)
zna budowę układu
okresowego pierwiastków
chemicznych (B)
wie, jakie informacje
o atomie pierwiastka
możemy uzyskać z układu
okresowego pierwiastków
chemicznych (B)
podaje prawo okresowości
(A)
wie, kto jest twórcą układu
okresowego pierwiastków
(A)
Uczeń:
zna podstawowe zasady
korzystania z układu
okresowego pierwiastków
chemicznych (B)
potrafi odnaleźć w układzie
okresowym symbole
chemiczne podstawowych
pierwiastków (C)
potrafi korzystać z układu
okresowego pierwiastków
chemicznych (C)
potrafi zastosować
informacje odczytane
z układu okresowego
pierwiastków chemicznych
(C)
podaje maksymalną liczbę
elektronów na powłokach
(A)
określa liczbę protonów,
elektronów, powłok
elektronowych, elektronów
pierwiastków chemicznych (B)
wyjaśnia budowę układu
okresowego pierwiastków
chemicznych (B)
Uczeń:
swobodnie korzysta
z informacji zawartych
w układzie okresowym
pierwiastków chemicznych (C)
podaje rozmieszczenie
elektronów na powłokach
elektronowych (C)
rysuje modele atomów
pierwiastków chemicznych (C)
12
walencyjnych, charakter
chemiczny pierwiastka
chemicznego, korzystając
z układu okresowego (C)
rozpisuje rozmieszczenie
elektronów na powłokach
(proste przykłady) (C)
rysuje modele atomów
pierwiastków chemicznych
(proste przykłady) (C)
5. Poznajemy sposoby łączenia się atomów w cząsteczki
5.1. Rodzaje wiązań 28. Wiązanie kowalencyjne
mechanizm powstawania
chemicznych
(atomowe)
wiązania kowalencyjnego
niespolaryzowanego
rola elektronów
walencyjnych w
tworzeniu wiązania
chemicznego
oktet elektronowy
powstawanie wspólnych
par elektronowych
pojęcia:
wzór sumaryczny
wzór strukturalny
wzór elektronowy
Uczeń:
wie, co to jest wiązanie
chemiczne, jak powstają
cząsteczki (B)
zna rolę elektronów
walencyjnych podczas
tworzenia się wiązań (B)
podaje regułę oktetu
(dubletu) (A)
definiuje wiązania
kowalencyjne
i kowalencyjne
niespolaryzowane (A)
podaje, w jakich
cząsteczkach powstają
wiązania kowalencyjne
i kowalencyjne
niespolaryzowane (B)
definiuje wzory
sumaryczny, elektronowy
i strukturalny (A)
zapisuje wzory cząsteczek
pierwiastków chemicznych
i różne ich liczby (C)
Uczeń:
wyjaśnia regułę oktetu
(dubletu) (B)
wyjaśnia mechanizm
tworzenia się wiązania
kowalencyjnego
niespolaryzowanego
na przykładach (C)
13
29. Wiązania kowalencyjne
spolaryzowane
i niespolaryzowane
mechanizm powstawania
wiązania kowalencyjnego
spolaryzowanego
30. Wiązanie jonowe
jony – kationy, aniony
mechanizm powstawania
jonów
mechanizm powstawania
wiązania jonowego
31. Rodzaje wiązań
chemicznych ćwiczenia
rodzaje wiązań
chemicznych
Uczeń:
definiuje wiązanie
kowalencyjne
spolaryzowane (A)
określa wpływ obecności
tego wiązania na
właściwości niektórych
cząsteczek (C)
podaje przykłady cząsteczek
o wiązaniu kowalencyjnym
spolaryzowanym (C)
zapisuje wzory cząsteczek
związków chemicznych
i różne ich liczby (C)
Uczeń:
definiuje jony,
kationy, aniony (A)
wyjaśnia sposób
powstawania
jonów,kationów, anionów
(B)
definiuje wiązanie jonowe
(A)
podaje przykłady cząsteczek
z wiązaniem jonowym (C)
Uczeń:
określa rodzaje wiązań
w cząsteczkach (proste
przykłady) (C)
odróżnia wzory sumaryczne
od wzorów strukturalnych
(B)
zapisuje wzory sumaryczne
i strukturalne (proste
przykłady) (C)
Uczeń:
opisuje na przykładzie
mechanizm tworzenia się
wiązania spolaryzowanego (C)
wyjaśnia różnice między
wiązaniem kowalencyjnym
niespolaryzowanym
a spolaryzowanym (C)
analizuje, w jakich
cząsteczkach (substancjach)
występują wiązania
spolaryzowane
i niespolaryzowane (D)
Uczeń:
wyjaśnia mechanizm
tworzenia się wiązania
jonowego (C)
wskazuje substancje,
w cząsteczkach których
występuje wiązanie jonowe
(C)
Uczeń:
wyjaśnia różnice między
różnymi typami wiązań (C)
określa typy wiązań
w podanych cząsteczkach (C)
umie powiązać właściwości
związku chemicznego
z występującymi w nim
wiązaniami (D)
zapisuje wzory sumaryczne,
strukturalne i elektronowe (C)
14
5.2. Znaczenie
wartościowości przy
ustalaniu wzorów
związków
chemicznych
32. Wartościowość
pierwiastków w związkach
chemicznych
pojęcie: wartościowość
pierwiastka chemicznego
wartościowości
najważniejszych
pierwiastków
chemicznych
zależność między
wartościowością
pierwiastka chemicznego
a jego miejscem
w układzie okresowym
Uczeń:
definiuje wartościowość
pierwiastka chemicznego
(A)
zna wartościowość
najważniejszych
pierwiastków chemicznych
(A)
wie, że wartościowość
pierwiastków w stanie
wolnym to 0 (B)
odczytuje wartościowość
z układu okresowego
pierwiastków (prostsze
przykłady) (C)
Uczeń:
swobodnie posługuje się
pojęciem wartościowości (C)
określa możliwe
wartościowości pierwiastka
chemicznego na podstawie
jego położenia w układzie
okresowym (D)
15
3.4. Prawo
zachowania masy
5.3. Prawo stałości
składu związku
chemicznego
33.34. Ustalanie wzorów
związków chemicznych na
podstawie wartościowości
sposoby tworzenia
wzorów sumarycznych
prostych związków
chemicznych
wzory sumaryczne
i strukturalne
modele cząsteczek
związków chemicznych
35. Prawo zachowania masy.
Prawo stałości składu związku
chemicznego
treść prawa zachowania
masy i prawa stałości
składu związku
chemicznego
znaczenie prawa
zachowania masy i prawa
stałości składu związku
chemicznego
Uczeń:
wyznacza wartościowość
pierwiastków chemicznych
na podstawie wzoru
sumarycznego związku
chemicznego (C)
zapisuje wzory sumaryczne
i strukturalne związków
chemicznych na podstawie
wartościowości (C)
określa liczbę pierwiastków
w związku chemicznym,
liczbę i rodzaj atomów
w cząsteczce (C)
zapisuje nazwę związku
chemicznego na podstawie
wzoru (C)
zapisuje wzory związków
chemicznych na podstawie
ich nazw (C)
odczytuje proste zapisy, np.
2 HCl (C)
korzysta z modeli do
zapisywania wzorów (C)
Uczeń:
podaje treść poznanych
praw (A)
Uczeń:
podaje nazwy związków
chemicznych na podstawie
wzoru dla przykładów
o wyższym stopniu trudności
(C)
zapisuje wzory związków
chemicznych na podstawie
nazwy dla przykładów
o wyższym stopniu trudności
(C)
swobodnie wyznacza
wartościowość, zapisuje wzory
sumaryczne i strukturalne
związków chemicznych (C)
Uczeń:
wyjaśnia znaczenie poznanych
praw (B)
liczba godzin
(1 lub 2)
uzależniona od
stopnia
opanowania
materiału
przez uczniów
16
36.37. Obliczenia chemiczne
z zastosowaniem prawa
zachowania masy i prawa
stałości składu związku
chemicznego
zadania z wykorzystaniem
poznanych praw
chemicznych
Uczeń:
stosuje poznane prawa
w prostszych zadaniach (C)
6. Uczymy się pisać
równania reakcji
chemicznych
38.39. Równania reakcji
chemicznych
równanie reakcji
chemicznej
uzgadnianie równań
reakcji chemicznych
modelowe przedstawienie
przebiegu reakcji
chemicznej
Uczeń:
wie, co to jest równanie
reakcji chemicznej
i współczynnik
stechiometryczny (A)
zapisuje i odczytuje prostsze
równania reakcji
chemicznych (C)
Podsumowanie
działu
40.41. Podsumowanie
wiadomości. Sprawdzian
wiadomości. Omówienie
sprawdzianu
Dział III. Woda i roztwory wodne
7. Poznajemy związek chemiczny wodoru i tlenu wodę
Uczeń:
rozwiązuje zadania na
podstawie poznanych praw
(o większym stopniu
trudności) (C)
ustala wzór związku
chemicznego na podstawie
stosunku mas pierwiastków
w tym związku chemicznym
(D)
Uczeń:
zapisuje równania reakcji
chemicznych i odczytuje je
(o większym stopniu
trudności) (C)
17
7.1. Woda
właściwości i rola
w przyrodzie
42. Woda i jej rola
w przyrodzie
występowanie wody
w przyrodzie
stany skupienia wody
rodzaje wód w przyrodzie
obieg wody w przyrodzie
znaczenie wody dla
organizmów
43. Zanieczyszczenia wód
naturalnych zagrożeniem dla
organizmów
czynniki wpływające na
zanieczyszczenia wód
zagrożenia dla
organizmów wynikające
z zanieczyszczeń wód
44. Sposoby usuwania
zanieczyszczeń
oczyszczanie ścieków
uzdatnianie wody
samooczyszczanie wód
Uczeń:
wymienia rodzaje wód
występujących w przyrodzie
(A)
wyjaśnia, jaką wodę nazywa
się destylowaną (B)
omawia obieg wody
w przyrodzie (B)
nazywa stany skupienia
wody (B)
określa przemiany stanów
skupienia wody (C)
wymienia właściwości
wody (A)
określa znaczenie wody dla
organizmów (C)
Uczeń:
wymienia źródła
zanieczyszczeń wód (A)
podaje zagrożenia
wynikające
z zanieczyszczenia wód (C)
opisuje zmiany właściwości
wody pod wpływem
zanieczyszczeń (B)
Uczeń:
wymienia i opisuje etapy
oczyszczania ścieków (B)
potrafi usunąć z wody
niektóre zanieczyszczenia
(C)
wyjaśnia cel uzdatniania
wody (B)
Uczeń:
dokładnie omawia uzdatnianie
wody (C)
wyjaśnia, na czym według
niego może polegać
samooczyszczanie wody (B)
18
7.2. Woda jako
rozpuszczalnik
45. Budowa cząsteczki wody
wzory:
sumaryczny
elektronowy
strukturalny
typy wiązań w cząsteczce
wody
polarna budowa
cząsteczki wody
konsekwencje polarnej
budowy cząsteczki wody
46. Woda jako rozpuszczalnik
pojęcia:
rozpuszczalnik
substancja
rozpuszczona
rozpuszczanie
substancje łatwo i trudno
rozpuszczalne w wodzie
8. Poznajemy różne rodzaje roztworów
8.1. Szybkość
47. Co to jest roztwór?
rozpuszczania się
substancji
pojęcie roztworu
przykłady roztworów
o różnym stanie skupienia
rozpuszczalnika
i substancji rozpuszczanej
Uczeń:
zapisuje wzory sumaryczny
i strukturalny wody (C)
definiuje dipol i cząsteczkę
polarną (A)
wymienia wiązania
występujące w cząsteczce
wody oraz między
cząsteczkami wody (A)
wyjaśnia pojęcie asocjacji
(B)
wymienia konsekwencje
polarnej budowy cząsteczki
wody (B)
Uczeń:
definiuje rozpuszczalnik,
substancję rozpuszczoną
i emulsję (A)
dzieli substancje na łatwo
i trudno rozpuszczalne
w wodzie (B)
wyjaśnia, na czym polega
proces rozpuszczania (B)
wie, dla jakich substancji
woda jest dobrym
rozpuszczalnikiem (B)
Uczeń:
wyjaśnia polarną budowę
cząsteczki wody (C)
opisuje omawiane wiązania
(B)
wyjaśnia konsekwencje
polarnej budowy cząsteczki
wody (C)
Uczeń:
definiuje roztwór (A)
podaje przykłady roztworów
(C)
Uczeń:
analizuje przykłady roztworów
pod względem różnego stanu
skupienia rozpuszczalnika
i substancji rozpuszczonej (D)
Uczeń:
podaje kryteria podziału
substancji na łatwo, trudno
i praktycznie nierozpuszczalne
w wodzie (B)
przedstawia mechanizm
rozpuszczania w wodzie HCl,
NaCl (D)
19
8.2.
Rozpuszczalność
substancji w wodzie
8.2.
Rozpuszczalność
substancji w wodzie
8.3. Rodzaje
roztworów
48. Od czego zależy szybkość
rozpuszczania się substancji?
czynniki wpływające na
szybkość rozpuszczania
się substancji w wodzie:
rozdrobnienie
substancji
rozpuszczanej
temperatura
rozpuszczalnika
mieszanie
Uczeń:
wymienia czynniki
wpływające na szybkość
rozpuszczania się substancji
w wodzie (A)
49. Co to jest i od czego
zależy rozpuszczalność
substancji?
rozpuszczalność
substancji
czynniki wpływające na
rozpuszczalność
substancji w wodzie
50. Analiza wykresów
rozpuszczalności różnych
substancji w wodzie
wykresy rozpuszczalności
– zależność między
ilością substancji
rozpuszczonej
a temperaturą
51.52. Rodzaje roztworów.
Krystalizacja
krystalizacja
roztwór nasycony,
nienasycony, stężony,
rozcieńczony
roztwór właściwy, koloid,
zawiesina
Uczeń:
definiuje rozpuszczalność
(A)
wymienia czynniki, które
wpływają na
rozpuszczalność substancji
(B)
Uczeń:
wie, co to jest wykres
rozpuszczalności (A)
odczytuje z wykresu
rozpuszczalności
rozpuszczalność danej
substancji w określonej
temperaturze (C)
porównuje rozpuszczalność
różnych substancji w tej
samej temperaturze (C)
dokonuje prostych obliczeń
(C)
Uczeń:
omawia proces krystalizacji
(B)
definiuje roztwory
nasycony, nienasycony,
stężony, rozcieńczony (A)
definiuje roztwór właściwy,
koloid, zawiesinę (A)
Uczeń:
przeprowadza doświadczenie
dowodzące wpływu różnych
czynników na szybkość
rozpuszczania się substancji
w wodzie (C)
wyjaśnia, jak te czynniki
wpływają na szybkość
rozpuszczania się substancji
w wodzie (B)
Uczeń:
bada rozpuszczalność
substancji w 100 g wody w
temperaturze pokojowej (C)
Uczeń:
swobodnie korzysta z wykresu
rozpuszczalności (C)
dokonuje obliczeń związanych
z rozpuszczalnością (C)
Uczeń:
podaje rozmiary cząstek
substancji rozpuszczonej dla
roztworu właściwego, koloidu
i zawiesiny (A)
charakteryzuje i porównuje
roztwór właściwy, koloid
i zawiesinę (C)
omówienie
efektu
Tyndalla – do
decyzji
nauczyciela
20
9. Obliczamy
stężenia procentowe
roztworów
53. Stężenie procentowe
roztworu
stężenie procentowe
roztworu
wzór na stężenie
procentowe roztworu
54.55. Obliczanie stężenia
procentowego roztworu
zadania na obliczanie
stężenia procentowego
roztworu
charakteryzuje roztwór
właściwy, koloid, zawiesinę
(wymienia ich podstawowe
cechy), podaje przykłady
roztworu właściwego,
koloidu, zawiesiny (C)
podaje sposoby przemiany
roztworu nasyconego
w nienasycony
i nienasyconego w nasycony
(C)
Uczeń:
definiuje stężenie
procentowe roztworu (A)
podaje wzór na stężenie
procentowe i gęstość
roztworu, wyjaśnia ich
składowe elementy (B)
wykonuje proste obliczenia
z wykorzystaniem wzorów
(C)
Uczeń:
rozwiązuje proste zadania
na stężenie procentowe
roztworu (C)
omawia efekt Tyndalla (B)
(jeśli był omawiany na lecji)
Uczeń:
dokonuje obliczeń
z przekształceniem wzoru
(trudniejsze zadania) (C)
Uczeń:
rozwiązuje zadania na stężenie
procentowe roztworu
o większym stopniu trudności
(C)
rozwiązuje zadania na
mieszanie roztworów (D)
rozwiązuje zadania
z wykorzystaniem gęstości (D)
21
Podsumowanie
działu
56. Sporządzanie roztworów
o określonym stężeniu
procentowym
zasady postępowania przy
sporządzaniu roztworów
o określonym stężeniu
procentowym
57. Stężenie procentowe
roztworu a rozpuszczalność
zależność między
stężeniem procentowym
roztworu
a rozpuszczalnością
substancji
Uczeń:
wymienia zasady
postępowania przy
sporządzaniu roztworów
o określonym stężeniu
procentowym (A)
przygotowuje roztwór
o określonym stężeniu
procentowym (prosty
przykład) (C)
Uczeń:
porównuje definicje
rozpuszczalności i stężenia
procentowego (C)
wykonuje proste obliczenia
(C)
Uczeń:
przygotowuje roztwór
o określonym stężeniu
procentowym (wyższy stopień
trudności) (C)
Uczeń:
definiuje elektrolity
i nieelektrolity (A)
wymienia rodzaje odczynów
roztworów (A)
wie, do czego służą
wskaźniki i zna sposób ich
działania (B)
Uczeń:
bada zjawisko przewodnictwa
prądu przez roztwór podanej
substancji (C)
określa rodzaj substancji za
pomocą wskaźnika (C)
Uczeń:
rozwiązuje zadania
z wykorzystaniem pojęcia
rozpuszczalności i stężenia
procentowego (C)
oblicza rozpuszczalność
substancji w danej
temperaturze na podstawie
stężenia procentowego
roztworu nasyconego tej
substancji w podanej
temperaturze i odwrotnie (D)
swobodnie korzysta z wykresu
rozpuszczalności do
rozwiązywania zadań (C)
58.. Podsumowanie
wiadomości. Sprawdzian
wiadomości. Omówienie
sprawdzianu
Dział IV. Kwasy i wodorotlenki
1. Poznajemy
elektrolity
i nieelektrolity
60. Elektrolity i nieelektrolity
elektrolity
nieelektrolity
wskaźniki odczynu
roztworu
22
zna trzy wskaźniki i ich
zmiany barwy w roztworach
o różnych odczynach (C)
2. Poznajemy kwasy
2.1. Kwas
61. Kwas solny
chlorowodorowy
(chlorowodorowy)
2.2. Kwas
i siarkowodorowy
siarkowodorowy
2.3. Kwas
siarkowy(VI)
2.4. Kwas
siarkowy(IV)
62. Kwasy siarkowy(IV)
i kwas siarkowy(VI)
kwas chlorowodorowy
i siarkowodorowy:
wzory sumaryczny
i strukturalny
modele cząsteczek
otrzymywanie
właściwości
i zastosowania
reszta kwasowa
Uczeń:
zapisuje wzory poznanych
kwasów (C)
zna budowę poznanych
kwasów (B)
definiuje resztę kwasową
(A)
wie, jak otrzymać omawiane
kwasy (B)
zapisuje równania reakcji
otrzymywania poznanych
kwasów (C)
wymienia najważniejsze
właściwości i zastosowania
poznanych kwasów (A)
kwas siarkowy(IV)
kwas siarkowy(VI)
bezwodniki kwasu
siarkowego(IV) i kwasu
siarkowego(VI)
tlenki kwasowe
Uczeń:
zna podział kwasów na
beztlenowe i tlenowe (A)
zapisuje wzory omawianych
kwasów (C)
wyznacza wartościowość
reszty kwasowej
i pierwiastków chemicznych
występujących w kwasie
(C)
opisuje sposoby
otrzymywania H2SO3
i H2SO4 (B)
zapisuje równania reakcji
otrzymywania H2SO3
i H2SO4 (C)
zna pojęcie tlenku
Uczeń:
wskazuje podobieństwo
budowy cząsteczek poznanych
kwasów (C)
wie, jak otrzymać chlorowodór
i siarkowodór (B)
zapisuje równania reakcji
otrzymywania chlorowodoru
i siarkowodoru (C)
wymienia właściwości
i zastosowania poznanych
kwasów (A)
wykonuje i opisuje
doświadczenia otrzymywania
i badania właściwości HCl
i H2S – schemat, obserwacje
i wnioski (D)
Uczeń:
wyjaśnia, dlaczego tak ważne
jest przestrzeganie zasad bhp
podczas pracy z kwasami (B)
wykazuje doświadczalnie
żrące właściwości H2SO4 (C)
podaje właściwości
i zastosowania kwasów (A)
uzasadnia wybrane
zastosowania kwasów ich
odpowiednimi właściwościami
(D)
wyjaśnia, dlaczego roztworu
H2SO3 nie można zatężyć
przez odparowanie wody (D)
opisuje doświadczenia
wykonane na lekcji schemat,
23
2.5. Kwas
azotowy(V)
63. Kwas azotowy(V)
kwas azotowy(V):
wzory sumaryczny
i strukturalny
model cząsteczki
otrzymywanie
właściwości
i zastosowania
reakcja ksantoproteinowa
2.6. Kwas węglowy
2.7. Kwas
fosforowy(V)
64. Kwasy fosforowy (V)
i kwas węglowy
kwas fosforowy(V) i kwas
węglowy:
wzory sumaryczny
i strukturalny
modele cząsteczek
otrzymywanie
właściwości
i zastosowania
kwasowego i bezwodnika
kwasowego (A)
wymienia najważniejsze
właściwości i zastosowania
poznanych kwasów (A)
stosuje zasady bhp podczas
pracy z kwasami (C)
Uczeń:
zapisuje wzory kwasu
azotowego(V) (C)
określa wartościowość
reszty kwasowej
i pierwiastków chemicznych
(C)
wie, jak otrzymać kwas
azotowy(V) (B)
wymienia najważniejsze
właściwości i zastosowania
HNO3 (A)
Uczeń:
zapisuje wzory omawianych
kwasów (C)
określa wartościowość
reszty kwasowej
i pierwiastków
wchodzących w skład
kwasów (C)
zna sposoby otrzymywania
kwasów (B)
zapisuje równanie reakcji
otrzymywania H2CO3 (C)
zna najważniejsze
właściwości i zastosowania
H3PO4 (A)
podaje właściwości H2CO3
obserwacje i wnioski (C)
wykonuje samodzielnie
doświadczenia
przeprowadzone na lekcji (C)
Uczeń:
opisuje metodę przemysłową
otrzymywania HNO3 (D)
zapisuje równania reakcji
otrzymywania HNO3 (C)
podaje właściwości i
zastosowania HNO3 (A)
omawia działanie HNO3 na
białko i miedź (D)
opisuje doświadczenia
wykonane na lekcji schemat,
obserwacje i wnioski (C)
wykonuje samodzielnie
doświadczenia
przeprowadzone na lekcji (C)
Uczeń:
podaje właściwości
i zastosowania kwasów (A)
zapisuje równania reakcji
otrzymywania H3PO4 (C)
opisuje doświadczenia
wykonane na lekcji schemat,
obserwacje i wnioski (C)
wykonuje samodzielnie
doświadczenia
przeprowadzone na lekcji (C)
24
2.8. Dysocjacja
jonowa kwasów
65. Na czym polega
dysocjacja jonowa
(elektrolityczna) kwasów?
3. Poznajemy wodorotlenki
3.1. Wodorotlenek
66. Wodorotlenek sodu,
sodu
wodorotlenek potasu
3.2. Wodorotlenek
potasu
teoria dysocjacji jonowej
dysocjacja jonowa
kwasów
jony:
kation wodoru
anion reszty kwasowej
odczyn kwasowy
wodorotlenek sodu
i wodorotlenek potasu:
wzory sumaryczny
i strukturalny
modele cząsteczek
otrzymywanie
właściwości
i zastosowania
grupa wodorotlenowa
(A)
Uczeń:
definiuje dysocjację jonową
(A)
opisuje dysocjację jonową
kwasów (B)
podaje nazwy jonów
powstających podczas
dysocjacji jonowej kwasów
(B)
zapisuje równania reakcji
dysocjacji jonowej kwasów
(proste przykłady) (C)
podaje nazwy anionów reszt
kwasowych poznanych
kwasów (C)
odczytuje proste równania
dysocjacji kwasów (C)
definiuje odczyn kwasowy
roztworu (A)
Uczeń:
zapisuje wzory sumaryczne
i strukturalne
wodorotlenków (C)
wskazuje we wzorach
wodorotlenków metal
i grupę wodorotlenową (C)
podaje dwie metody
otrzymywania
wodorotlenków (B)
zapisuje równania reakcji
otrzymywania
wodorotlenków (C)
wymienia najważniejsze
właściwości i zastosowania
wodorotlenków (A)
Uczeń:
wie, kto jest twórcą teorii
dysocjacji jonowej (A)
zapisuje i odczytuje równania
reakcji dysocjacji kwasów (C)
potrafi powiązać odczyn
roztworu z obecnością
odpowiednich jonów (C)
analizuje pochodzenie
podobnych właściwości
kwasów (D)
Uczeń:
wyjaśnia pojęcie tlenku
zasadowego (B)
podaje właściwości
i zastosowania wodorotlenków
(A)
wykonuje doświadczenie na
otrzymanie NaOH (C)
wykonuje doświadczenia na
zbadanie właściwości
wodorotlenków (D)
opisuje przeprowadzone
doświadczenia (C)
zapisuje równania reakcji
chemicznych wykonanych
doświadczeń (C)
25
3.3. Wodorotlenek
wapnia
67. Wodorotlenek wapnia
wodorotlenek wapnia:
wzory sumaryczny
i strukturalny
model cząsteczki
otrzymywanie
właściwości
i zastosowania
Uczeń:
zapisuje wzory sumaryczny
i strukturalny Ca(OH)2 (C)
opisuje budowę cząsteczki
Ca(OH)2 (B)
wymienia metody
otrzymywania Ca(OH)2 (B)
zapisuje równanie reakcji
otrzymywania Ca(OH)2 (C)
wymienia najważniejsze
właściwości i zastosowania
Ca(OH)2 (A)
3.4. Przykłady
innych
wodorotlenków
3.7. Podsumowanie
wiadomości o
wodorotlenkach
3.5. Poznajemy
zasady
68. Przykłady innych
wodorotlenków
budowa cząsteczki
wodorotlenków
wodorotlenki: magnezu,
miedzi(II), żelaza(III)
woda amoniakalna
różnica między
wodorotlenkiem a zasadą
Uczeń:
wie, jak są zbudowane
wodorotlenki (B)
definiuje wodorotlenki
i zasady (A)
korzysta z tabeli
rozpuszczalności
wodorotlenki (C)
zapisuje wzory
wodorotlenków (C)
omawia sposób otrzymania
Mg(OH)2
podaje właściwości
i zastosowania Mg(OH)2
wie, że niektórych
wodorotlenków nie można
otrzymać dwiema
poznanymi metodami (B)
3.6. Dysocjacja
jonowa zasad
69. Na czym polega
dysocjacja jonowa zasad?
dysocjacja jonowa zasad
jony:
kationy metalu
aniony
wodorotlenkowe
odczyn zasadowy
Uczeń:
podaje, na czym polega
dysocjacja jonowa zasad (B)
zapisuje proste równania
reakcji dysocjacji (C)
podaje nazwy jonów,
Uczeń:
podaje właściwości Ca(OH)2
(C)
analizuje wybrane
zastosowania Ca(OH)2 ze
względu na jego właściwości
(D)
opisuje doświadczenia
wykonane na lekcji schemat,
obserwacje i wnioski (C)
wykonuje samodzielnie
doświadczenia
przeprowadzone na lekcji (C)
Uczeń:
wyjaśnia różnicę między
wodorotlenkiem a zasadą (C)
sprawnie korzysta z tabeli
rozpuszczalności
wodorotlenki (C)
podaje sposoby otrzymywania
Cu(OH)2 i Fe(OH)3 (D)
opisuje doświadczenia
wykonane na lekcji schemat,
obserwacje i wnioski (C)
proponuje sposób
otrzymywania podanego
wodorotlenku (D)
zapisuje wzór zasady
amonowej (B)
opisuje otrzymywanie,
właściwości i zastosowania
zasady amonowej (C)
Uczeń:
zapisuje i odczytuje równania
reakcji dysocjacji jonowej
zasad (C)
analizuje pochodzenie
wspólnych właściwości zasad
26
4. Poznajemy pH
roztworów
70. Odczyn roztworu, pH
2.9. Podsumowanie
wiadomości o
kwasach
3.7. Podsumowanie
wiadomości o
wodorotlenkach
Podsumowanie
działu
71.72. Podsumowanie
wiadomości. Sprawdzian
wiadomości. Omówienie
sprawdzianu
odczyn roztworu
pH roztworu
skala pH jako miara
odczynu roztworu
odczytuje proste równania
reakcji dysocjacji (C)
określa, które jony
odpowiadają za odczyn
zasadowy (C)
Uczeń:
wymienia rodzaje odczynu
(A)
dostrzega związek odczynu
roztworu z występującymi
w nim jonami (C)
definiuje skalę pH (A)
określa, od czego zależy pH
roztworu (B)
podaje zakres pH dla
każdego odczynu (A)
zbada pH roztworu (C)
wie, jaką reakcję nazywa się
reakcją zobojętniania (A)
(D)
Uczeń:
proponuje sposób zmiany
odczynu roztworu (D)
otrzymuje roztwór obojętny
(C)
Podsumowanie
wiadomości o
kwasach
można zrobić
też wcześniej
– po
omówieniu
kwasów.
27
Dział V. Sole
5. Poznajemy sole
5.1. Wzory i nazwy
soli
5.2. Dysocjacja
jonowa soli
73. Budowa i nazwy soli
budowa soli
ustalanie wzorów
sumarycznych soli
wzór ogólny soli
nazewnictwo soli
74. Ustalanie wzorów soli na
podstawie nazwy i odwrotnie
wzory i nazwy soli
75. Dysocjacja jonowa soli
dysocjacja jonowa soli
jony:
kationy metalu
aniony reszty
kwasowej
6. Poznajemy sposoby otrzymywania soli
Uczeń:
omawia budowę soli (B)
wyróżnia metal i resztę
kwasową (B)
zapisuje wzór ogólny soli
(B)
podaje nazwy soli
pochodzących od podanego
kwasu (C)
podaje nazwy kwasów, od
których pochodzą podane
sole (C)
ustala rodzaj wiązania
między metalem a resztą
kwasową (B)
Uczeń:
wie, że sole występują
w postaci kryształów, a nie
pojedynczych cząsteczek
(A)
podaje nazwy soli oraz
zapisuje ich wzory
sumaryczne i strukturalne
(C)
identyfikuje sole w zbiorze
różnych substancji (C)
Uczeń:
opisuje dysocjację soli (B)
dostrzega związek ładunku
jonu metalu, reszty
kwasowej
z wartościowością (C)
zapisuje i odczytuje proste
równania reakcji dysocjacji
(C)
Uczeń:
wyjaśnia, na czym polega
wiązanie jonowe w solach (C)
Uczeń:
zapisuje wzory i podaje nazwy
soli (trudniejsze przykłady)
(C)
Uczeń:
zapisuje i odczytuje równania
reakcji dysocjacji (C)
28
6.1. Reakcje
zobojętniania
76. Reakcja zobojętniania jako
jeden ze sposobów
otrzymywania soli
reakcja zobojętniania
jeden ze sposobów
otrzymywania soli
cząsteczkowy, jonowy,
jonowy skrócony zapis
równania reakcji
chemicznej
6.2. Reakcje metali
z kwasami
77. Otrzymywanie soli
w reakcji metali z kwasami
reakcja metalu aktywnego
z kwasem – jeden ze
sposobów otrzymywania
soli
wodór i sól – produkty
reakcji metalu aktywnego
z kwasem
sprawdzanie, czy metale
nieaktywne, np. miedź,
reagują z kwasami
szereg aktywności metali
6.3. Reakcje tlenków
metali z kwasami
78. Otrzymywanie soli
w reakcji tlenków metali
z kwasami
reakcja tlenków metali
z kwasami jeden ze
sposobów otrzymywania
soli
Uczeń:
definiuje reakcję
zobojętniania (A)
wie, że sole można
otrzymywać w reakcji
zobojętniania (B)
wyjaśnia rolę wskaźnika
w reakcji zobojętniania (B)
podaje zapis ogólny
przebiegu reakcji
zobojętniania (A)
wie, jaki zapis reakcji
nazywa się cząsteczkowym,
jonowym, skróconym
jonowym (B)
zapisuje proste równania (3
formy) reakcji zobojętniania
(C)
Uczeń:
podaje zapis ogólny
przebiegu reakcji metalu
aktywnego z kwasem (A)
wie, że można ją stosować
do otrzymywania soli (B)
zapisuje i odczytuje prostsze
równania reakcji metali
z kwasami (C)
wyjaśnia, co to jest szereg
aktywności metali (B)
podaje zastosowanie
szeregu aktywności metali
(B)
Uczeń:
podaje zapis ogólny
przebiegu reakcji tlenków
metali z kwasami (A)
Uczeń:
zapisuje i odczytuje równania
reakcji (3 formy) zobojętniania
(C)
proponuje substraty reakcji
zobojętniania potrzebne do
otrzymania danej soli (D)
przeprowadza zaproponowaną
przez siebie reakcję chemiczną
(D)
wyjaśnia zmianę odczynu
roztworu w reakcji
zobojętniania (B)
Uczeń:
zapisuje i odczytuje równania
reakcji kwasów z metalami (C)
wyjaśnia istotę reakcji kwasów
z metalami (B)
wie, które metale reagują
według omawianego schematu
(B)
korzysta z szeregu aktywności
metali (C)
przewiduje, czy dana reakcja
chemiczna zachodzi (D)
przeprowadza reakcję kwasów
z metalami (C)
identyfikuje gazowy produkt
reakcji chemicznej (C)
Uczeń:
zapisuje i odczytuje równania
reakcji tlenków metali
z kwasami (C)
29
6.4. Inne sposoby
otrzymywania soli
79. Inne sposoby
otrzymywania soli
inne sposoby
otrzymywania soli:
reakcja metalu
z niemetalem
reakcja tlenku
zasadowego
z tlenkiem kwasowym
reakcja tlenku
kwasowego z zasadą
wie, że reakcje tlenków
metali z kwasami można
zastosować do
otrzymywania soli (B)
zapisuje i odczytuje proste
równania reakcji
chemicznych (C)
Uczeń:
zna jedną z omawianych
metod i potrafi ją
zastosować w zadaniach
(C)
zapisuje równania reakcji
(C)
odróżnia tlenki kwasowe od
tlenków zasadowych (C)
definiuje bezwodnik
kwasowy (A)
opisuje doświadczenia
przeprowadzone na lekcji,
potrafi je przeprowadzić (C)
proponuje i przeprowadza
reakcję otrzymywania danej
soli tą metodą (D)
Uczeń:
wymienia poznane sposoby
otrzymywania soli (B)
wymienia produkty
omawianych reakcji
chemicznych (B)
zapisuje i odczytuje równania
reakcji otrzymywania soli
podanymi metodami (C)
proponuje sposób otrzymania
podanej soli (D)
projektuje doświadczenie do
podanej propozycji (D)
wykonuje zaprojektowane
doświadczenie (D)
30
80. Otrzymywanie soli trudno
rozpuszczalnych
sole trudno rozpuszczalne
powstawanie soli trudno
rozpuszczalnych jako
łączenie się odpowiednich
jonów
cząsteczkowy, jonowy,
jonowy skrócony zapis
równania reakcji
powstawania soli trudno
rozpuszczalnej
analiza tabeli
rozpuszczalności
Uczeń:
podaje podział soli (A)
wyjaśnia, co to są sole
trudno rozpuszczalne (B)
korzysta z tabeli
rozpuszczalności (C)
definiuje reakcję
strąceniową (A)
zapisuje i odczytuje proste
równania reakcji
strąceniowych (C)
5.3. Elektroliza soli
81. Elektroliza wodnych
roztworów soli
elektroliza soli:
mechanizm elektrolizy
reakcje elektrodowe
produkty elektrolizy
zastosowania elektrolizy
7. Poznajemy
zastosowania soli
82. Podsumowanie
wiadomości. Sole wokół nas
zastosowania wybranych
soli
sole szkodliwe dla
zdrowia i życia człowieka
utrwalenie wiadomości
o solach
Uczeń:
definiuje elektrolizę, katodę,
anodę, kation i anion (A)
wyjaśnia, na czym polegają
reakcje elektrodowe (B)
ustala produkty elektrolizy
wodnego roztworu CuCl2
(C)
wymienia najważniejsze
zastosowania elektrolizy (A)
Uczeń:
podaje przykłady
występowania
i zastosowania
najważniejszych soli (B)
8. Obliczenia chemiczne
Uczeń:
swobodnie korzysta z tabeli
rozpuszczalności (C)
przewiduje wynik reakcji
chemicznej na podstawie
informacji z tabeli
rozpuszczalności (D)
proponuje reakcję
otrzymywania danej soli
trudno rozpuszczalnej (D)
projektuje doświadczenie do
podanej propozycji (D)
wykonuje zaprojektowane
doświadczenie (D)
zapisuje równania reakcji
(zapis cząsteczkowy, jonowy,
jonowy skrócony) (C)
podaje zastosowania reakcji
strąceniowych (C)
Uczeń:
zapisuje i omawia równania
reakcji elektrodowych (C)
określa zastosowania
elektrolizy (C)
Uczeń:
wymienia przykłady
występowania i zastosowania
soli (A)
identyfikuje sole na podstawie
podanych informacji (D)
wymienia sole szkodliwe dla
zdrowia człowieka (C)
tematy
31
8.1. Pojęcie mola
8.2. Masa molowa
8.3. Obliczenia
stechiometryczne
83. Pojęcie mola i masy
molowej
Podsumowanie
działu
84.85. Sprawdzian
wiadomości. Omówienie
sprawdzianu
mol
masa molowa
Uczeń:
definiuje mol i masę
molową (A)
podaje masę molową (C)
wykonuje proste obliczenia
(C)
Uczeń:
korzysta z poznanych pojęć
przy obliczeniach (C)
skład pierwiastkowy
skorupy ziemskiej
porównanie składów
pierwiastkowych skorupy
ziemskiej, Ziemi
i Wszechświata
surowce mineralne
Uczeń:
definiuje skorupę ziemską,
minerały, skały i surowce
mineralne (A)
wymienia nazwy
najważniejszych
pierwiastków chemicznych
występujących w skorupie
ziemskiej, Ziemi i we
Wszechświecie (A)
dokonuje podziału
surowców mineralnych (B)
podaje przykłady surowców
każdego rodzaju (B)
Uczeń:
wymienia nazwy skał
wapiennych (A)
podaje nazwę i wzór
głównego składnika skał
wapiennych (B)
zapisuje reakcję
charakterystyczną wapieni
(C)
wyjaśnia, co to są: wapno
palone, gaszone, zaprawa
Uczeń:
porównuje skład
pierwiastkowy skorupy
ziemskiej, Ziemi
i Wszechświata (C)
Dział VI. Surowce i tworzywa
9. Poznajemy surowce pochodzenia mineralnego
9.1. Skład
86. Skład pierwiastkowy
chemiczny skorupy
skorupy ziemskiej
ziemskiej
9.2. Skały wapienne,
ich właściwości
i zastosowania
87. Skały wapienne
skały wapienne:
wapień
kreda
marmur
węglan wapnia – główny
składnik skał wapiennych
reakcja charakterystyczna
wapieni
zastosowania wapieni
Uczeń:
zapisuje i objaśnia równania
reakcji od skał wapiennych do
zaprawy murarskiej (C)
wyjaśnia, na czym polega
twardnienie zaprawy
murarskiej, zapisuje równanie
reakcji (C)
projektuje doświadczenie
udowadniające, że skały
wapienne zawierają węglan
nadobowiązko
- we
tematy
nadobowiązko
-we
32
9.3. Skały gipsowe,
ich właściwości
i zastosowania
88. Skały gipsowe
skały gipsowe
siarczan(VI) wapnia
główny składnik skał
gipsowych
hydraty – sole uwodnione
gips krystaliczny i gips
palony
zastosowania gipsu
palonego
9.4. Tlenek
krzemu(IV), jego
odmiany
i zastosowania
9.5. Szkło
89.Tlenek krzemu(IV),
zastosowanie w produkcji
szkła
tlenek krzemu(IV) jako
składnik minerałów
właściwości
i zastosowania krzemionki
budowa wewnętrzna szkła
murarska (wapienna) (B)
zapisuje wzory wapna
palonego i gaszonego (C)
wymienia najważniejsze
właściwości wapna
palonego i gaszonego (A)
zapisuje równanie reakcji
otrzymywania wapna
palonego i wapna
gaszonego (C)
wyjaśnia, na czym polega
twardnienie zaprawy
murarskiej (B)
wymienia najważniejsze
zastosowania wapieni (A)
Uczeń:
wymienia nazwy skał
gipsowych (A)
podaje nazwę i wzór
głównego składnika skał
gipsowych (B)
definiuje hydraty (A)
podaje różnice między
gipsem krystalicznym
a gipsem palonym (B)
opisuje sposób otrzymania
gipsu palonego z gipsu
krystalicznego (B)
wyjaśnia, na czym polega
twardnienie gipsu palonego
(B)
podaje najważniejsze
zastosowania gipsu (A)
Uczeń:
zapisuje wzory tlenku
krzemu(IV) (C)
wymienia minerały,
w których występuje tlenek
wapnia (D)
projektuje doświadczenie,
udowadniające, że mamy do
czynienia ze „starym” tynkiem
(zawiera CaCO3) (D)
wymienia zastosowania
omawianych substancji (A)
Uczeń:
zapisuje równania reakcji
otrzymywania gipsu palonego
(C)
zapisuje i omawia równanie
reakcji twardnienia zaprawy
gipsowej (C)
omawia zastosowania gipsu
(A)
Uczeń:
omawia dokładnie produkcję
szkła (C)
porównuje substancje
krystaliczne i bezpostaciowe
9.6. Gleba i jej
właściwości
w przypadku
5 godzin
w cyklu
33
rodzaje i zastosowania
szkła
9.7. Metale
90. Metale
10. Poznajemy surowce energetyczne
10.1. Węgle kopalne 91. Surowce energetyczne
10.2. Ropa naftowa
węgle kopalne, gaz ziemny,
i gaz ziemny
ropa naftowa
wspólne i różniące
właściwości metali
metody otrzymywania
metali
korozja metali
stopy metali
powstawanie złóż węgla
podział węgli kopalnych
zastosowania węgli
kopalnych
powstawanie ropy
naftowej i gazu ziemnego
produkty destylacji
frakcjonowanej ropy
krzemu(IV) (A)
wymienia właściwości
i zastosowania krzemionki
(A)
podaje cechy substancji
bezpostaciowej (B)
zna podstawowe surowce do
produkcji szkła (A)
opisuje przebieg produkcji
szkła (B)
wymienia właściwości
i zastosowania szkła (A)
Uczeń:
wymienia postaci metali
występujące w przyrodzie
(A)
definiuje rudy i stopy metali
(A)
podaje przykłady rud
i stopów metali (C)
wyjaśnia, na czym polega
korozja metali (B)
wymienia właściwości
metali (B)
podaje sposób
otrzymywania metali z ich
rud (B)
zapisuje proste równania
reakcji chemicznych (C)
(C)
wymienia rodzaje szkła
i podaje ich zastosowania (C)
Uczeń:
określa, jak powstają złoża
węgli kopalnych, gazu
ziemnego i ropy naftowej
(C)
podaje właściwości ropy
naftowej (A)
wyjaśnia podział węgli
Uczeń:
bada właściwości fizyczne
ropy naftowej i jej palność (C)
omawia proces destylacji ropy
naftowej (B)
porównuje frakcje ropy
naftowej (C)
określa zastosowania
Uczeń:
określa istotę otrzymywania
metali z ich rud – znaczenie
reakcji redukcji (C)
porównuje właściwości
różnych metali (C)
objaśnia proces
wielkopiecowy (C)
zapisuje równania reakcji
otrzymywania metali z ich
związków chemicznych (C)
analizuje problem dlaczego
częściej zamiast czystych
metali używane są ich stopy
(D)
nauczania
34
naftowej
zastosowania ropy
naftowej i gazu ziemnego
10.1. Węgle kopalne
10.2. Ropa naftowa
i gaz ziemny
10.3. Alternatywne
źródła energii
92. Węgiel kamienny.
Alternatywne źródła energii
Podsumowanie
działu
93.94. Podsumowanie
wiadomości. Sprawdzian
wiadomości. Omówienie
sprawdzianu.
węgiel kamienny jako
paliwo
produkty suchej destylacji
węgla kamiennego
wyczerpywanie się
zasobów surowców
energetycznych i ochrona
środowiska
przyrodniczego
przykłady alternatywnych
źródeł energii
kopalnych (C)
wyjaśnia pojęcie destylacji
frakcjonowanej (B)
definiuje węglowodory (A)
wymienia produkty
destylacji ropy naftowej (A)
wymienia zastosowania
omawianych surowców (B)
Uczeń:
wyjaśnia, na czym polega
sucha destylacja węgla
kamiennego (B)
wymienia produkty suchej
destylacji węgla
kamiennego i niektóre ich
zastosowania (A)
podaje przykłady wpływu
na środowisko przyrodnicze
działalności człowieka
związanej
z wykorzystywaniem
surowców energetycznych
(C)
podaje przykłady rozwiązań
mających na celu ochronę
środowiska przyrodniczego
przed wpływem działalności
człowieka (C)
wymienia alternatywne
źródła energii (A)
produktów destylacji
frakcjonowanej ropy naftowej
(C)
Uczeń:
wymienia produkty suchej
destylacji węgla kamiennego
i ich niektóre zastosowania (C)
omawia zasoby surowców
energetycznych (C)
analizuje skutki
wykorzystywania ich przez
człowieka (D)
wyjaśnia przyczyny
poszukiwania nowych źródeł
energii (C)
przedyskutowuje problemy
ekologiczne związane
z wydobywaniem
i wykorzystywaniem
surowców energetycznych (D)
omawia alternatywne źródła
energii (C)
Dział VII. Węgiel i jego związki z wodorem
1. Poznajemy
odmiany węgla
pierwiastkowego
95. Węgiel pierwiastkowy
właściwości węgla jako
pierwiastka chemicznego
występowanie węgla
Uczeń:
wyjaśnia, czym się zajmuje
chemia organiczna (B)
Uczeń:
analizuje budowę diamentu
i grafitu i wyjaśnia jej
35
2. Poznajemy węglowodory nasycone
2.2. Metan
96. Metan – główny składnik
gazu ziemnego
2.1. Szereg
homologiczny
alkanów
2.3. Właściwości
97. Szereg homologiczny
węglowodorów nasyconych
(alkanów)
w przyrodzie w stanie
wolnym, w związkach
nieorganicznych
i organicznych
podaje informacje o węglu
na podstawie jego położenia
w układzie okresowym (C)
definiuje zjawisko alotropii
(A)
wymienia odmiany
alotropowe węgla (A)
podaje właściwości odmian
alotropowych węgla (B)
wykrywa węgiel
w substancjach
organicznych (C)
konsekwencje (D)
podaje informacje na temat
fulerenów (B)
wykrywa węgiel i wodór
w związkach organicznych (C)
metan jako składnik gazu
ziemnego
właściwości metanu
zależność przebiegu
spalania metanu od ilości
tlenu
Uczeń:
wyjaśnia, jakie związki
chemiczne nazywa się
węglowodorami (B)
zna skład i zastosowania
gazu ziemnego (A)
rozumie zasady
obchodzenia się z gazem
ziemnym (B)
zapisuje wzory sumaryczny
i strukturalny metanu (B)
buduje model cząsteczki
metanu (C)
wymienia właściwości
i zastosowania metanu (A)
wie, na czym polega
spalanie całkowite
i niecałkowite (B)
zapisuje i odczytuje
równania reakcji spalania
dla metanu (C)
Uczeń:
wyjaśni pojęcia:
węglowodory nasycone,
alkany i szereg
Uczeń:
bada doświadczalnie rodzaje
produktów spalania metanu
(C)
węglowodory nasycone
szereg homologiczny
alkany:
nazewnictwo
Uczeń:
zapisuje równania reakcji
spalania dowolnego alkanu (C)
analizuje zmiany właściwości
36
alkanów
3. Poznajemy węglowodory nienasycone
3.1. Szeregi
98. Węglowodory nienasycone
homologiczne
(alkeny i alkiny)
alkenów i alkinów
3.2. Eten
99. Eten (etylen)
przedstawiciel alkenów
wzory sumaryczne,
półstrukturalne
i strukturalne
wzór ogólny
zastosowania alkanów
szereg homologiczny
węglowodorów
nasyconych:
zmiany właściwości
fizycznych w szeregu
homologicznym
homologiczny (B)
zapisuje wzór ogólny
alkanów (B)
rozróżnia wzory
sumaryczne, strukturalne
i półstrukturalne (B)
podaje nazwy, wzory
sumaryczne, półstrukturalne
i strukturalne alkanów (C)
buduje model cząsteczki
podanego alkanu (C)
w szeregu homologicznym (D)
węglowodory
nienasycone
alkeny:
wzór ogólny
wzory
nazewnictwo
alkiny:
wzór ogólny
wzory
nazewnictwo
Uczeń:
wyjaśnia, co to są
węglowodory nienasycone
(B)
definiuje alkeny, alkiny (A)
podaje wzory ogólne
alkenów i alkinów (B)
zapisuje wzory alkenów
i alkinów (C)
stosuje zasady nazewnictwa
(C)
oblicza masy cząsteczkowe
węglowodorów (C)
Uczeń:
zapisuje wzory sumaryczny
i strukturalny etenu (C)
buduje model cząsteczki
etenu (C)
wie, jak otrzymać eten (B)
wymienia właściwości etenu
(A)
wyjaśni pojęcia monomer,
polimer, reakcje
polimeryzacji i reakcja
przyłączania (B)
zapisuje równania reakcji
Uczeń:
buduje model cząsteczki
dowolnego alkenu i alkinu (C)
eten:
budowa cząsteczki
otrzymywanie
właściwości fizyczne
i chemiczne
zastosowania
Uczeń:
otrzymuje eten i bada jego
właściwości (C)
zapisuje równania reakcji
otrzymywania etenu, reakcji
przyłączania i polimeryzacji
(C)
analizuje właściwości
i budowę cząsteczki etenu (D)
37
3.3. Etyn
100. Etyn (acetylen)
przedstawiciel alkinów
etyn (acetylen):
budowa cząsteczki
otrzymywanie
właściwości fizyczne
i chemiczne
zastosowania
3.2. Eten
3.5. Tworzywa
sztuczne
101. Polietylen jako
przedstawiciel tworzyw
sztucznych
tworzywa sztuczne:
przykłady
otrzymywanie
w procesie
polimeryzacji
2.3. Właściwości
alkanów
3.4. Właściwości
alkenów i alkinów
102. Porównanie budowy
cząsteczek i właściwości
alkanów, alkenów
i alkinów
porównanie budowy
cząsteczek alkanów,
alkenów, alkinów
porównanie aktywności
chemicznej
węglowodorów
najważniejsze
zastosowania
węglowodorów
spalania etenu (C)
wie, jak doświadczalnie
odróżnić węglowodory
nasycone od nienasyconych
(B)
podaje zastosowania etenu
(A)
Uczeń:
zapisuje wzory etynu (C)
wie, jak otrzymać etyn (B)
wymienia właściwości
etynu (A)
zapisuje równania reakcji
spalania etynu (C)
podaje zastosowania etynu
(A)
Uczeń:
wymienia przykłady
tworzyw sztucznych (A)
podaje, w jakiej reakcji
chemicznej można niektóre
z nich otrzymać (B)
wyjaśni pojęcia monomer,
polimer (B)
podaje przykłady
zastosowania tworzyw
sztucznych (B)
Uczeń:
zapisuje wzory ogólne
węglowodorów (B)
zapisuje wzory prostszych
węglowodorów
(sumaryczne, strukturalne,
półstrukturalne) i podaje ich
nazwy (C)
wymienia różnice
w budowie alkanów,
Uczeń:
otrzymuje etyn i bada jego
właściwości (C)
zapisuje równania reakcji
otrzymywania etynu (C)
zapisuje równania reakcji
przyłączania i polimeryzacji
etynu (D)
analizuje budowę cząsteczki
etynu i jej konsekwencje (D)
Uczeń:
określa, jakie substancje mogą
ulegać polimeryzacji (C)
omawia budowę polimeru (B)
analizuje zalety i wady
tworzyw sztucznych (D)
Uczeń:
wyjaśnia od czego zależy
rodzaj produktów spalania
węglowodorów (B)
zapisuje wzory dowolnego
węglowodoru (C)
zapisuje dla dowolnego
węglowodoru równania
reakcji:
spalania (C)
38
Podsumowanie
działu
alkenów, alkinów (B)
doświadczalnie wykrywa
węgiel w węglowodorach
(C)
opisuje doświadczalny
sposób odróżnienia
węglowodorów
nienasyconych od
nasyconych (C)
zapisuje równania reakcji
spalania całkowitego
i niecałkowitego
węglowodorów (proste
przykłady) (C)
porównuje aktywność
chemiczną węglowodorów
z obecnością w ich
cząsteczce wiązań
wielokrotnych (C)
wie, dla jakich
węglowodorów zachodzi
reakcja polimeryzacji
i przyłączania (B)
wymienia zastosowania
węglowodorów (A)
przyłączania, polimeryzacji
(C)
doświadczalnie odróżnia
węglowodory nasycone od
nienasyconych (C)
analizuje zależność
właściwości chemicznych
węglowodorów od ich budowy
(D)
Uczeń:
rozumie pojęcie
pochodnych węglowodorów
(B)
wyjaśnia budowę
pochodnych (rodnik – grupa
węglowodorowa, grupa
Uczeń:
wyjaśnia, dlaczego alkohole
nazywa się pochodnymi
węglowodorów (B)
zna nazwy alkili (B)
zapisuje wzory i podaje nazwy
alkoholi (C)
103.104. Podsumowanie
wiadomości. Sprawdzian
wiadomości. Omówienie
sprawdzianu
Dział VIII. Pochodne węglowodorów
4. Poznajemy alkohole
4.1. Szereg
105. Szereg homologiczny
homologiczny
alkoholi jako pochodnych
alkoholi
węglowodorów
pochodne węglowodorów
grupa węglowodorowa i
grupa hydroksylowa
alkohole:
szereg homologiczny
nazewnictwo
wzór ogólny
39
4.2. Metanol
4.3. Etanol
14. Substancje silnie
działające na
organizm człowieka
106. Metanol i etanol
metanol i etanol
właściwości
i zastosowania
fermentacja alkoholowa
alkoholizm – choroba
społeczna
4.4. Glicerol
4.5. Właściwości
alkoholi
107. Glicerol (propanotriol).
alkohole monoi polihydroksylowe
glicerol:
wzory sumaryczne,
półstrukturalne
i strukturalne
właściwości
funkcyjna) (B)
opisuje budowę alkoholi (B)
zna zasady tworzenia nazw
systematycznych alkoholi
(B)
zapisuje wzór ogólny
alkoholi (B)
zapisuje wzory
(sumaryczne, strukturalne,
półstrukturalne) czterech
pierwszych alkoholi
w szeregu homologicznym
i podaje ich nazwy (C)
Uczeń:
zapisuje wzory metanolu
i etanolu (C)
wskazuje rodnik i grupę
hydroksylową (C)
opisuje fermentację
alkoholową (B)
wymienia podstawowe
właściwości etanolu
i metanolu (A)
wie, że metanol jest trucizną
(A)
zna najważniejsze
zastosowania etanolu (A)
zapisuje równania reakcji
spalania etanolu i metanolu
(C)
Uczeń:
dzieli alkohole na monoi polihydroksylowe (A)
zna kryteria podziału
alkoholi (B)
podaje przykłady alkoholi
mono- i
dowodzi, że alkohole tworzą
szereg homologiczny (D)
Uczeń:
określa właściwości fizyczne
i chemiczne metanolu i etanolu
(C)
wyjaśnia, dlaczego, mimo
obecności grupy –OH, roztwór
etanolu ma odczyn obojętny
(C)
zapisuje równanie reakcji
fermentacji alkoholowej
i spalania (C)
zanalizuje zastosowania
etanolu, powiąże je z jego
właściwościami (D)
opisuje i samodzielnie
wykonuje doświadczenia
przeprowadzone na lekcji (C)
wykrywa obecność etanolu (D)
Uczeń:
zna nazwy systematyczne
glicerolu i glikolu
etylenowego, wyjaśnia ich
pochodzenie (C)
dostrzega związek właściwości
glicerolu z jego
40
i zastosowania
5. Poznajemy kwasy karboksylowe
5.1. Szereg
108. Szereg homologiczny
homologiczny
kwasów karboksylowych.
kwasów
karboksylowych
5.2. Kwas metanowy
5.3. Kwas etanowy
109.110. Kwas mrówkowy
i octowy
kwasy karboksylowe:
grupa węglowodorowa
i grupa karboksylowa
reszta kwasowa
szereg homologiczny
nazewnictwo
wzór ogólny
kwas mrówkowy i kwas
octowy:
wzory sumaryczne,
półstrukturalne
i strukturalne
fermentacja octowa
właściwości
i zastosowania
polihydroksylowych (B)
zapisuje wzory glicerolu
i glikolu etylenowego (C)
wymienia właściwości
i zastosowania glicerolu (A)
zastosowaniami (C)
zapisuje równania reakcji
spalania glicerolu (C)
Uczeń:
rozumie, że kwasy
karboksylowe są
pochodnymi węglowodorów
(B)
zna budowę kwasów
karboksylowych (B)
opisuje zasady nazewnictwa
systematycznego (B)
zna nazwy zwyczajowe
najważniejszych kwasów
karboksylowych (A)
zapisuje wzór ogólny
kwasów karboksylowych
(B)
zapisuje wzory czterech
pierwszych kwasów
karboksylowych w szeregu
homologicznym (C)
wskazuje we wzorze rodnik,
grupę karboksylową i resztę
kwasową (C)
Uczeń:
zapisuje wzory omawianych
kwasów karboksylowych
(C)
opisuje fermentację octową
(B)
wymienia najważniejsze
właściwości kwasów
mrówkowego i octowego
(A)
Uczeń:
zna nazwy zwyczajowe
kwasów karboksylowych (A)
udowadnia, że kwasy
karboksylowe tworzą szereg
homologiczny (D)
zapisuje wzór dowolnego
kwasu karboksylowego i jego
nazwę systematyczną (C)
porównuje budowę kwasów
organicznych
i nieorganicznych (C)
Uczeń:
określa właściwości
omawianych kwasów
karboksylowych (C)
wyjaśnia, odczyn roztworu
kwasów mrówkowego i
octowego (B)
powiąże zastosowania kwasu
octowego z jego
właściwościami (C)
41
5.4. Wyższe kwasy
karboksylowe
111. Wyższe kwasy
karboksylowe (stearynowy,
oleinowy)
niższe i wyższe kwasy
karboksylowe
wzory kwasów
palmitynowego,
stearynowego i
oleinowego
właściwości kwasów
stearynowego i
oleinowego
mydła
mechanizm mycia i prania
wie, że kwas mrówkowy
jest trucizną (A)
zapisuje równania reakcji
kwasów mrówkowego
i octowego, np. z: Mg, CuO,
NaOH (C)
podaje nazwy soli tych
kwasów (C)
zapisuje równania
dysocjacji kwasów
mrówkowego i octowego
(podaje nazwy anionów) (C)
wymienia zastosowania
wybranych kwasów
karboksylowych (A)
Uczeń:
dokonuje podziału kwasów
karboksylowych na niższe
i wyższe, nasycone
i nienasycone (B)
podaje przykłady
odpowiednich kwasów
karboksylowych (C)
zapisuje wzory sumaryczne
kwasów:
palmitynowego
stearynowego
oleinowego (B)
wskazuje rodnik, grupę
karboksylową i resztę
kwasową w cząsteczce
kwasu karboksylowego (C)
wymienia najważniejsze
właściwości kwasów
stearynowego i oleinowego
(A)
opisuje doświadczalny
sposób odróżnienia kwasu
zapisuje równania reakcji:
fermentacji octowej
spalania
z innymi substancjami (C)
analizuje właściwości
omawianych kwasów
i kwasów nieorganicznych (D)
opisuje i samodzielnie
wykonuje doświadczenia
przeprowadzone na lekcji (C)
proponuje sposób otrzymania
podanej soli (D)
Uczeń:
wyjaśnia, dlaczego wyższe
kwasy karboksylowe
nazywane są kwasami
tłuszczowymi (B)
wie, gdzie znajduje się
wiązanie podwójne
w cząsteczce kwasu
oleinowego (A)
wyjaśnia, na czym polega
utwardzanie tłuszczu ciekłego
(B)
zapisuje równania reakcji:
kwasu oleinowego
z bromem
otrzymywania stearynianu
sodu
dla kwasu stearynowego
(C)
określa, jaką wodę nazywa się
wodą twardą (C)
wyjaśnia mechanizm mycia
i prania (D)
42
5.5. Właściwości
kwasów
karboksylowych
112. Porównywanie
właściwości kwasów
karboksylowych
porównywanie:
budowy cząsteczek
poznanych kwasów
karboksylowych
właściwości
6. Poznajemy estry
113. Estry
estry:
produkty reakcji
cząsteczek kwasów
karboksylowych
z cząsteczkami
alkoholi
mechanizm i warunki,
w jakich zachodzi
reakcja estryfikacji
budowa cząsteczek
właściwości
i zastosowania
nasyconego od
nienasyconego (C)
definiuje mydła (A)
zna sposób otrzymywania
mydeł (B)
opisuje zachowanie się
mydła w wodzie twardej (C)
Uczeń:
wie, że właściwości kwasów
karboksylowych zależą od
długości łańcucha
węglowego (A)
podaje zmiany niektórych
właściwości w szeregu
homologicznym (B)
wie, że na właściwości
kwasów karboksylowych
ma wpływ stan nasycenia
(A)
porównuje właściwości
kwasów oleinowego
i stearynowego (C)
Uczeń:
definiuje reakcję
hydrolizy, estry (A)
wyjaśnia pojęcie reakcji
estryfikacji (B)
zapisuje wzór ogólny estrów
(wskazuje grupę funkcyjną
i podaje jej nazwę) (B)
podaje przykłady
występowania estrów
w przyrodzie oraz ich
zastosowania (B)
wie, jak otrzymać np. octan
etylu (B)
zapisuje równanie reakcji
otrzymywania octanu etylu
analizuje zachowanie mydła
(stearynian sodu) w wodzie
twardej (D)
opisuje i samodzielnie
wykonuje doświadczenia
przeprowadzone na lekcji (C)
Uczeń:
porównuje właściwości
kwasów karboksylowych
w szeregu homologicznym (C)
zapisuje równania reakcji,
projektuje doświadczenia
dotyczące właściwości
chemicznych kwasów
karboksylowych (D)
Uczeń:
wyjaśnia mechanizm reakcji
estryfikacji (B)
podaje warunki, w jakich
zachodzi estryfikacja (B)
zapisuje równania reakcji
otrzymywania estrów,
hydrolizy estrów (C)
nazywa estry (C)
zapisuje wzory estrów (C)
udowadnia różnicę między
reakcją zobojętniania
a estryfikacją (D)
przeprowadza reakcję
estryfikacji (C)
43
(C)
podaje właściwości octanu
etylu (A)
podaje nazwy prostych
estrów (C)
7. Poznajemy inne pochodne węglowodorów
7.1. Aminy
114. Inne pochodne
7.2. Aminokwasy
węglowodorów – aminy,
aminokwasy
Podsumowanie
działu
aminy i aminokwasy:
budowa,
wzory
właściwości
występowanie
Uczeń:
wie, co to są aminy,
aminokwasy (A)
zapisuje wzory ogólne amin
i aminokwasów (B)
wskazuje i nazywa grupy
funkcyjne (B)
podaje występowanie amin
i aminokwasów (A)
wymienia właściwości amin
i aminokwasów (A)
zapisuje wzór najprostszej
aminy (C)
Uczeń:
dowodzi, że aminy można
traktować jako pochodne
węglowodorów, a także
amoniaku (D)
zapisuje wzory poznanych
amin i aminokwasów (C)
analizuje konsekwencje
obecności dwóch grup
funkcyjnych w aminokwasach
(D)
zapisuje równanie reakcji
chemicznej i wyjaśnia
tworzenie się dipeptydu (D)
115.116. Podsumowanie
wiadomości. Sprawdzian
wiadomości. Omówienie
sprawdzianu
Dział IX. Związki chemiczne w życiu codziennym
8. Poznajemy
składniki chemiczne
żywności
117. Podstawowe składniki
żywności i ich rola
w organizmie
skład chemiczny
organizmu człowieka
składniki pokarmowe:
budulcowe, energetyczne,
regulujące – ich źródła
i rola w organizmie
człowieka
zasady prawidłowego
żywienia
9. Poznajemy
118. Tłuszcze
podział tłuszczów ze
Uczeń:
wymienia główne składniki
organizmów (A)
wymienia podstawowe
składniki żywności i ich
źródła (B)
określa rolę składników
żywności w organizmie (C)
wie, co to są makroi mikroelementy (B)
określa zasady
prawidłowego żywienia (C)
Uczeń:
Uczeń:
44
tłuszcze
9.1. Rodzaje
tłuszczów i ich
otrzymywanie
9.2. Właściwości
tłuszczów
10. Poznajemy
białka
10.1. Występowanie,
skład i budowa
białek
10.2. Właściwości
białek
119. Białka
względu na pochodzenie
i stan skupienia
właściwości fizyczne
tłuszczów
tłuszcze – estry glicerolu
i wyższych kwasów
tłuszczowych
reakcja zmydlania
tłuszczu
wymienia skład
pierwiastkowy tłuszczów
(A)
wykrywa węgiel
w tłuszczach (C)
dzieli tłuszcze i podaje ich
przykłady (C)
wymienia właściwości
fizyczne tłuszczów (A)
definiuje hydrolizę (A)
określa, czym są tłuszcze
(B)
zapisuje słownie przebieg
reakcji:
otrzymywania tłuszczu
hydrolizy tłuszczu
zmydlania tłuszczu (B)
opisuje zachowanie oleju
roślinnego wobec wody
bromowej (B)
białka:
skład pierwiastkowy
podział na proste
i złożone
reakcje
charakterystyczne
biuretowa
i ksantoproteinowa
wpływ różnych
czynników na białka
Uczeń:
wymienia skład
pierwiastkowy białek (A)
dzieli białka (B)
wie, z czego powstają białka
(B)
wykrywa węgiel w białkach
(C)
podaje przykłady
występowania białek (B)
zalicza białka do związków
wielkocząsteczkowych (B)
bada wpływ niektórych
czynników na białka (C)
definiuje denaturację
zapisuje wzór ogólny tłuszczu
i wzór jednego tłuszczu (C)
wykonuje doświadczenie
badanie składu
pierwiastkowego tłuszczów
(C)
udowadnia, że tłuszcze są
estrami (D)
zapisuje poznane równania
reakcji:
hydrolizy tłuszczu
otrzymywania tłuszczu (C)
przeprowadza reakcję
zmydlania tłuszczu (C)
zapisuje równanie
przeprowadzonej reakcji
zmydlania tłuszczu (C)
analizuje różnice w budowie
tłuszczów stałych i olejów
roślinnych (D)
odróżnia doświadczalnie
tłuszcze nasycone od
nienasyconych (C)
Uczeń:
wie, w jaki sposób zbadać
skład pierwiastkowy białek (C)
określa wiązanie peptydowe
(C)
wyjaśnia, na czym polega
denaturacja i peptyzacja białek
(B)
wyjaśnia pojęcia zolu i żelu
(B)
opisuje doświadczenia
wykonane na lekcji (C)
wykrywa obecność białka
w próbce (C)
bada wpływ różnych
45
i koagulację białek (A)
wymienia reakcje
charakterystyczne dla białek
(B)
potrafi wykryć białko
w próbce (C)
zapisuje słownie przebieg
hydrolizy białek (B)
11. Poznajemy sacharydy
11.1. Skład
120. Glukoza jako przykład
pierwiastkowy
monosacharydu (cukru
i podział
prostego)
sacharydów
11.2.
Monosacharydy
11.3. Disacharydy
121. Sacharoza – przykład
disacharydu (dwucukru)
sacharydy:
skład pierwiastkowy
podział
właściwości fizyczne
glukoza – przykład
monosacharydu:
właściwości
reakcje
charakterystyczne
spalanie glukozy
w organizmie
człowieka
sacharoza:
przykład disacharydu
właściwości
Uczeń:
wie, co to są węglowodany
(A)
podaje skład pierwiastkowy
sacharydów (A)
identyfikuje doświadczalnie
pierwiastki chemiczne
wchodzące w skład
sacharydów (C)
dzieli sacharydy i podaje ich
przykłady (C)
podaje występowanie
glukozy (A)
zapisuje wzór sumaryczny
glukozy i fruktozy (B)
wymienia właściwości
fizyczne glukozy (A)
określa reakcje
charakterystyczne dla
glukozy (C)
przypisuje glukozie
właściwości redukujące (B)
Uczeń:
zapisuje wzór sumaryczny
sacharozy (B)
podaje właściwości
sacharozy (A)
zapisuje równanie reakcji
hydrolizy sacharozy (C)
czynników na białko (C)
Uczeń:
wyjaśnia, dlaczego sacharydy
nazywane są węglowodanami
(B)
opisuje doświadczenia na
wykrywanie glukozy (C)
przeprowadza reakcje
charakterystyczne glukozy (C)
udowadnia, że glukoza ma
właściwości redukujące (D)
zapisuje równania reakcji:
spalania glukozy
dotyczące właściwości
redukujących
fermentacji alkoholowej
(C)
Uczeń:
wyjaśnia, dlaczego sacharozę
nazywa się disacharydem
(dwucukrem) (B)
udowadnia, że sacharoza jest
polisacharydem (cukrem
złożonym) (D)
46
podaje nazwy produktów
hydrolizy sacharozy (C)
wymienia zastosowania
sacharozy (A)
11.4. Polisacharydy
122. Polisacharydy
(wielocukry) – skrobia
i celuloza
skrobia:
występowanie
właściwości
znaczenie
celuloza (błonnik):
występowanie
właściwości
znaczenie
12. Poznajemy
włókna
123. Włókna naturalne
i syntetyczne
włókna naturalne,
sztuczne i syntetyczne:
właściwości
identyfikacja
Podsumownie działu
124.125. Sprawdzian
Uczeń:
zalicza skrobię i celulozę do
polisacharydów (B)
zapisuje wzory sumaryczne
skrobi i celulozy (C)
podaje występowanie skrobi
i celulozy (A)
wymienia właściwości
skrobi i celulozy (A)
wymienia produkty
hydrolizy skrobi i celulozy
(B)
wykrywa skrobię w badanej
próbce (C)
określa znaczenie oraz
zastosowania skrobi
i celulozy (C)
Uczeń:
dokonuje podziału włókien
(B)
podaje przykłady i niektóre
zastosowania włókien (C)
wymienia właściwości
najważniejszych włókien
(A)
doświadczalnie odróżnia
włókno wełniane od
bawełnianego (C)
przeprowadza hydrolizę
sacharozy (C)
ustala, czy sacharoza ma
właściwości redukujące czy
też nie (B)
wykonuje doświadczenie
potwierdzające tezę
o właściwościach
redukujących sacharozy (D)
Uczeń:
wyjaśnia, dlaczego skrobię
i celulozę zalicza się do
polisacharydów (wielocukrów)
(B)
porównuje budowę skrobi
i celulozy (C)
wykrywa obecność skrobi
w badanej próbce (C)
zapisuje równania reakcji
hydrolizy skrobi i celulozy (C)
Uczeń:
omawia kryterium podziału
włókien (B)
podaje właściwości
i zastosowania różnych
włókien (C)
określa sposoby identyfikacji
włókien (C)
identyfikuje doświadczalnie
niektóre włókna (C)
47
13.
Zanieczyszczenia
środowiska
przyrodniczego
14. Substancje silnie
działające na
organizm człowieka
wiadomości. Omówienie
sprawdzianu
126.127. Zanieczyszczenie
środowiska
128. Negatywne skutki
działania niektórych substancji
na organizm człowieka
rodzaje zagrożeń
środowiska
przyrodniczego
zanieczyszczenia:
atmosfery
hydrosfery
litosfery
alkoholizm
narkomania
lekomania
Uczeń:
wyjaśnia, czym zajmuje się
ekologia (B)
definiuje zanieczyszczenia
(A)
dzieli zanieczyszczenia
środowiska przyrodniczego
(B)
wymienia najważniejsze
zagrożenia dla środowiska
przyrodniczego (B)
podaje źródła
zanieczyszczeń atmosfery,
hydrosfery i litosfery (B)
opisuje wpływ niektórych
zanieczyszczeń na
środowisko przyrodnicze
(C)
charakteryzuje
najpoważniejsze zagrożenia
(C)
definiuje eutrofizację (A)
dzieli odpady na rodzaje i
podaje ich źródła (B)
opisuje negatywny wpływ
odpadów na stan
środowiska przyrodniczego
(C)
omawia niektóre sposoby
zmniejszenia zagrożeń dla
środowiska przyrodniczego
lub ich całkowitej likwidacji
(C)
Uczeń:
wyjaśnia pojęcia nałogu,
uzależnienia (B)
Uczeń:
charakteryzuje dokładnie
poszczególne zagrożenia (C)
charakteryzuje zachowanie
tlenków węgla, azotu, siarki w
atmosferze (C)
analizuje przyczyny
powstawania efektu
cieplarnianego i jego
konsekwencje (D)
analizuje wpływ działalności
człowieka na glebę oraz
podaje wybrane sposoby
usuwania zanieczyszczeń
gleby (D)
charakteryzuje problemy, jakie
stwarzają odpady (C)
1 godzina
lekcyjna lub 2
48
nikotynizm
inne nałogi
opisuje szkodliwość
omawianych substancji (C)
opisuje zasady używania
niektórych substancji, np.
leków (C)
wie, że alkoholizm jest
chorobą społeczną (B)
opisuje wpływ omawianych
środków na organizm
człowieka, jego zachowanie
(C)