KONKURS CHEMICZNY – etap rejonowy 2007/2008
KOD UCZNIA………………………………………………………
INSTRUKCJA DLA UCZNIA
Nie podpisuj pracy. Zostanie ona zakodowana. Zestaw składa się z 25 zadań. W dwudziestu pierwszych
zadaniach prawidłowa jest tylko jedna odpowiedź. Wybierz i zaznacz ją znakiem „X”. Jeżeli pomylisz
się, otocz ją kółkiem i zaznacz właściwą. Odpowiedzi do pozostałych zadań wpisz czytelnie
w wyznaczonych miejscach. Nie używaj korektora. W trakcie rozwiązywania zadań możesz korzystać
z tablic dołączonych do zestawu zadań oraz kalkulatora. Zadania możesz rozwiązywać w dowolnej
kolejności.
Na udzielenie wszystkich odpowiedzi masz 90 minut.
Nie denerwuj się. W tym konkursie nic nie tracisz, zdobywasz natomiast nowe doświadczenia.
Życzymy Ci powodzenia!
ZADANIA ZAMKNIĘTE
1. Woda nie jest produktem reakcji:
a) spalania wodoru w tlenie
b) zobojętniania zasady sodowej kwasem solnym
c) magnezu z kwasem siarkowym (VI)
d) tlenku sodu z kwasem solnym
2. Stosunek molowy substratów i produktów w reakcji całkowitego spalania acetylenu wynosi:
a) 1:5:2:4
b) 2:5:4:2
c) 2:5:2:2
d) 1:2:3:2
.
3. Ile wynosi zawartość procentowa wody w związku o wzorze: CuSO4 5H2O?
a) 36%
b) 56,25%
c) 72%
d) 11,25%
4. Identyczną liczbę elektronów walencyjnych mają:
a) Cl-, Ne, S2b) Ca2+, Br -, K
c) Cl- Mg2+, Kr
d) Na+, Mg2+, Ne
5. Do probówek w których znajdują się tlenki dodano wodę, a następnie oranżu metylowego.
1
2
3
4
MgO
SO3
CuO
P4O10
Zauważono, że roztwór zabarwia się na czerwono w probówkach:
a) 1 i 3
b) tylko w 2
c) 3 i 4
d) 2 i 4
1
KONKURS CHEMICZNY – etap rejonowy 2007/2008
6. Oceń, który sposób zapisu jest prawidłowy: 5H2O, Fe, 2CO, 4N2.
a) 5 cząsteczek wody, 1 cząsteczka żelaza, 2 cząsteczki tlenku węgla(IV), 8 atomów azotu
b) 5 atomów wody, 1 atom żelaza, 2 cząsteczki tlenku węgla (II), 4 atomy azotu
c) 5 cząsteczek wody, 1 atom żelaza, 2 cząsteczki tlenku węgla(II), 4 cząsteczki azotu
d) 6 atomów wody, 1 cząsteczka żelaza, 4 atomy tlenku węgla (II), 8 cząsteczek azotu
7. W jakim stosunku masowym należy zmieszać 20% roztwór kwasu siarkowego (VI) z wodą, aby
otrzymać roztwór 15%?
a) 1:3
b) 1:1
c) 2:1
d) 3:1
8. Przez pomyłkę wsypano sproszkowaną kredę do wody. Aby ponownie rozdzielić te substancje
należy:
a) ogrzać je aż do wrzenia i oziębić
b) przesączyć
c) dobrze wymieszać i oziębić
d) mieszaniny tej nie można rozdzielić żadnymi dostępnymi metodami
9. Woda królewska to mieszanina, która zawiera:
a) 1 objętość H2SO4 i 3 objętości HCl
b) 3 objętości H2SO4 i 1 objętość HCl
c) 1 objętość HNO3 i 3 objętości HCl
d) 3 objętości HNO3 i 1 objętość HCl
10. Norma Unii Europejskiej dopuszcza 44 mg azotanów(V) w 1 dm3 wody. Pobrana próbka wody
zawierała 10 mg azotanów (V) w 140 cm . Czy taka woda jest przydatna do picia?
a) tak
b) na podstawie tych informacji nie można określić jej przydatności
c) nie
d) po przegotowaniu
11. Wskaż parę tlenków, które nie reagują ze sobą.
a) Na2O SO3
b) N2O5 Na2O
c) N2O5 SO3
d) SO3 MgO
12. O masie jądra decydują:
a) protony
b) protony i elektrony
c) protony i neutrony
d) elektrony i neutrony
13. Zaznacz punkt, w którym podano prawidłowo dokończone zdanie: „Nazwy substancji
chemicznych: marmur, krzemionka, karbid, grafit odnoszą się …
a) tylko do związków chemicznych
b) tylko do pierwiastków
c) do trzech związków chemicznych i jednego pierwiastka
d) do dwóch związków chemicznych i dwóch pierwiastków
14. Stężenie nasyconego w temperaturze 600C roztworu węglanu potasu wynosi 25%.
Rozpuszczalność tej soli jest równa:
a) 33,3g
b) 25g
c) 20g
2
KONKURS CHEMICZNY – etap rejonowy 2007/2008
d) 100g
15. Stosunek masowy Fe: S wynosi 7:8. Jaki wzór ma ten związek?
a) FeS
b) Fe2S3
c) FeS2
d) Fe3S2
16. O twardości wody świadczy :
a) kamień osadzający się na ściankach czajnika podczas gotowania wody
b) zielonkawa barwa wody
c) pienienie się wody podczas gotowania
d) wszystkie wymienione czynniki
17. Do najbardziej rozpowszechnionych w skorupie ziemskiej pierwiastków należą:
a) azot, srebro, miedź
b) krzem, węgiel, żelazo
c) tlen, krzem, glin
d) żelazo, wapń, azot
18. Które spośród przedstawionych sformułowań dotyczących układu okresowego jest fałszywe:
a) pierwiastki umieszczone w lewej dolnej części układu okresowego są metalami,
b) każdy okres kończy się gazem szlachetnym,
c) numer grupy informuje o liczbie powłok elektronowych,
d) pierwiastki należące do tej samej grupy mają podobne właściwości chemiczne?
19. Ryby łatwiej oddychają w wodzie:
a) ciepłej, bo wtedy łatwiej ich organizm przyswaja tlen
b) ciepłej, bo zawiera więcej tlenu niż zimna
c) zimnej, bo zawiera więcej tlenu niż ciepła
d) żadna odpowiedź nie jest poprawna
20. Wodorotlenek cynku można otrzymać w reakcji:
a) cynku z zasadą sodową
b) cynku z wodą
c) tlenku cynku z wodą
d) chlorku cynku z zasadą sodową
3
KONKURS CHEMICZNY – etap rejonowy 2007/2008
ZADANIA OTWARTE
1. Do kolby o pojemności 1dm3 wprowadzono 400g 5% roztworu KOH. Następnie dodano 5,8g
wodorotlenku potasu i uzupełniono wodą do pełna. Oblicz stężenie procentowe otrzymanego
roztworu, jeżeli jego gęstość wynosi 1,29g/cm3.
2. Na zajęciach koła chemicznego uczniowie otrzymali polecenie oznaczenia zawartości
procentowej pierwiastka węgla w próbce węgla kamiennego. Jeden z uczniów spalił próbkę
kopaliny o masie 2g i wydzielony gaz przepuścił przez płuczkę zawierającą Ca(OH)2.
Otrzymany osad odsączył i zważył. Jego masa wynosiła 13g. Podaj równania przeprowadzonych
przez ucznia reakcji i oblicz zawartość węgla pierwiastkowego w badanej próbce.
4
KONKURS CHEMICZNY – etap rejonowy 2007/2008
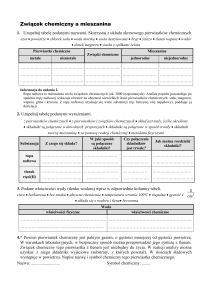
3. Jakie wiązania występują w cząsteczkach: K2O
cząsteczek.
Wzór
cząsteczki
Rodzaj wiązania
CO2
N2? Narysuj wzory elektronowe tych
Wzór elektronowy
K2O
CO2
N2
4. W przykładach 1 - 4 podano po pięć określeń (A - E) charakteryzujących pewne związki
chemiczne. Niestety spośród każdych pięciu określeń jedno trafiło tam przez pomyłkę,
ale pozostałe cztery rzeczywiście dotyczą tej samej substancji. Zidentyfikuj, o jakie substancje
chodziło w przykładach 1 - 4 podając ich nazwy oraz podkreśl błędną właściwość.
Przykład 1
A) występuje w przyrodzie B) bierze udział w fotosyntezie C) w postaci stałej jest nazywany „suchym”
lodem D) zestalony nie sublimuje E) może służyć do napełniania gaśnic
…………………………………………………………………………………………………………
Przykład 2
A) jest bezbarwną, oleistą cieczą B) jego gęstość jest prawie dwa razy mniejsza od gęstości wody C)
zwęgla substancje organiczne D) rozpuszcza się w wodzie, a proces ten jest procesem egzotermicznym
E) nazywany jest „krwią” przemysłu chemicznego
……………………………………………………………………………………………………………
Przykład 3
A) jest ciałem stałym, nierozpuszczalnym w wodzie B) jego bezbarwną odmianą jest kryształ górski
C) ma wysoką temperaturę topnienia D) reaguje ze wszystkimi kwasami E) wykorzystywany jest do
produkcji szkła
………………………………………………………………………………………………………
Przykład 4
A) jest bezbarwnym gazem B) dymi w wilgotnym powietrzu C) jest palny D) jego wodny roztwór
występuje w soku żołądkowym E) cięższy od powietrza
…………………………………………………………………………………………………………
5
KONKURS CHEMICZNY – etap rejonowy 2007/2008
5. Do doświadczenia użyto roztworów następujących substancji:
Na2S, BaCl2, K2S04, NaOH, HCI i zmieszano je parami:
probówka 2
probówka 1
A
probówka 3
X
B
Y
A
Z
+ fenoloftaleina
Obserwacje, przedstawiono w tabeli:
Probówka 1
Probówka 2
Probówka 3
Obserwacje
Wydzielił się gaz o zapachu zgniłych jaj.
Wytrącił się biały osad.
Roztwór odbarwił się.
Jakie substancje umieszczono w probówkach: 1,2,3? Podaj ich wzory sumaryczne oraz napisz w formie
jonowej skróconej reakcje zachodzące w probówkach.
Wzór substancji
A
B
X
Y
Z
Równania reakcji w formie jonowej skróconej
Probówka 1
Probówka 2
Probówka 3
6