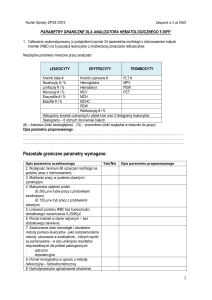
diagnostyka laboratoryjna Journal of Laboratory Diagnostic
2010 • Volume 46 • Number 4 • 383-389
Praca oryginalna • Original Article
Użyteczność aparatu CellaVision™DM8
w ocenie obrazu wzoru odsetkowego krwinek białych
u pacjentów onkologicznych
Usefulness of CellaVision™DM8 for evaluation
of the white blood cell differential in cancer patients
Barbara Masłyk1, Regina Deja1, Joanna Gliwińska1, Zofia Kołosza2, Elżbieta Nowara3
1Zakład
Analityki i Biochemii Klinicznej, 2Zakład Epidemiologii Nowotworów, 3Klinika Onkologii Klinicznej i Doświadczalnej,
Centrum Onkologii – Instytut im. Marii Skłodowskiej-Curie, Gliwice
Streszczenie
Cel: Celem pracy było sprawdzenie użyteczności aparatu CellaVision™DM8 w ocenie wzoru odsetkowego krwinek białych.
CellaVision™DM8 jest urządzeniem umożliwiającym automatyczną analizę obrazu rozmazu krwi obwodowej.
Metody: Analizy porównawczej wzoru odsetkowego krwinek białych dokonano dla dwóch metod odniesienia: rozmazu mikroskopowego oraz aparatu hematologicznego Sysmex XE-2100. Do oceny porównania metod wykorzystano analizę korelacji
i regresji prostoliniowej, a dla oceny istotności różnic pomiędzy wynikami test t-Studenta; z wykorzystaniem programu statystycznego STATISTICA wersja 7.1. Dla porównania zgodności pomiarów wykonanych analizowanymi metodami użyto graficznej techniki wg. Bland i Altman.
Wyniki: System CellaVision™DM8 jest urządzeniem pomocnym w ocenie wzoru odsetkowego krwinek białych, z dobrą korelacją
pomiędzy wynikami otrzymanymi z użyciem aparatu hematologicznego Sysmex XE-2100 oraz różnicowaniem mikroskopowym.
System CellaVision™DM8 zapewnia uzyskanie wstępnego wyniku leukogramu, jego archiwizację oraz dostęp do wykonanych przez urządzenie zdjęć komórek krwi kilku operatorom jednocześnie.
Summary
Aim: The aim of study was checking usefulness of CellaVision™DM8 for evaluation of the white blood cell differential.
CellaVision™DM8 automatically performs a preliminary white blood cell differential count of peripheral blood smears.
Methods: In this study, we compare following methods: automated Sysmex XE-2100, manual microscopy and
CellaVision™DM8 differential count. Linear regression analysis and t-Student test were used to compare these methods,
using STATISTICA software (version 7.1). The Bland and Altman technique was used to compare agreement of the results
obtained by analyzed methods.
Results: The CellaVision™DM8 is a device helpful for evaluation of the white blood cell differential, with a good correlation
between results received by manual and Sysmex XE-2100 differential count.
System CellaVision™DM8 ensures faster analisys access to the images and possibility to review to other persons simultaneously.
Słowa kluczowe: diagnostyka hematologiczna, różnicowanie krwinek białych, korelacja, CellaVision™DM8
Keywords: hematological diagnostics, white blood cell differential, correlation, CellaVision™DM8
Wstęp
(lub 6) subpopulacji: neutrofile, limfocyty, monocyty, eozyno-
Różnicowanie krwinek białych w rozmazie krwi obwodowej
file i bazofile, (komórki LUC). Jednakże, szczególnie u pa-
jest podstawowym testem wykorzystywanym przez klinicys-
cjentów onkologicznych, u chorych często pojawiają się
tów u pacjentów z chorobą nowotworową. Wykorzystywane
komórki nieprawidłowe i patologiczne np. limfocyty wyka-
rutynowo w laboratoriach analitycznych analizatory hema-
zujące różne nieprawidłowości, komórki blastyczne, czy nie-
tologiczne umożliwiają różnicowanie krwinek białych na 5
dojrzałe granulocyty. Obraz różnicowania otrzymywany
383
Użyteczność aparatu CellaVisionTMDM8 w ocenie obrazu wzoru odsetkowego krwinek białych u pacjentów onkologicznych
w takich przypadkach z aparatu hematologicznego nie jest
białych (Wbc) oraz płytek krwi (Plt) różnicuje leukocyty na 5
w pełni zadowalający, zawiera bowiem ograniczone infor-
głównych subpopulacji: neutrofile (neut), limfocyty (lymph),
macje o morfologii komórek nieprawidłowych. Wynik leuko-
monocyty (mono), eozynofile (eo) i bazofile (baso). Ponadto
gramu pochodzący z aparatu hematologicznego zostaje
dokonuje zliczania subpopulacji niedojrzałych granulocytów
„oflagowany” i niezbędna jest weryfikacja różnicowania za
(IG) zawierającej metamielocyty, mielocyty oraz promielo-
pomocą metody manualnej – mikroskopowej. Weryfikacji
cyty; jako parametr badawczy. Granulocyty obojętnochłonne
takiej dokonać mogą pracownicy z dużym doświadczeniem,
o jądrze pałeczkowatym (band) nie są zliczane jako oddziel-
rutynowo oceniający rozmazy krwi obwodowej. Różnicowa-
na subpopulacja, lecz włączane do klasy neutrofili. Do różni-
nie mikroskopowe jest procesem zarówno czaso-, jak i pra-
cowania leukocytów na poszczególne podklasy wykorzysty-
cochłonnym. Niejednokrotnie wydłuża to znacznie czas
wana jest metoda fluorescencyjnej cytometrii przepływowej;
oczekiwania na wynik rozmazu mikroskopowego, co może
metoda barwienia fluorescencyjnego w połączeniu z intensy-
utrudnić klinicystom podjęcie decyzji terapeutycznych. Dla-
wnością rozproszenia światła. Wiązka światła emitowana
tego od kilku lat na rynek diagnostyczny wprowadzane są
przez laser półprzewodnikowy prześwietla próbkę, co umoż-
urządzenia umożliwiające automatyczną analizę obrazu
liwia różnicowanie komórek analizując trzy typy sygnałów:
rozmazu krwi obwodowej. Przykładem takiego aparatu jest
rozproszone światło czołowe (objętość komórki), rozproszo-
CellaVision™Diffmaster8 (CellaVision™DM8; CellaVisio-
ne światło boczne (zawartość komórki: jądro i ziarnistości)
nAB, Lund, Sweden). Analizatory, wyposażone w zautoma-
oraz boczną fluorescencję (zawartość kwasów nukleinowych
tyzowane, wysokiej klasy mikroskopy lokalizują leukocyty
w komórce). Metoda fluorescencyjnej cytometrii przepływo-
w preparacie (slajdzie) i dokonują wstępnej klasyfikacji krwi-
wej pozwala na przedstawienie bardzo precyzyjnego obrazu
nek białych oraz wstępnej charakterystyki erytrocytów
każdej wykrytej komórki [5]. W przypadku obecności niepra-
i płytek krwi. Zdjęcia komórek krwi prezentowane są opera-
widłowych komórek we krwi analizator odpowiednio „oflago-
torowi na ekranie monitora do weryfikacji i bezpośredniej
wuje” wynik badania. Bezpośrednio po automatycznej anali-
autoryzacji lub reklasyfikacji. Aparat dokonuje wstępnej kla-
zie morfologii krwi obwodowej patologiczne próbki krwi,
syfikacji krwinek białych, umożliwiając jednocześnie ich
zgodnie z rutynową procedurą stosowaną w laboratorium,
weryfikację i reklasyfikację przez operatora systemu, a wy-
przekazane zostają do weryfikacji mikroskopowej.
niki oraz zdjęcia komórek można przeglądać w dowolnym,
dogodnym dla użytkownika czasie. Systemy wyposażone
Różnicowanie mikroskopowe
są w specjalistyczne oprogramowania umożliwiające prze-
We wszystkich próbkach włączonych do badania wstępnie
syłanie wyników i obrazów komórek na odległość, w tym do
rozpoznano obecność niedojrzałych granulocytów, niepra-
innych szpitali zapewniających możliwość konsultacji trud-
widłowych limfocytów, komórek blastycznych i/lub zwiększo-
nych przypadków. Może to być początkiem rozwoju tzw.
nej liczby poszczególnych subpopulacji. Rozmazy krwi obwo-
telehematologii.
dowej wykonano w standardowych warunkach, używając
Celem przedstawianej pracy było sprawdzenie użyteczności
barwienia metodą May-Grünwald Giemsa. Z każdej próbki
aparatu CellaVision™DM8 w ocenie różnicowania krwinek
wykonano równocześnie dwa rozmazy: pierwszy do oceny
białych w rozmazie krwi obwodowej.
mikroskopowej, drugi do oceny wzoru odsetkowego krwinek
białych z użyciem aparatu CellaVision™DM8. We wszystkich
Materiał i metody
preparatach, niezależnie od metody różnicowania, weryfiko-
Próbki krwi, pacjenci
wano 100 komórek. Oceny wzoru odsetkowego krwinek
Badaniem objęto 92 próbki krwi pacjentów leczonych w Cen-
białych, porównywanymi metodami, dokonywał ten sam ope-
trum Onkologii – Instytucie, o/Gliwice (Klinice Onkologii Kli-
rator. Oceny rozmazów mikroskopowych dokonano przy
nicznej i Doświadczalnej), u których w oznaczeniu morfologii
użyciu mikroskopu świetlnego Olympus CX41.
krwi stwierdzono obecność komórek nieprawidłowych. Do
analiz wykorzystano krew pełną pobieraną do rutynowych
CellaVision™DM8
badań hematologicznych. Krew pobierano w standardowych
Aparat CellaVision™DM8 automatycznie wstępnie różnicuje
warunkach; bezpośrednio do plastikowych, próżniowych, ste-
krwinki białe w rozmazie krwi obwodowej. Preparaty (slajdy)
rylnych probówek (Becton Dickinson), o pojemności 2 ml,
umieszczane są w specjalnych magazynkach po 8 slajdów,
zawierających K2EDTA jako antykoagulant. Oznaczenia mor-
a wydajność aparatu to klasyfikacja do 20 slajdów/godzinę.
fologii oraz preparaty rozmazu krwi obwodowej wykonano do
System wyposażony jest w zautomatyzowany mikroskop,
dwóch godzin od chwili pobrania.
który lokalizuje potencjalne leukocyty w preparacie, a następnie za pomocą cyfrowej kamery wykonuje wysokiej roz-
Aparat hematologiczny
dzielczości zdjęcia poszczególnych komórek. Standardem
Oznaczenia morfologii krwi obwodowej wykonano na anali-
do różnicowania jest 100 obrazów komórek, które oceniane
zatorze hematologicznym Sysmex XE-2100, wykorzystywa-
są z wykorzystaniem specjalnego oprogramowania. System
nym w rutynowej pracy laboratoryjnej. Analizator oprócz
posiada tzw. bibliotekę komórek referencyjnych dla po-
podstawowych oznaczeń liczby krwinek czerwonych (Rbc),
szczególnych subpopulacji, a także agregatów płytkowych,
384
B. Masłyk i inni
cieni komórek i artefaktów. Obrazy komórek przedstawiane
pomiędzy wynikami analizowanych metod użyto analizy
są operatorowi na ekranie monitora w kolejnych subpopula-
korelacji i regresji prostoliniowej. Istotność różnic pomiędzy
cjach, tzw. galeriach komórek. Użytkownik może analizować
otrzymanymi wynikami oceniono wykorzystując test t-Stu-
komórki w kilku opcjach przeglądów: przeglądzie zawie-
denta dla prób zależnych. Do porównania zgodności pomia-
rającym wszystkie zidentyfikowane komórki, przeglądzie
rów pomiędzy metodami użyto graficznej metody Bland
wybranych kilku subpopulacji, jak również może powiększyć
i Altman, przyjmując średnią różnic+/-2SD jako 95% zakres
każdą indywidualną komórkę i porównać z zawartymi w sys-
zgodności dla poszczególnych pomiarów.
temie komórkami referencyjnymi. Operator może zaakceptować sugerowaną przez system klasyfikację lub dokonać
Wyniki:
reklasyfikacji przemieszczając poszczególne komórki do
1. Porównanie wyników różnicowania
innych klas. Po weryfikacji preparatu operator dokonuje
CellaVision™DM8 z metodą mikroskopową
autoryzacji wyniku, czyli podpisania preparatu. Podpisanie
Wyniki analizy korelacji i regresji prostoliniowej oraz wyniki
preparatu następuje po weryfikacji wszystkich prezentowa-
testu t-Studenta dla poszczególnych subpopulacji krwinek
nych klas komórek, możliwe jest także dodanie przez użyt-
białych zebrano w Tabeli I. W przypadku aparatu CellaVi-
kownika odpowiednich komentarzy do wyniku leukogramu.
sion™DM8 włączone do analizy poszczególne podklasy
Następnie wynik transmitowany jest poprzez Laboratoryjny
leukocytów podlegały wcześniejszej weryfikacji i reklasyfi-
System Informatyczny do odbiorcy. Wyniki różnicowania
kacji przez operatora systemu. Nieistotne statystycznie
prezentowane są w postaci zdjęć, udziału procentowego
różnice w średniej wartości zliczeń komórek oznaczanych
i wartości liczbowych zliczonych typów komórek oraz nasile-
podklas leukocytów otrzymano w zakresie niedojrzałych
nia występowania określonej patologii.
granulocytów, limfocytów, eozynofili oraz komórek blastycznych. Dla pozostałych subpopulacji krwinek białych wyka-
Metody
zano istotne różnice średnich z pomiarów; przy czym niższą
Różnicowania leukocytów w preparatach krwi obwodowej
wartość średnią w różnicowaniu mikroskopowym niż Cella-
dokonano w tym samym czasie, w następującej kolejności:
Vision™DM8 otrzymano dla neutrofili, bazofili i atypowych
analiza na analizatorze hematologicznym, rozmaz mikrosko-
limfocytów, wyższą natomiast w zakresie monocytów.
powy oraz różnicowanie na aparacie CellaVision™DM8.
Zaobserwowano dobrą zgodność wyników otrzymanych
Porównanie metod obejmowało dwa etapy:
automatyczną metodą CellaVision™DM8 oraz referencyjną
1. porównanie metody różnicowania CellaVision™DM8
metodą mikroskopową dla trzech głównych subpopulacji leu-
z referencyjną metodą mikroskopową w zakresie nastę-
kocytów: neutrofili, limfocytów i eozynofili. Nieco niższe war-
pujących subpopulacji: neutrofile, niedojrzałe granulo-
tości współczynnika korelacji uzyskano dla monocytów oraz
cyty, limfocyty, monocyty, eozynofile, bazofile, atypowe
niedojrzałych granulocytów. Natomiast znacząco niższe dla
limfocyty oraz komórki blastyczne
bazofili, atypowych limfocytów i komórek blastycznych.
2. porównanie metody różnicowania CellaVision™DM8
W kolejnym etapie pracy do oceny porównania metod
z metodą fluorescencyjnej cytometrii przepływowej
zastosowano graficzną analizę Bland-Altman. Wyniki uzys-
Sysmex XE-2100 w zakresie subpopulacji: neutrofile,
kane tą techniką przedstawiono na odpowiednich wykre-
niedojrzałe granulocyty, limfocyty, monocyty, eozynofile
sach [ryc. 1, 2, 3, 4]. Pozostałe oceniane subpopulacje leu-
oraz bazofile
kocytów nie zostały zaprezentowane obrazowo z uwagi na
Opracowanie statystyczne wykonano z wykorzystaniem pro-
niewielką liczbę zliczanych komórek. Średnia różnic zliczeń
gramu STATISTICA (wersja 7.1). Do oceny zależności
komórek pomiędzy metodami automatyczną CellaVision™
Tabela I. Korelacja wyników oznaczeń otrzymanych z użyciem aparatu CellaVisionTMDM8 vs różnicowania mikroskopowego.
Wbc
x⎯ mikroskop
x⎯ CellaVision
p = (test t)
równanie regresji
r=
p=
NEUT
47,97
50,47
0,0003
y = 0,3224 + 1,0455*x
0,9573
0,0000
IG
2,43
2,05
NS
y = 0,2266 + 0,7493*x
0,8773
0,0000
LYMPH
28,40
27,41
NS
y = -2,5604 + 1,0553*x
0,9530
0,0000
MONO
14,36
11,47
0,0000
y = 0,3472 + 0,7745*x
0,7465
0,0000
EO
4,79
4,45
NS
y = 0,0782 + 0,9127*x
0,9672
0,0000
BASO
0,50
0,89
0,0016
y = 0,6118 + 0,5481*x
0,3600
0,0004
ATYP LYMPH
1,22
2,62
0,0000
y = 1,6978 + 0,7777*x
0,5338
0,0000
BLAST
0,38
0,55
NS
y = 0,3856 + 0,4206*x
0,4479
0,0000
385
Użyteczność aparatu CellaVisionTMDM8 w ocenie obrazu wzoru odsetkowego krwinek białych u pacjentów onkologicznych
Rycina 1. Analiza porównawcza wyników neutrofili (%) otrzymanych z użyciem aparatu CellaVision™DM8 vs różnicowania mikroskopowego (wg BlandAltman).
Rycina 3. Analiza porównawcza wyników monocytów (%) otrzymanych z użyciem aparatu CellaVision™DM8 vs różnicowania mikroskopowego (wg BlandAltman)
Rycina 2. Analiza porównawcza wyników limfocytów (%) otrzymanych z użyciem aparatu CellaVision™DM8 vs różnicowania mikroskopowego (wg BlandAltman)
Rycina 4. Porównanie wyników eozynofili (%) otrzymanych z użyciem aparatu CellaVision™DM8 vs różnicowania mikroskopowego (wg Bland-Altman)
DM8 i mikroskopową wynosi: -2,51 dla neutrofili; 0,99 dla
operatora. Nieistotne statystycznie różnice w średniej war-
limfocytów; 2,89 dla monocytów; 0,34 dla eozynofili; 0,39 dla
tości zliczeń komórek oznaczanych podklas leukocytów
bazofili; 0,38 dla niedojrzałych granulocytów; -1,43 dla aty-
otrzymano w zakresie dwóch subpopulacji: limfocytów
powych limfocytów oraz -0,17 dla komórek blastycznych.
i eozynofili. Dla pozostałych podklas krwinek białych wyka-
Przedstawione różnice w ilości zliczanych krwinek białych
zano istotne różnice średnich z pomiarów. Niższą wartość
w poszczególnych subpopulacjach, względem średniej war-
średnią różnicowania na aparacie hematologicznym niż
tości wyników otrzymanych analizowanymi metodami, wska-
CellaVision™DM8 otrzymano dla neutrofili i bazofili, wyższą
zują na zgodność większości wyników otrzymanych obyd-
natomiast w zakresie niedojrzałych granulocytów oraz
woma metodami.
monocytów.
Podobnie, jak w przypadku metod ocenianych w pierwszym
2. Porównanie wyników różnicowania
etapie badania, dobrą współzależność wyników odnotowano
CellaVision™DM8 z metodą fluorescencyjnej
także pomiędzy automatyczną metodą CellaVision™DM8
cytometrii przepływowej Sysmex XE-2100
a metodą fluorescencyjnej cytometrii przepływowej dla
Wyniki analizy korelacji i regresji prostoliniowej oraz testu
głównych subpopulacji krwinek białych: neutrofili, limfocytów
t-Studenta dla poszczególnych subpopulacji leukocytów
i eozynofili. Nieznacznie gorszą korelację wykazano dla
oznaczanych z użyciem aparatu CellaVision™DM8 oraz
monocytów, a najniższą zgodność wyników pomiędzy meto-
Sysmex XE-2100 zebrano w Tabeli II. W przypadku aparatu
dami dla subpopulacji bazofili. Wysoka wartość współczyn-
CellaVision™DM8 włączone do analizy podklasy leukocy-
nika korelacji dla głównych subpopulacji krwinek białych
tów podlegały wcześniejszej weryfikacji i reklasyfikacji przez
(neutrofile, limfocyty, eozynofile) wskazuje na silną liniową
386
B. Masłyk i inni
Tabela II. Korelacja wyników oznaczeń otrzymanych z użyciem aparatu CellaVision™DM8 vs Sysmex XE-2100.
Wbc
x⎯ XE-2100
x⎯ CellaVision
p = (test t)
równanie regresji
r=
p=
NEUT
46,13
50,47
0,0000
y = 1,5227 + 1,0611*x
0,9634
0,0000
IG
2,96
2,05
0,0000
y = -0,0874 + 0,7214*x
0,9222
0,0000
LYMPH
28,29
27,41
NS
y = -0,8807 + 0,9999*x
0,9510
0,0000
MONO
17,30
11,47
0,0000
y = 0,0611 + 0,6592*x
0,7731
0,0000
EO
4,64
4,45
NS
y = -0,0422 + 0,969*x
0,9813
0,0000
BASO
0,63
0,89
0,0491
y = 0,6465 + 0,3778*x
0,2291
0,0280
zależność pomiędzy wartościami zliczeń uzyskanymi obyd-
korelacji dla niedojrzałych granulocytów świadczy o wysokiej
woma metodami. Zadowalającą, lecz nieco niższą wartość
korelacji tych oznaczeń wykonywanych obydwoma meto-
współczynnika korelacji uzyskano dla subpopulacji monocy-
dami automatycznymi.
tów. Niższy natomiast współczynnik regresji wyznaczono dla
W kolejnym etapie pracy do oceny porównania metod zasto-
podklasy bazofili, lecz znaczący wpływ na taki wynik staty-
sowano graficzną analizę Bland-Altman. Uzyskane wyniki
styczny może mieć niewielka liczba komórek różnicowanych
przedstawiono na odpowiednich wykresach [ryc. 5, 6, 7, 8].
w tej subpopulacji. Uzyskany natomiast wysoki współczynnik
Pozostałe oceniane subpopulacje leukocytów nie zostały
Rycina 5. Analiza porównawcza wyników neutrofili (%) otrzymanych z użyciem aparatu CellaVision™DM8 vs Sysmex XE-2100 (wg Bland-Altman).
Rycina 7. Analiza porównawcza wyników monocytów (%) otrzymanych z użyciem aparatu CellaVision™DM8 vs Sysmex XE-2100 (wg Bland-Altman).
Rycina 6. Analiza porównawcza wyników neutrofili (%) otrzymanych z użyciem aparatu CellaVision™DM8 vs Sysmex XE-2100 (wg Bland-Altman).
Rycina 8. Porównanie wyników eozynofili (%) otrzymanych z użyciem aparatu CellaVision™DM8 vs Sysmex XE-2100 (wg Bland-Altman).
387
Użyteczność aparatu CellaVisionTMDM8 w ocenie obrazu wzoru odsetkowego krwinek białych u pacjentów onkologicznych
zaprezentowane obrazowo z uwagi na niewielką liczbę zli-
„odzyskać” w celu ponownej weryfikacji czy ewentualnej
czanych komórek. Średnia różnic pomiarów pomiędzy meto-
konsultacji [4, 7]. Zatem wymogi standaryzacji oraz skróce-
dami automatycznymi Sysmex XE-2100 i CellaVision™DM8
nia czasu oczekiwania na wynik leukogramu spowodowały
wynosi: -4,34 dla neutrofili; 0,88 dla limfocytów; 5,84 dla
poszukiwania nowych rozwiązań metodycznych [6, 7].
monocytów; 0,19 dla eozynofili; -0,25 dla bazofili oraz 0,91
Jednym z takich rozwiązań jest zautomatyzowana metoda
dla niedojrzałych granulocytów. Różnice w wartościach
oceny komórek rozmazu krwi obwodowej, oznaczenia
oznaczeń pomiędzy analizowanymi metodami są nieznacz-
dotychczas wykonywanego manualnie, z wykorzystaniem
ne i porównywalne z tymi, jakie uzyskano pomiędzy meto-
systemu CellaVision™DM8.
dami mikroskopową vs CellaVision™DM8. Również otrzy-
CellaVision™DM8 jest aparatem automatycznie dokonują-
mane w tym etapie badania różnice w ilości zliczanych
cym oceny obrazu rozmazu mikroskopowego krwi obwodo-
krwinek białych w poszczególnych subpopulacjach, wzglę-
wej. Wyposażony w wysokiej klasy mikroskop oraz kamerę
dem średniej wartości wyników otrzymanych analizowanymi
cyfrową lokalizuje komórki na slajdzie, wykonuje ich zdjęcia,
metodami, wskazują na zgodność większości wyników
a dzięki wyrafinowanemu oprogramowaniu wstępnie klasyfi-
otrzymanych obydwoma metodami.
kuje krwinki białe do odpowiednich subpopulacji. Do identyfikacji komórek oprogramowanie używa wzorca bazującego
Dyskusja
na licznych parametrach tj. wielkość i gęstość jądra, ziarnis-
Ocena wzoru odsetkowego krwinek białych jest klinicznie
tość i wielkość komórek, ilość cytoplazmy czy współczynnik
ważnym, czułym w wykrywaniu patologicznych zmian doty-
cytoplazma/jądro [9]. Komórki następnie zostają przedsta-
czących komórek krwi obwodowej, a dodatkowo wyróżnia-
wione operatorowi na ekranie do wizualnej weryfikacji. Ope-
jącym się niewielkimi kosztami wykonania, stąd często zle-
rator może zatwierdzić sugerowaną klasyfikację, bądź doko-
canym testem laboratoryjnym [2, 4]. Pomimo dynamicznego
nać reklasyfikacji poszczególnych komórek. Różne klasy
rozwoju nowoczesnych technik biologii molekularnej, cyto-
komórek mogą być przeglądane razem, w kolejnych subpo-
genetyki i immunologii ocena morfologii komórek pozostaje
pulacjach (galeriach) lub też poszczególne komórki mogą
pierwszym krokiem do szybkiej, wstępnej diagnozy chorych.
być indywidualnie powiększone i przeglądane z wykorzysta-
Wymaga to wykonania wysokiej jakości różnicowania leuko-
niem wirtualnego mikroskopu [6, 9]. Operator może dla
cytów krwi obwodowej dla dokładnej oceny morfologii komó-
porównania krwinek użyć biblioteki komórek referencyjnych
rek [3]. Automatyczne analizatory hematologiczne dostar-
w przypadku komórek trudnych do klasyfikacji, jak również
czają wielu użytecznych informacji dotyczących morfologii
może samodzielnie dodawać obrazy do zbioru biblioteki jako
krwi; zarówno liczbowych, jak i obrazowych (histogramy,
własne komórki referencyjne. W celu zatwierdzenia wyniku
skattergramy) i wykonują niezawodne różnicowanie leukocy-
różnicowania konieczna jest weryfikacja wszystkich kategorii
tów dla próbek prawidłowych, stąd jest to niezwykle uży-
komórek.
teczny skryningowy test z wysoką precyzją i dokładnością
W przedstawionym opracowaniu porównania metod Cella-
rozdziału. Jednakże próbki krwi obwodowej chorych zawie-
Vision™DM8 i referencyjnej metody mikroskopowej oraz
rające niedojrzałe lub patologiczne komórki nadal wymagają
CellaVision™DM8 i Sysmex XE-2100 dokonano z użyciem
różnicowania mikroskopowego [1, 2, 4]. Mimo znaczącego
analizy korelacji i regresji prostoliniowej. W wyniku analizy
postępu w metodyce stosowanej w analizatorach hematolo-
przeprowadzonej na 92 losowo wybranych próbkach krwi
gicznych, brak jak dotąd znaczącej poprawy w automatyzacji
(próbkach po wstępnej ocenie na aparacie hematologicz-
oceny rozmazu krwi obwodowej [3]. Niezależnie od aparatu
nym i zakwalifikowanych do weryfikacji mikroskopowej) naj-
około 10% [1, 2], 15% [3], a nawet 28% [4] wyników różnico-
wyższe współczynniki korelacji (r=0,95-0,98) otrzymano dla
wania leukocytów zostaje „oflagowanych” w aparacie hema-
subpopulacji neutrofili, limfocytów i eozynofli; niezależnie od
tologicznym i wymaga weryfikacji mikroskopowej. W naszym
metody odniesienia. Stanowi to potwierdzenie bardzo dużej
laboratorium oznaczenia morfologii krwi wykonywane są na
zgodności wyników zliczeń komórek tych subpopulacji
aparacie Sysmex XE-2100, a „oflagowane” subpopulacje
otrzymanych analizowanymi metodami. Podobnie wysokie
leukocytów wahają się w granicach 15-20%. W takich przy-
zależności wykazali inni autorzy [1, 2, 3, 4] wykonując
padkach, zgodnie z ustaloną procedurą stosowaną w labora-
porównania CellaVision™DM96 z referencyjną metodą
torium, próbki zostają zakwalifikowane do oceny mikro-
manualną. Natomiast przy porównaniu dwóch metod auto-
skopowej. Zatem, pomimo rutynowo wykorzystywanego
matycznych CellaVision™DM96 i Sysmex XE-2100 podob-
automatycznego różnicowania komórek w pracowniach
ną wysoką współzależność pomiarów uzyskali Cornet oraz
hematologicznych, istotną część pracy stanowi weryfikacja
Linssen i wsp. oraz Van Gelder z zespołem [3, 5, 9]. Przy
mikroskopowa preparatów patologicznych.
porównaniu wyników różnicowania CellaVisionTMDM8
Ocena rozmazów mikroskopowych wymaga znacznego
z referencyjną metodą mikroskopową współczynniki regresji
wkładu czasu oraz wykwalifikowanego personelu [1, 3, 8].
dla niedojrzałych granulocytów i monocytów były niższe
Analizowane próbki mogą ponadto stwarzać trudności
i wynosiły r=0,88 i r=0,75 oraz nieznacznie wyższe w meto-
w różnicowaniu ze względu na nietypowe, nieprawidłowe
dzie CellaVision™DM8 vs Sysmex XE-2100 r=0,92 i r=0,77,
cechy, a poszczególne oceniane komórki niełatwo jest
odpowiednio. Podobne spostrzeżenia mieli inni badacze
388
B. Masłyk i inni
[1, 3, 4, 9], a obserwowana niższa korelacja powyższych
Sysmex XE-2100 oraz rozmazem mikroskopowym. Istotną
wyników najprawdopodobniej spowodowana jest hetero-
cechą aparatu jest możliwość reklasyfikacji komórek jedno-
gennym rozkładem monocytów w preparatach krwi obwodo-
cześnie przez zespół operatorów, co redukuje ryzyko subiek-
wej, co jest bardzo dobrze znanym problemem samej
tywnej identyfikacji komórek w preparatach trudnych oraz
metody wykonania rozmazów. W konsekwencji, zarówno
zapewnia możliwość oceny obrazu różnicowanych krwinek
sama liczba zliczanych krwinek, jak i miejsca obserwacji
białych w dowolnym czasie, ułatwiając tym samym konsulta-
komórek krwi dla metody mikroskopowej i automatycznej
cje indywidualnych preparatów.
mogą się różnić, co w efekcie przyczynia się do występowa-
Dokonując klasyfikacji krwinek białych z wykorzystaniem
nia różnic w liczbie zliczanych monocytów [3]. Pozostałe
systemu CellaVision™DM8 uzyskaliśmy w krótkim czasie
włączone do badania subpopulacje leukocytów, zawierające
wstępny wynik leukogramu, dostęp do wykonanych przez
tylko nieliczne zliczane komórki nie wykazały tak dobrej
urządzenie zdjęć komórek krwi dla kilku operatorom jedno-
korelacji pomiędzy ocenianymi metodami. W porównaniu
cześnie oraz dostęp do historii rozmazów pacjenta
metod CellaVision™DM8 oraz metody mikroskopowej
Nadal jednak referencyjną metodą badania rozmazu krwi
współczynnik regresji dla atypowych limfocytów wynosił
obwodowej, która oprócz oceny ilościowej i jakościowej sub-
r= 0,53, a dla komórek blastycznych r= 0,45, co również
populacji krwinek białych obejmuje dodatkową ocenę jakoś-
związane jest prawdopodobnie z niewielką liczbą tych
ciową krwinek czerwonych i płytek krwi, pozostaje badanie
komórek w ocenianych próbkach. Najniższą wartość
mikroskopowe, szczególnie w przypadkach występowania
współczynnika korelacji, zatem najniższą współzależność
komórek patologicznych.
wyników stwierdzono dla subpopulacji bazofili (r= 0,36
i r=0,23), niezależnie od porównywanych metod. Podobne
wyniki uzyskali inni badacze, gdzie współczynniki korelacji
dla bazofili pomiędzy metodami automatyczną i manualną
były niskie i wahały się w zakresie r=0,05-0,57 [1, 2, 3, 4, 9].
Oznaczone tak niskie współczynniki korelacji dla bazofili
prawdopodobnie spowodowane są tym, że tylko w nielicznych próbkach obecne były granulocyty zasadochłonne,
a tym samym obliczenia statystyczne dla takich niewielkich
liczebnie grup, nie są w pełni zadowalające [1, 2].
Wskaźniki różnicowania krwinek białych są ważnym diagnostycznym kryterium w wielu chorobach, stąd niezmiernie
istotną cechą przedstawianego systemu jest możliwość
przedyskutowania trudnych przypadków i skonsultowania
z innymi specjalistami. CellaVision™DM8 automatyzuje
pracę tradycyjnie wykonywaną przez personel laboratorium
używając mikroskopu, zapewnia przegląd wszystkich komórek jednocześnie dla możliwości szybkiego potwierdzenia,
a automatyczna lokalizacja i wstępna klasyfikacja redukują
subiektywną identyfikację komórek i poprawiają jakość
wyniku. System zapewnia ponadto możliwość wglądu
w archiwalne wyniki pacjenta oraz znacząco redukuje czas
wykonania rutynowych testów hematologicznych, szczególnie w przypadku próbek leukopenicznych.
Wnioski
Wstępne wyniki oceny automatycznego systemu różnicowania rozmazów krwi obwodowej, choć z pewnością wymagają
Piśmiennictwo
1. Briggs C, Longair I, Slavik M i wsp. Can automated blood film
analysis replace the manual differential? An evaluation of the
CellaVision DM96 automated image analysis system. Int J Lab
Hematol 2009; 31: 48-60.
2. Ceelie H, Dinkelaar RB, van Gelder W. Examination of peripheral
blood films using automated microscopy; evaluation of Diffmaster
Octavia and Cellavision DM96. J Clin Pathol 2007; 60: 72-79.
3. Cornet E, Perol JP, Troussard X. Performance evaluation and
relevance of the CellaVision DM96 system in routine analysis
and in patients with malignant hematological diseases. Int J Lab
Hematol 2008; 30: 536-542.
4. Kratz A, Bengtsson HI, Casey JE i wsp. Performance evaluation
of the CellaVision DM96 system: WBC differentials by automated digital image analysis supported by an artificial neural
network. Am J Clin Pathol 2005; 124: 770-781.
5. Linssen J, Jennissen V, Hildmann J i wsp. Identification and
quantification of high fluorescence-stained lymphocytes as antibody synthesizing/secreting cells using the automated routine
hematology analyzer XE-2100. Cytometry B Clin Cytom 2007;
72: 157-166.
6. Riley RS, Ben-Ezra JM, Massey D i wsp. The virtual blood film.
Clin Lab Med 2002; 22: 317-345.
7. Swolin B, Simonsson P, Backman S i wsp. Differential counting
of blood leukocytes using automated microscopy and a decision
support system based on artificial neural networks-evaluation of
DiffMaster Octavia. Clin Lab Haematol 2003; 25: 139-147.
8. Tatsumi N, Pierre RV. Automated image processing. Past, present, and future of blood cell morphology identification. Clin Lab
Med 2002; 22: 299-315.
9. Van Gelder W, Ceelie H. Automated blood cell analysis: Virtual
reality? Proceeding of the Sysmex European Symposium
2005:94-101.
jeszcze ustalenia dodatkowych wewnątrzlaboratoryjnych
kryteriów oceny komórek w rutynowej pracy w oparciu o protokół H20A2 CLSI/NCCLS (Clinical and Laboratory Standards Institute), a także ustawicznego szkolenia personelu
obsługującego System oraz poszerzonej dalszej weryfikacji,
są obiecujące, a System CellaVision™DM8 wydaje się być
urządzeniem pomocnym we wstępnej ocenie wzoru odsetkowego krwinek białych, z dobrą korelacją pomiędzy wynikami otrzymanymi z użyciem aparatu hematologicznego
Adres do korespondencji:
Barbara Masłyk
Centrum Onkologii – Instytut, O/Gliwice
ul. Wybrzeże Armii Krajowej 15, 44-101 Gliwice
Tel. (32) 278 94 39
e-mail [email protected]
(Praca wpłynęła do Redakcji: 2011-01-24)
(Praca przekazana do opublikowania: 2011-02-10)
389