Morfologia krwi obwodowej
Morfologia krwi obwodowej (ang. complete blood counts, CBC) to jedno z
podstawowych badań dostarczających istotnych informacji na temat stanu
zdrowia pacjenta poprzez ocenę liczby i budowy trzech podstawowych
rodzajów krwinek: białych (leukocytów), czerwonych (erytrocytów) oraz
płytek krwi (trombocytów).
Badanie wykonuje się z krwi pełnej pobranej na antykoagulant: K2EDTA lub
K3EDTA.
Morfologia krwi obwodowej obejmuje szereg parametrów określających stan
poszczególnych układów (3,4,7, 8,9):
1. Układ czerwonokrwinkowy
– erytrocyty (ang. red blood cells, RBC)- wskazuje na ilość krwinek czerwonych w
określonej jednostce objętości (n x106/µl)
– hemoglobina (ang. hemoglobin, Hb)- wskazuje na ilość hemoglobiny – białka,
barwnika krwi odpowiedzialnego za przenoszenie tlenu- w określonej jednostce
objętości (g/dl)
– hematokryt (ang. hematocrit, Hct)- jest to stosunek objętości erytrocytów do
objętości pełnej krwi (%)
– MCV (ang. mean cell volume) – określa średnią objętość krwinki czerwonej (fL)
– MCH (and. mean corpuscular hemoglobin)- określa średnią masę hemoglobiny w
erytrocycie (pg)
– MCHC (ang. mean corpuscular hemoglobin concentration) – określa średnie
stężenie hemoglobiny w krwinkach czerwonych (g/dl)
– RDW (ang. red distibution width)- określa anizocytozę erytrocytów (fL)
– retikulocyty (ang. reticulocyte, RET) – określa ilość młodych krwinek
czerwonych, wyrażony w promilach lub jako wartość bezwzględna, czasami
uwzględnia podział wg dojrzałości retikulocytów na frakcję młodych retikulocytów
HFR (ang. high fluorescence reticulocytes), średnio dojrzałych retikulocytów MFR
(ang.medium fluorescence reticulocytes) oraz dojrzałych retikulocytów LFR (ang.
low fluorescence reticulocytes), przy czym HFR i MFR zliczane są razem jako
niedojrzałe retikulocyty IFR (ang. immature red cell fraction).
2. Układ białokrwinkowy
– leukocyty (ang. white blood cells, WBC)- określa całkowitą ilość krwinek białych
3
w określonej jednostce objętości (n x10 / µl)
3
– poszczególne frakcje leukocytarne (n x x10 / µl oraz w %) :
granulocyty obojętnochłonne (and. neutrophils, NEUT)- z jądrem segmentowanym
lub pałeczkowatym,
granulocyty kwasochłonne (ang. eosinophils, EOS),
granulocyty zasadochłonne (ang. basophils, BASO),
limfocyty (ang. lymphocytes, LYMPH),
monocyty (ang. monocytes, MONO).
Dodatkowo w rozmazie krwi obwodowej mogą pojawić się atypowe limfocyty oraz
różne młodsze formy (mielocyty, mieloblasty i inne).
3. Trombocyty
– trombocyty (ang. platelets, PLT) – określa ilość płytek krwi w określonej
jednostce objętości (n x 109/l)
– PCT (ang. plateletcrit) – określa stosunek objętości masy płytkowej do całkowitej
objętości krwi (%)
– MPV (ang. mean platelet volume)- określa średnią objętość trombocyta (fL)
– PDW (ang. platelet distribution width)- określa anizocytozę płytek krwi (fL)
– P-LCR(ang.platelet large cell ratio)- określa odsetek dużych płytek o objętości
powyżej 12 fL (%)
Zmniejszenie lub zwiększenie liczby krwinek może wynikać zarówno z
pojawienia się różnych chorób krwi jak i nieprawidłowości w obrębie innych
układów i narządów.
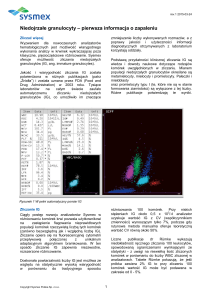
Wartości referencyjne zależą od wieku, płci oraz metody stosowanej w danym
laboratorium. Przykładowo prawidłowe wartości leukocytów mogą wyglądać tj.
przedstawiono w tabeli 1.
Tabela 1. Przykładowe normy różnych parametrów morfologii krwi
obwodowej w podziale na poszczególne układy oraz wiek (5,7,10)
Poszczególne parametry morfologii krwi obwodowej ulegają pewnym
fizjologicznym przejściowym wahaniom, a także określonym zmianom w
niektórych stanach patologicznych. Mogą to być zarówno zmiany ilościowe jak i
jakościowe.
Tab.2. Wybrane przyczyny zmian parametrów morfologii krwi obwodowej
(4,5,6,7).
Morfologia podstawowa (znana także jako morfologia 3 diff) obejmuje analizę 3
frakcji krwinek białych, natomiast morfologia pełna (znana także jako 5 diff)
dotyczy analizy 5 frakcji krwinek białych. Analizatory 8 diff wyodrębniają
dodatkowo trzy populacje: niedojrzałych form neutrofili, limfocytów oraz
monocytów (5).
Analizatory hematologiczne oznaczają poszczególne frakcje leukocytów
wykorzystując różne metody takie jak cytometria przepływowa, technika
impedancyjna, cytochemia lub kombinacje tych metod (1). Metoda impedancyjna
jest podstawową metodą wykorzystującą zmianę wartości pola magnetycznego,
wykorzystywaną w analizatorach hematologicznych 3 diff (5).
Pomimo faktu, iż podczas oceny leukocytów we krwi obwodowej to manualny
rozmaz krwi wciąż uważany jest za złoty standard, metody automatyczne
zaczynają powoli zastępować tą tradycyjną metodę, stając się podstawową metodą
skriningową w wykrywaniu zaburzeń hematologicznych. Dzieje się tak głównie
dlatego, że rozmaz ręczny jest metodą wymagającą stosunkowo dużego nakładu
pracy oraz dużego doświadczenia, zwłaszcza przy rozróżnianiu patologii,
natomiast metody automatyczne informują użytkownika o wielu
nieprawidłowościach, oflagowując je i pozostawiając do dalszej oceny specjalisty
(ocena histogramów, skategramów, sygnalizowanych nieprawidłowości). Czasami
wyniki uzyskane z analizatora wymagają dodatkowo przygotowania rozmazu
manualnego i poddania go wprawnemu oku diagnosty. Podczas interpretacji
wyniku badania morfologii krwi należy pamiętać, że analizatory mierzą inne cechy
komórek niż badanie mikroskopowe (2).
Tab.3. Metody oznaczania poszczególnych komórek krwi przez analizatory
hematologiczne 5-diff (5,7).
Konieczność uwzględniania kosztów w opiece medycznej zmusza do
zlecania badań, które są stosunkowo tanie i niosą ze sobą szereg
podstawowych informacji o zdrowiu pacjenta, pozwalając na ewentualne
ukierunkowanie dalszej diagnostyki. Wiele chorób przebiega bezobjawowo
lub skąpoobjawowo, stąd też wyłączne badanie fizykalne nie może być
podstawą wykluczenia istnienia stanów chorobowych. Morfologia krwi
obwodowej jest badaniem szybkim, tanim i szeroko dostępnym w
laboratoriach, co stwarza możliwość regularnej podstawowej kontroli
organizmu.
mgr Agnieszka Helis, diagnosta laboratoryjny
Piśmiennictwo:
1. Van der Meer W. Blood Cell Morphology: Controversies and Alternatives.
Thesis Radboud University Nijmegen, 2006,The Netherlands. Print. Quickprint BV
Nijmegen.
2. Jung S. Differential Blast Counts Obtained by Automated Blood Cell Analyzers.
Korean J Lab Med, 2010; 30: 540-546.
3. O’Neil P. et al. Performance Evaluation of the Complete Blood Count and White
Blood Cell Differential Parameters on the AcT 5diff Hematology Analyzer.
Laboratory Hematology, 7: 116–124.
4. Rapson D., Matthews J. Interpreting blond counts. Online available.
5. Mazur B. Rola analizatorów hematologicznych w różnicowaniu krwinek białych.
Hematology Line, 2012; 1,13: 3-7.
6. Wrzyszcz A. Znaczenie makro- i mikrocytozy krwinek czerwonych w
diagnostyce laboratoryjnej. Hematology Line, 2012, 1, 13: 8-15.
7. Lewandowski K. Płytki krwi w rutynowej diagnostyce hematologicznej.
Hematology Line, 2012, 1, 13: 20-25.
8. Sysmex. Platelet distribution curves: interpretation, potentials and limitations.
Sysmex Xtra Online, 2011: 1-6. Online available.
9.Sysmex. Principle for measuring reticulocytes with XE-5000 and XE-2100,
making use of bioimaging technology. The Cell Analysis Center 2007, 3: 1-5.
Online available.
10. Laboratory Reference Range Study, BCH, Adult values, 1996 HE1A. 696.
Online available.
Data publikacji: 30.03.2016r.