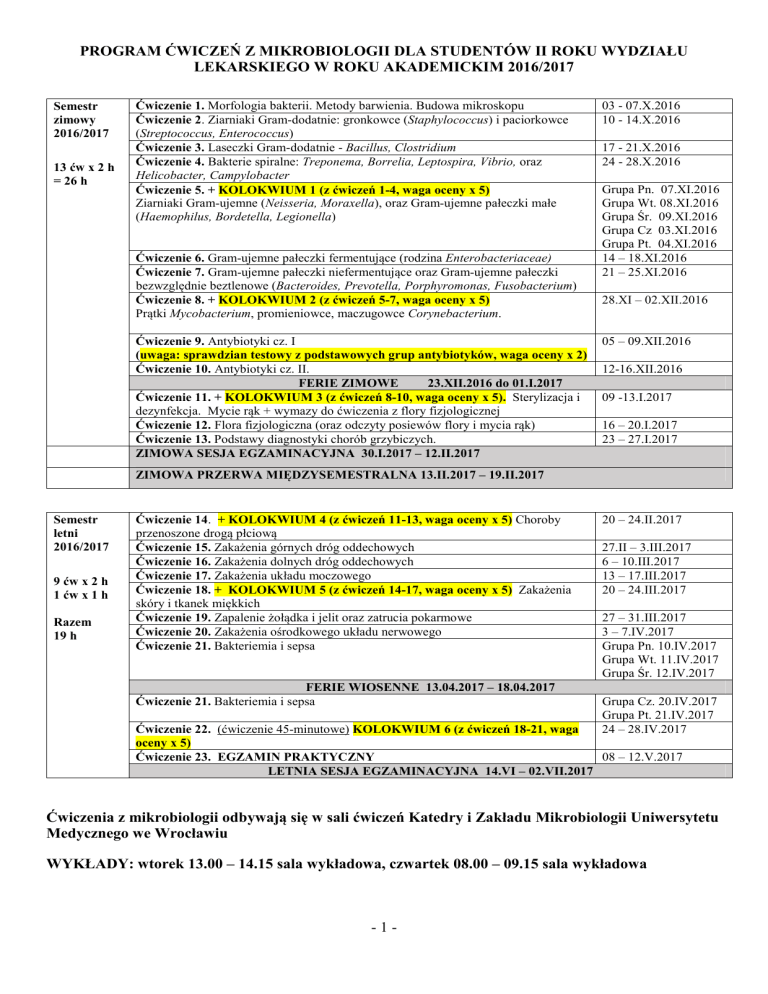
PROGRAM ĆWICZEŃ Z MIKROBIOLOGII DLA STUDENTÓW II ROKU WYDZIAŁU
LEKARSKIEGO W ROKU AKADEMICKIM 2016/2017
Semestr
zimowy
2016/2017
13 ćw x 2 h
= 26 h
Ćwiczenie 1. Morfologia bakterii. Metody barwienia. Budowa mikroskopu
Ćwiczenie 2. Ziarniaki Gram-dodatnie: gronkowce (Staphylococcus) i paciorkowce
(Streptococcus, Enterococcus)
Ćwiczenie 3. Laseczki Gram-dodatnie - Bacillus, Clostridium
Ćwiczenie 4. Bakterie spiralne: Treponema, Borrelia, Leptospira, Vibrio, oraz
Helicobacter, Campylobacter
Ćwiczenie 5. + KOLOKWIUM 1 (z ćwiczeń 1-4, waga oceny x 5)
Ziarniaki Gram-ujemne (Neisseria, Moraxella), oraz Gram-ujemne pałeczki małe
(Haemophilus, Bordetella, Legionella)
Ćwiczenie 6. Gram-ujemne pałeczki fermentujące (rodzina Enterobacteriaceae)
Ćwiczenie 7. Gram-ujemne pałeczki niefermentujące oraz Gram-ujemne pałeczki
bezwzględnie beztlenowe (Bacteroides, Prevotella, Porphyromonas, Fusobacterium)
Ćwiczenie 8. + KOLOKWIUM 2 (z ćwiczeń 5-7, waga oceny x 5)
Prątki Mycobacterium, promieniowce, maczugowce Corynebacterium.
Ćwiczenie 9. Antybiotyki cz. I
(uwaga: sprawdzian testowy z podstawowych grup antybiotyków, waga oceny x 2)
Ćwiczenie 10. Antybiotyki cz. II.
FERIE ZIMOWE
23.XII.2016 do 01.I.2017
Ćwiczenie 11. + KOLOKWIUM 3 (z ćwiczeń 8-10, waga oceny x 5). Sterylizacja i
dezynfekcja. Mycie rąk + wymazy do ćwiczenia z flory fizjologicznej
Ćwiczenie 12. Flora fizjologiczna (oraz odczyty posiewów flory i mycia rąk)
Ćwiczenie 13. Podstawy diagnostyki chorób grzybiczych.
ZIMOWA SESJA EGZAMINACYJNA 30.I.2017 – 12.II.2017
03 - 07.X.2016
10 - 14.X.2016
17 - 21.X.2016
24 - 28.X.2016
Grupa Pn. 07.XI.2016
Grupa Wt. 08.XI.2016
Grupa Śr. 09.XI.2016
Grupa Cz 03.XI.2016
Grupa Pt. 04.XI.2016
14 – 18.XI.2016
21 – 25.XI.2016
28.XI – 02.XII.2016
05 – 09.XII.2016
12-16.XII.2016
09 -13.I.2017
16 – 20.I.2017
23 – 27.I.2017
ZIMOWA PRZERWA MIĘDZYSEMESTRALNA 13.II.2017 – 19.II.2017
Semestr
letni
2016/2017
9 ćw x 2 h
1 ćw x 1 h
Razem
19 h
Ćwiczenie 14. + KOLOKWIUM 4 (z ćwiczeń 11-13, waga oceny x 5) Choroby
przenoszone drogą płciową
Ćwiczenie 15. Zakażenia górnych dróg oddechowych
Ćwiczenie 16. Zakażenia dolnych dróg oddechowych
Ćwiczenie 17. Zakażenia układu moczowego
Ćwiczenie 18. + KOLOKWIUM 5 (z ćwiczeń 14-17, waga oceny x 5) Zakażenia
skóry i tkanek miękkich
Ćwiczenie 19. Zapalenie żołądka i jelit oraz zatrucia pokarmowe
Ćwiczenie 20. Zakażenia ośrodkowego układu nerwowego
Ćwiczenie 21. Bakteriemia i sepsa
FERIE WIOSENNE 13.04.2017 – 18.04.2017
Ćwiczenie 21. Bakteriemia i sepsa
20 – 24.II.2017
27.II – 3.III.2017
6 – 10.III.2017
13 – 17.III.2017
20 – 24.III.2017
27 – 31.III.2017
3 – 7.IV.2017
Grupa Pn. 10.IV.2017
Grupa Wt. 11.IV.2017
Grupa Śr. 12.IV.2017
Grupa Cz. 20.IV.2017
Grupa Pt. 21.IV.2017
24 – 28.IV.2017
Ćwiczenie 22. (ćwiczenie 45-minutowe) KOLOKWIUM 6 (z ćwiczeń 18-21, waga
oceny x 5)
08 – 12.V.2017
Ćwiczenie 23. EGZAMIN PRAKTYCZNY
LETNIA SESJA EGZAMINACYJNA 14.VI – 02.VII.2017
Ćwiczenia z mikrobiologii odbywają się w sali ćwiczeń Katedry i Zakładu Mikrobiologii Uniwersytetu
Medycznego we Wrocławiu
WYKŁADY: wtorek 13.00 – 14.15 sala wykładowa, czwartek 08.00 – 09.15 sala wykładowa
-1-
SZCZEGÓŁOWY PLAN ĆWICZEŃ Z MIKROBIOLOGII
semestr zimowy 2016/2017
ĆWICZENIE 1 (03.X - 07.X. 2016)
TEMAT: MORFOLOGIA BAKTERII. METODY BARWIENIA PREPARATÓW.
Część teoretyczna:
Organizacja i dyscyplina pracy w czasie ćwiczeń z mikrobiologii.
Typy mikroskopów używanych na ćwiczeniach: świetlny, z ciemnym polem widzenia, fluorescencyjny.
Morfologia bakterii.
Metody barwienia preparatów mikroskopowych: barwienie proste, złożone, pozytywne, negatywne,
negatywno-pozytywne.
Część praktyczna:
Sporządzanie i oglądanie w mikroskopie świetlnym preparatów z hodowli bakterii; barwienie metodą Grama
(Staphylococcus sp., Bacillus sp, Escherichia coli)
Demonstracja gotowych preparatów z bakterii w mikroskopie świetlnym, w ciemnym polu
i fluorescencyjnym.
ĆWICZENIE 2 (10.X – 14.X. 2016)
TEMAT: ZIARNIAKI GRAM-DODATNIE: GRONKOWCE I PACIORKOWCE
Część teoretyczna:
Charakterystyka i chorobotwórczość Staphylococcus aureus, Staph.epidermidis, Staph.saprophyticus.
Charakterystyka i chorobotwórczość Streptococcus pyogenes, Streptococcus agalactiae, Streptococcus
pneumoniae, Streptococcus z gr. orale, Enterococcus sp.
Część praktyczna:
Demonstracja hodowli na agarze z krwią, opis morfologii kolonii, rodzaje hemolizy.
Demonstracja gotowych preparatów z omawianych bakterii w mikroskopie świetlnym
Testy identyfikacyjne dla gronkowców: wytwarzanie katalazy, CF (wykonanie), wrażliwość na nowobiocynę i
furazolidon, test koagulazowy (demonstracja), ID32 Staph do odczytu, Crystal GP - demonstracja.
Testy identyfikacyjne dla paciorkowców: wrażliwość na bacytracynę i optochinę, szereg biochemiczny dla
enterokoków, wykrywanie antygenów grupowych (demonstracja Slidex Strepto Kit), Api20Strep do odczytu,
Crystal GP -demonstracja.
ĆWICZENIE 3 (17.X – 21.X. 2016)
TEMAT: LASECZKI GRAM-DODATNIE: BACILLUS, CLOSTRIDIUM.
Część teoretyczna:
Charakterystyka i chorobotwórczość laseczek: Bacillus anthracis, Clostridium tetani, Clostridium difficile,
Clostridium botulinum, Clostridium perfringens.
Metody hodowli bakterii beztlenowych – anaerostat fizyczny i chemiczny, generatory atmosfery beztlenowej
Schemat profilaktyki pre- i poekspozycyjnej przy podejrzeniu tężca.
Część praktyczna:
Demonstracja hodowli laseczek beztlenowych na podłożach wybiórczych: Agar Schaedler’a z krwią, bulion
tioglikolanowy.
Demonstracja Bacillus subtilis na Agarze zwykłym – morfologia kolonii laseczek na wybranych podłożach.
Demonstracja gotowych preparatów bakteryjnych w mikroskopie świetlnym.
Demonstracja testów identyfikacyjnych dla bakterii beztlenowych - odczyt testów API 20A, demonstracja
Crystal ANR.
-2-
ĆWICZENIE 4 (24.X – 28.X. 2016)
TEMAT: BAKTERIE SPIRALNE: TREPONEMA, BORRELIA, LEPTOSPIRA, VIBRIO,
HELICOBACTER, CAMPYLOBACTER
Część teoretyczna:
Charakterystyka i chorobotwórczość Treponema pallidum, Borrelia recurrentis, Borrelia burgdorferi,
Leptospira, Vibrio, Campylobacter jejuni, Helicobacter pylori.
Część praktyczna:
Demonstracja bezpośredniego preparatu bioptatu z żołądka z Helicobacter pylori.
Demonstracja hodowli Campylobacter i Helicobacter.
Oglądanie gotowych preparatów z Campylobacter i Helicobacter.
Demonstracja preparatu srebrzonego z Treponema pallidum
Demonstracja Leptospira w mikroskopie z ciemnym polem widzenia.
ĆWICZENIE 5 + KOLOKWIUM 1 (z ćwiczeń 1-4)
(grupy poniedziałkowe 7.XI.2016, grupy wtorkowe 8.XI.2016, grupy środowe 9.XI.2016, grupy
czwartkowe 3.XI,2016 grupy piątkowe 4.XI.2016)
TEMAT: ZIARNIAKI GRAM-UJEMNE (NEISSERIA, MORAXELLA) ORAZ GRAMUJEMNE PAŁECZKI MAŁE: HAEMOPHILUS, BORDETELLA, LEGIONELLA
Część teoretyczna:
Charakterystyka i chorobotwórczość rodzaju Neisseria i Moraxella
Charakterystyka i chorobotwórczość Gram(-) pałeczek małych: Haemophilus, Bordetella, Legionella
Aktualny kalendarz szczepień dotyczący bakterii Neisseria, Bordetella, Haemophilus
Omówienie testu z czynnikami wzrostowymi BX i BV dla Haemophilus influenzae
Część praktyczna:
Demonstracja hodowli bakterii na podłożach Neisseria i Moraxella na Agarze z krwią, Haemophilus na podłożu
Cassmana (podłoże czekoladowe)
Demonstracja testów identyfikacyjnych: Crystal NH, Api NH do identyfikacji Neisseria meningitidis i
Haemophilus influenzae
Różnicowanie Moraxella catarrhalis od szczepów Neisseria wchodzących w skład flory fizjologicznej górnych
dróg oddechowych – test BC na agarze Muller-Hintona (MH)
Oglądanie gotowych preparatów
ĆWICZENIE 6 (14.XI – 18.XI. 2016)
TEMAT: GRAM-UJEMNE PAŁECZKI FERMENTUJĄCE: ENTEROBACTERIACEAE
Część teoretyczna:
Charakterystyka i chorobotwórczość pałeczek rodziny Enterobacteriaceae: Salmonella, Shigella, Escherichia,
Proteus, Klebsiella, Enterobacter.
Część praktyczna:
Demonstracja hodowli bakterii na podłożach wybiórczych: Mac Conkey’a i SS (Enterobacteriaceae)
Morfologia kolonii pałeczek Gram-ujemnych Enterobacteriaceae na wybranych podłożach
Demonstracja gotowych preparatów bakteryjnych w mikroskopie świetlnym
Identyfikacja Gram-ujemnych pałeczek- odczyt testów ID32GN, demonstracja Crystal ENF.
-3-
ĆWICZENIE 7 (21.XI– 25.XI.2016)
TEMAT: GRAM-UJEMNE PAŁECZKI NIEFERMENTUJĄCE: PSEUDOMONAS,
ACINETOBACTER, STENOTROPHOMONAS ORAZ GRAM-UJEMNE PAŁECZKI
BEZWZGLĘDNIE BEZTLENOWE: BACTEROIDES, PORPHYROMONAS, PREVOTELLA
Część teoretyczna:
Charakterystyka i chorobotwórczość pałeczek niefermentujących: Pseudomonas aeruginosa, Acinetobacter
baumannii, Stenotrophomonas maltophilia.
Charakterystyka i chorobotwórczość Gram-ujemnych bakterii bezwzględnie beztlenowych (Bacteroides,
Prevotella, Porphyromonas, Fusobacterium).
Część praktyczna:
Demonstracja hodowli bakterii tlenowych i beztlenowych na podłożach wybiórczych: agar Muller-Hintona
(MH), Mac Conkey’a (MC) i Schaedler’a – obserwacja morfologii kolonii bakteryjnych
Demonstracja gotowych preparatów w mikroskopie świetlnym.
Identyfikacja Gram-ujemnych pałeczek niefermentujących: odczyt testów ID32GN i Crystal ENF.
Test na wytwarzanie oksydazy (metodą paskową !) i barwników dla G(-) pałeczek niefermentujących.
Demonstracja i identyfikacja Gram-ujemnych pałeczek bezwzględnie beztlenowych: odczyt testów API 20 A
dla Bacteroides fragilis, demonstracja testu Crystal ANR.
ĆWICZENIE 8 (28.XI – 2.XII. 2016) + KOLOKWIUM 2 ( z ćwiczeń 5-7)
TEMAT: PRĄTKI Mycobacterium , PROMIENIOWCE Actinomyces, Nocardia,
MACZUGOWCE Corynebacterium.
Część teoretyczna:
Charakterystyka i chorobotwórczość maczugowców – Corynebacterium diphtheriae.
Szczepionka DPT (Diphtheria – Pertussis - Tetanus).
Podział taksonomiczny prątków
Charakterystyka i chorobotwórczość Mycobacterium tuberculosis oraz mykobakterii MOTT.
Postacie kliniczne gruźlicy, diagnostyka, szczepienia (BCG), próby tuberkulinowe
Odporność śródzakaźna – fenomen Kocha
Charakterystyka i chorobotwórczość Actinomyces spp. i Nocardia spp.
Część praktyczna:
Demonstracja hodowli i gotowych preparatów: Corynebacterium.
Demonstracja hodowli i gotowych preparatów Actinomyces spp. i Nocardia spp.
Testy identyfikacyjne dla maczugowców (ApiCoryne), dla promieniowców (API 20A).
Demonstracja hodowli prątków na podłożu Loewensteina-Jensena: Mycobacterium smegmatis, Mycobacterium
fortuitum, Mycobacterium tuberculosis
Oglądanie preparatów plwociny od chorego prątkującego barwionych metodą Ziehl-Neelsena (czynnik
wiązkowy – cord factor).
Oznaczanie wrażliwości prątków na tuberkulostatyki – demonstracja antybiogramu.
-4-
ĆWICZENIE 9 (5.XII – 9.XII. 2016) + SPRAWDZIAN TESTOWY „WEJŚCIÓWKA”
(ze znajomości podstawowych grup antybiotyków)
TEMAT: ANTYBIOTYKI część I. MECHANIZMY DZIAŁANIA ANTYBIOTYKÓW
Część teoretyczna:
Charakterystyka najważniejszych grup antybiotyków - mechanizm działania, spektrum przeciwbakteryjne,
farmakokinetyka: antybiotyki beta-laktamowe, aminoglikozydy, tetracykliny, makrolidy, ketolidy,
linkozamidy, glikopeptydy, fluorochinolony, sulfonamidy, nitroimidazole, tygecyklina, polimyksyny
(kolistyna), oksazolidynony (linezolid).
Metody oznaczania wrażliwości bakterii na antybiotyki
- Metoda dyfuzyjno-krążkowa
- Metoda seryjnych rozcieńczeń w podłożu bulionowym MH – oznaczanie MIC i MBC leku (demonstracja)
- Metoda E-testów – oznaczanie MIC leku
- Metoda rozcieńczenia leku w pożywce Loewensteina – Jensena dla prątków gruźlicy – demonstracja
Część praktyczna:
Wykonanie antybiogramu metodą dyfuzyjno-krążkową dla wybranych szczepów bakterii:
- Staphylococcus aureus MRSA z ropy – zakażenie rany poopreacyjnej
- Enterococcus HLAR z moczu – zakażenie układu moczowego
- Klebsiella pneumoniae ESBL+ z plwociny – zapalenie płuc związane z wentylacją mechaniczną
ĆWICZENIE 10 (12.XII – 16.XII. 2016)
TEMAT: ANTYBIOTYKI część II. MECHANIZMY OPORNOŚCI BAKTERII
Część teoretyczna:
Omówienie wybranych mechanizmów oporności bakterii na antybiotyki: MRS, MLSB, VISA, VRSA, HLAR,
VRE, GRE, MBL, ESBL, KPC
Część praktyczna:
Odczyt i interpretacja antybiogramów z poprzedniego ćwiczenia.
Odczyt antybiogramów przygotowanych metodą ATB dla różnych szczepów bakterii.
Wykonanie testu z cefinazą – wykrywanie beta-laktamaz u Moraxella.
Demonstracja antybiogramów z różnymi mechanizmami oporności bakterii: MRSA, MLSB, ESBL
Demonstracja E-testu (VRE) oraz demonstracja testu z EDTA (MBL).
……………………………………….FERIE ZIMOWE……………..……………………..…………
-5-
ĆWICZENIE 11 (9.I – 13.I. 2017) + KOLOKWIUM 3 (z ćwiczeń 8-10)
TEMAT: STERYLIZACJA i DEZYNFEKCJA – MYCIE RĄK.
POBIERANIE WYMAZÓW DO ĆWICZEŃ Z FLORY FIZJOLOGICZNEJ.
Część teoretyczna:
Omówienie metod sterylizacji i dezynfekcji oraz preparatów stosowanych w antyseptyce.
Część praktyczna:
Doświadczenie: higieniczne mycie rąk (mycie + jednokrotna dezynfekcja) - jedna płytka agarowa dla zespołu
dwóch studentów.
Pobieranie wymazów do ćwiczeń z flory fizjologicznej: wymaz z nosa, gardła, ucha, spojówki oka, skóry
suchej i wilgotnej.
ĆWICZENIE 12 (16.I – 20.I. 2017)
TEMAT: FLORA FIZJOLOGICZNA
Część teoretyczna:
Omówienie roli flory endogennej człowieka.
Chorobotwórczość i anatomiczne rozmieszczenie flory fizjologicznej człowieka.
Omówienie pojęć: kolonizacja, nosicielstwo, zakażenie oportunistyczne.
Część praktyczna:
Ocena skuteczności higienicznego mycia rąk – odczyt doświadczenia
Morfologia kolonii stanowiących florę fizjologiczną różnych miejsc: opis morfologii, wykonanie i oglądanie
barwionych preparatów różnych typów drobnoustrojów.
ĆWICZENIE 13 (23.I – 27.I. 2017)
TEMAT: PODSTAWY DIAGNOSTYKI CHORÓB GRZYBICZYCH.
Część teoretyczna:
Omówienie najczęściej występujących przypadków grzybic miejscowych i układowych oraz czynników
etiologicznych (Candida, Cryptococcus, Aspergillus).
Omówienie metod pobierania, przesyłania i zasad hodowli grzybów chorobotwórczych.
Charakterystyka najważniejszych grup leków przeciwgrzybiczych: polieny (nystatyna, natamycyna,
amfoterycyna B), imidazole, triazole, antymetabolity (5-fluorocytozyna), echinokandyny.
Część praktyczna:
Identyfikacja grzybów drożdżopodobnych:
- obserwacja morfologii hodowli na podłożu Sabouraud’a i Chromagar Candida,
- obserwacja blastospor i artrospor w preparatach barwionych metodą Grama,
- odczyt testu filamentacji (wykonanie preparatów natywnych),
- obserwacja charakterystycznych struktur (chlamydospor) w mikrohodowli,
- odczyt testu ID 32 C.
- demonstracja ustalenia wartości MIC dla Candida - E-test
Grzyby pleśniowe i dermatofity:
- obserwacja morfologii hodowli Aspergillus i Penicillium na podłożu Czapka,
- obserwacja gotowych preparatów dermatofitów w laktofenolu (Trichophyton, Epidermophyton,
Microsporum).
………………. SESJA I ZIMOWA PRZERWA MIĘDZYSEMESTRALNA…………..…………
-6-
ĆWICZENIE 14 (20.II – 24.II. 2017) + KOLOKWIUM 4 (z ćwiczeń 11-13)
TEMAT: CHOROBY PRZENOSZONE DROGĄ PŁCIOWĄ
Część teoretyczna
Omówienie zakażeń przenoszonych drogą płciową oraz czynników etiologicznych STD.
Część praktyczna – ćwiczenie demonstracyjne
Diagnostyka kiły:
- USR i TPHA do odczytu i interpretacji
- FTA-ABS i ELISA do omówienia
- preparat srebrzony z tkanki mózgowej
Diagnostyka rzeżączki (GU):
- hodowla gonokoków na podłożu Roiron
- wykonanie testu na oksydazę
- demonstracja preparatu z ropy rzeżączkowej
- omówienie testu przesiewowego Gonoline Duo 2
Diagnostyka rzęsistkowicy:
- demonstracja preparatu z Trichomonas vaginalis (Giemsa)
Diagnostyka NGU:
- hodowla Mycoplasma hominis
- Mycoplasma IST-test do odczytu i interpretacji
- Chlamydia trachomatis (zakażona linia komórkowa Mc Coy’a - zdjęcie)
Diagnostyka grzybicy dróg rodnych
- hodowla grzybów Candida na podłożu Sabourauda z antybiotykiem
UWAGA! OPRACOWANIE MATERIAŁÓW DIAGNOSTYCZNYCH DO ĆWICZENIA Z ZAKAŻEŃ GÓRNYCH DRÓG
ODDECHOWYCH
1. wymaz z gardła (angina paciorkowcowa – Streptococcus pyogenes) – posiew na ½ AK
2. wymaz z gardła (zakażenie wirusowe – flora fizjologiczna) –
posiew na ½ AK
ĆWICZENIE 15 (27.II – 3.III. 2017)
TEMAT: ZAKAŻENIA GÓRNYCH DRÓG ODDECHOWYCH
Część teoretyczna:
Omówienie postaci klinicznych oraz etiologii zakażeń górnych dróg oddechowych.
Schemat badania mikrobiologicznego. Pobieranie i przesyłanie próbek do badania.
Część praktyczna:
Odczyt posiewów próbek z zakażeń górnych dróg oddechowych:
1. wymaz z gardła (angina paciorkowcowa) – Streptococcus pyogenes – wykonanie preparatu mikroskopowego
barwionego metodą Grama z własnego posiewu, test wrażliwości na bacytracynę (demonstracja), test do
wykrywania antygenów S. pyogenes (Slidex Strepto Kit)
2. wymaz z gardła (zakażenie wirusowe/flora fizjologiczna) – demonstracja testu z optochiną
Demonstracja hodowli wybranych patogenów górnych dróg oddechowych: Staphylococcus aureus,
Streptococcus pneumoniae, Moraxella catarrhalis, Corynebacterium diphtheriae
Demonstracja bezpośredniego z wymazu z gardła chorego na anginę Plaut-Vincent’a.
Demonstracja szybkich testów w kierunku anginy ropnej, zakażenia RSV.
Analiza przykładowych wyników badań mikrobiologicznych
UWAGA! OPRACOWANIE MATERIAŁÓW DO ĆWICZENIA Z ZAKAŻEŃ DOLNYCH DRÓG ODDECHOWYCH
1. plwocina (pozaszpitalne zapalenie płuc - Streptococcus pneumoniae) –
posiew na AK, MC
2. A) wydzielina oskrzelowa (VAP – Acinetobacter baumannii) –
posiew na ½ AK, ½ MC, ½ SAB
B) krew (VAP – Acinetobacter baumannii) posiew na ½ AK, ½ MC, ½ SAB
-7-
ĆWICZENIE 16 (6.III – 10.III. 2017)
TEMAT: ZAKAŻENIA DOLNYCH DRÓG ODDECHOWYCH
Część teoretyczna:
Omówienie postaci klinicznych oraz etiologii zakażeń dolnych dróg oddechowych.
Schemat badania mikrobiologicznego. Zasady pobierania i transportu próbek z dróg oddechowych.
Część praktyczna:
Odczyt posiewów próbek z zakażeń dolnych dróg oddechowych:
1. plwocina (zapalenie płuc, pacjent pozaszpitalny) – Streptococcus pneumoniae – wykonanie preparatu
barwionego metodą Grama z posiewów własnych, test z optochiną (demonstracja), antybiogram.
2. wydzielina z drzewa oskrzelowego + krew (pacjent hospitalizowany – OIT, VAP) Acinetobacter baumannii
– wykonanie preparatu mikroskopowego barwionego metodą Grama z posiewów własnych, odczyt testu
ID32GN, antybiogram.
Demonstracja szybkich testów w kierunku Legionella. RSV
Analiza przykładowych wyników badań mikrobiologicznych
UWAGA! OPRACOWANIE MATERIAŁÓW DIAGNOSTYCZNYCH DO ZAKAŻEŃ UKŁADU MOCZOWEGO
1. mocz (pacjent ambulatoryjny, Escherichia coli) 2. mocz (pacjent zacewnikowany, Proteus mirabilis) -
Posiew ilościowy na AK, MC.
Posiew ilościowy na AK, MC.
ĆWICZENIE 17 (13.III – 17.III. 2016)
TEMAT: ZAKAŻENIA UKŁADU MOCZOWEGO
Część teoretyczna:
Omówienie czynników etiologicznych zakażeń układu moczowego.
Schemat badania mikrobiologicznego moczu.
Pobieranie i przesyłanie materiałów diagnostycznych do badania zakażeń układu moczowego.
Część praktyczna:
Odczyt posiewów materiałów diagnostycznych:
mat.1. identyfikacja E. coli - test ID32GN, interpretacja antybiogramu,
mat.2. identyfikacja P. mirabilis - test ID32GN, interpretacja antybiogramu
demonstracja hodowli wybranych patogenów układu moczowego: E.coli, Klebsiella spp., Pseudomonas
aeruginosa, Staph.epidermidis, Staph.saprophyticus, Enterococcus spp., Candida spp.
demonstracja testu Golda – wynik dodatni i ujemny.
demonstracja posiewu moczu zanieczyszczonego
demonstracja gotowych zestawów do półilościowego posiewu moczu: Uriline, Uricult.
Analiza przykładowych wyników badań mikrobiologicznych
UWAGA! OPRACOWANIE MATERIAŁÓW DIAGNOSTYCZNYCH DO ĆWICZENIA Z ZAKAŻEŃ SKÓRY I TKANEK MIĘKKICH
1. wymaz z ropnia podprzeponowego (pacjent z ropniem podprzeponowym, Bacteroides fragilis + E. coli),
posiew na podłoża: AK, MC, ½ agar Schaedlera z krwią (tioglikolan jałowy do demonstracji).
2. ropa z czyraka na wymazówce (pacjent z czyrakiem mnogim, Staphylococcus aureus), posiew na podłoża: AK,
MC, ½ agar Schaedlera z krwią (tioglikolan jałowy do demonstracji).
3. Wymaz z rany oparzeniowej (pacjent po rozległym oparzeniu, Pseudomonas aeruginosa), posiew na podłoża:
AK, MC, bulion cukrowy.
-8-
ĆWICZENIE 18 (20.III – 24.III. 2017) + KOLOKWIUM 5 (z ćwiczeń 14-17)
TEMAT: ZAKAŻENIA SKÓRY i TKANEK MIĘKKICH.
Część teoretyczna
Omówienie czynników etiologicznych zakażeń skóry i tkanek miękkich.
Schemat badania mikrobiologicznego ropy. Pobieranie i przesyłanie próbek do badania.
Część praktyczna
Odczyt posiewów próbek ze zmian ropnych, identyfikacja szczepów, interpretacja antybiogramów.
Mat.1. identyfikacja Bacteroides – odczyt API 20A; identyfikacja E. coli: odczyt ID32GN; interpretacja
antybiogramu dla E.coli.
Mat.2. identyfikacja Staphylococcus: wykonanie testu na katalazę, demonstracja testu na obecność koagulazy,
odczyt ID32Staph, interpretacja antybiogramu
Mat.3. identyfikacja Pseudomonas aeruginosa: wykonanie testu na oksydazę metodą paskową (!), odczyt ID32GN,
interpretacja antybiogramu.
Demonstracja hodowli wybranych patogenów zakażeń skóry i tkanek miękkich: Escherichia coli, Pseudomonas
aeruginosa, Staphylococcus aureus, Bacteroides fragilis.
Demonstracja gotowych preparatów w/w patogenów w mikroskopie świetlnym.
Analiza przykładowych wyników badań mikrobiologicznych
UWAGA! OPRACOWANIE MATERIAŁÓW DO ĆWICZENIA Z ZAKAŻEŃ PRZEWODU POKARMOWEGO
1. Wymaz z odbytu (badanie nosicielstwa Salmonella/Shigella) – posiew na ½ MC, ½ SS, bulion SF
2. Wymaz z odbytu (biegunka, ograniczona flora fizjologiczna) – posiew na ½ MC, ½ SS, bulion SF
ĆWICZENIE 19 (27.III – 31.III. 2017)
TEMAT: ZAPALENIE ŻOŁĄDKA I JELIT ORAZ ZATRUCIA POKARMOWE
Część teoretyczna:
Omówienie czynników etiologicznych zakażeń przewodu pokarmowego.
Schemat badania mikrobiologicznego kału. Pobieranie i przesyłanie materiałów diagnostycznych.
Część praktyczna:
Odczyt posiewów materiałów diagnostycznych:
Mat.1.identyfikacja Salmonella: test ID32GN, demonstracja typowania serologicznego Salmonella
metodą aglutynacji szkiełkowej.
Mat.2. identyfikacja E. coli: test ID32GN,
demonstracja hodowli wybranych patogenów układu pokarmowego: Salmonella, Shigella, Escherichia coli,
Yersinia enterocolitica, Campylobacter jejuni.
Demonstracja gotowych preparatów w/w patogenów w mikroskopie świetlnym.
demonstracja testu do wykrywania rotawirusów i adenowirusów w kale: Rota-Adeno Kit.
demonstracja testu kasetkowego do wykrywania toksyn Clostridium difficile w kale
Analiza przykładowych wyników badań mikrobiologicznych
UWAGA! OPRACOWANIE MATERIAŁÓW DIAGNOSTYCZNYCH DO ĆWICZENIA Z ZAKAŻEŃ OUN
Materiał 1.
1a)
1b)
1c)
Pacjent z zapaleniem opon mózgowo-rdzeniowych (Neisseria meningitidis):
PMR na podłożu transportowo-wzrostowym Meningomedium - DEMONSTRACJA
PMR w jałowej probówce (PILOTKA) – studenci samodzielnie wykonują preparat bezpośredni
barwiony metodą Grama
krew na podłożu transportowo-wzrostowym - posiew na podłoża: ½AK, ½MC, ½Casman’a.
-9-
Materiał 2.
2a)
2b)
2c)
Pacjent z zapaleniem opon mózgowo-rdzeniowych (Streptococcus pneumoniae):
PMR na podłożu transportowo-wzrostowym Meningomedium - DEMONSTRACJA
PMR w jałowej probówce (PILOTKA) – studenci samodzielnie wykonują preparat bezpośredni
barwiony metodą Grama
krew na podłożu transportowo-wzrostowym - posiew na podłoża: ½AK, ½MC, ½Casman’a.
ĆWICZENIE 20 (3.IV – 7.IV.2016)
TEMAT: ZAKAŻENIA OŚRODKOWEGO UKŁADU NERWOWEGO
Część teoretyczna
Omówienie czynników etiologicznych zakażeń OUN.
Schemat badania mikrobiologicznego płynu mózgowo-rdzeniowego.
Pobieranie i przesyłanie próbek PMR do badań mikrobiologicznych.
Część praktyczna
Odczyt posiewów próbek krwi i płynu mózgowo-rdzeniowego (!PMR posiewa sala ćwiczeń!)
Barwienie i oglądanie preparatów z PMR (pilotka) z poprzedniego ćwiczenia
Materiał 1. identyfikacja Neisseria meningitidis: preparat mikroskopowy z posiewów własnych barwiony metodą
Grama, wykonanie testu na oksydazę, odczyt testu API NH, demonstracja testu Crystal NH.
Materiał 2. identyfikacja Streptococcus pneumoniae: preparat mikroskopowy z posiewów własnych barwiony metodą
Grama, demonstracja testu wrażliwości na optochinę, odczyt testu API 20 Strep, demonstracja testu Crystal GP, odczyt
i interpretacja antybiogramu dla Streptococcus pneumoniae z OUN
Demonstracja hodowli wybranych patogenów zakażeń centralnego układu nerwowego: Neisseria meningitidis
(AK), Streptococcus agalactiae (AK), Escherichia coli (MC), Haemophilus influenzae (Casman), Candida
albicans (SAB)
Demonstracja gotowych preparatów z w/w drobnoustrojów w mikroskopie świetlnym.
Analiza przykładowych wyników badań mikrobiologicznych
UWAGA! OPRACOWANIE MATERIAŁÓW DO ĆWICZENIA Z ZAKAŻEŃ OGÓLNOUSTROJOWYCH (SEPSA)
- dla grup poniedziałkowych, wtorkowych i środowych.
Materiał 1. Pacjent z podejrzeniem zakażenia krwi (Klebsiella pneumoniae): krew na podłożu transportowowzrostowym po 24 godz. inkubacji (krew dodatnia) - posiew na podłoża AK i MC
Materiał 2. Pacjent z zakażeniem odcewnikowym (Staphylococcus epidermidis): krew na podłożu transportowowzrostowym po 24 godz. Inkubacji (krew dodatnia) - posiew na podłoża AK i MC
Grupy czwartkowe i piątkowe, ze względu na ferie wiosenne, będą miały przygotowane ćwiczenia.
- 10 -
ĆWICZENIE 21 (grupy poniedziałkowe 10.IV.2017, grupy wtorkowe 11.IV.2017, grupy środowe
12.IV.2017, grupy czwartkowe 20.IV.2017, grupy piątkowe 21.IV.2017)
TEMAT: ZAKAŻENIA OGÓLNOUSTROJOWE - BAKTERIEMIA I SEPSA
Część teoretyczna
Omówienie czynników etiologicznych zakażeń ogólnoustrojowych
Schemat badania mikrobiologicznego krwi - pobieranie i przesyłanie próbek do badania.
Omówienie czynników ryzyka rozwinięcia się zakażenia krwi u pacjenta hospitalizowanego
Część praktyczna
Odczyt posiewów próbek krwi oraz interpretacja antybiogramów.
Materiał 1. identyfikacja Klebsiella pneumoniae: demonstracja testu Crystal ENF, odczyt testu ID32GN, odczyt
antybiogramu (szczep ESBL+)
Materiał 2. identyfikacja Staphylococcus epidermidis: demonstracja Crystal GP, odczyt testu ID32Staph, odczyt
antybiogramu (szczep MRCNS)
Demonstracja hodowli wybranych patogenów zakażeń ogólnoustrojowych: Streptococcus agalactiae,
Streptococcus salivarius, Staphylococcus epidermidis, Enterococcus faecalis, Pseudomonas aeruginosa,
Enterobacter cloacae, Candida albicans
Demonstracja gotowych preparatów z w/w drobnoustrojów w mikroskopie świetlnym.
Demonstracja podłoży transportowo-namnażających do posiewu płynów ustrojowych.
Demonstracja aparatu Bact Alert do hodowli próbek płynów ustrojowych.
Analiza przykładowych wyników badań mikrobiologicznych
!!! Ćwiczenie 45-minutowe
ĆWICZENIE 22 (24.IV – 28.IV. 2017)
KOLOKWIUM 6 (z ćwiczeń 18-21)
ĆWICZENIE 23 (8.V – 12.V. 2017)
TEMAT: EGZAMIN PRAKTYCZNY
(samodzielne ustawienie gotowego preparatu w mikroskopie świetlnym, ocena preparatu przez studenta,
omówienie wyniku badania mikrobiologicznego wylosowanego przez studenta)
UWAGA:
Materiały teoretyczne do ćwiczeń znajdują się na stronie internetowej: www.umed.wroc.pl/mikrobiologia
Wrocław, 2016-06-29
dr n med. Katarzyna Jermakow, adiunkt dydaktyczny,
prof. dr hab. Grażyna Gościniak, kierownik Katedry Mikrobiologii,
- 11 -