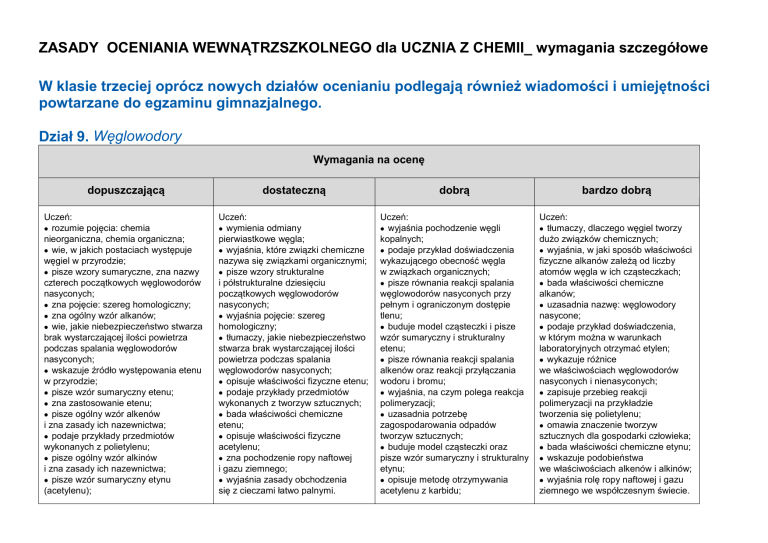
ZASADY OCENIANIA WEWNĄTRZSZKOLNEGO dla UCZNIA Z CHEMII_ wymagania szczegółowe
W klasie trzeciej oprócz nowych działów ocenianiu podlegają również wiadomości i umiejętności
powtarzane do egzaminu gimnazjalnego.
Dział 9. Węglowodory
Wymagania na ocenę
dopuszczającą
Uczeń:
rozumie pojęcia: chemia
nieorganiczna, chemia organiczna;
wie, w jakich postaciach występuje
węgiel w przyrodzie;
pisze wzory sumaryczne, zna nazwy
czterech początkowych węglowodorów
nasyconych;
zna pojęcie: szereg homologiczny;
zna ogólny wzór alkanów;
wie, jakie niebezpieczeństwo stwarza
brak wystarczającej ilości powietrza
podczas spalania węglowodorów
nasyconych;
wskazuje źródło występowania etenu
w przyrodzie;
pisze wzór sumaryczny etenu;
zna zastosowanie etenu;
pisze ogólny wzór alkenów
i zna zasady ich nazewnictwa;
podaje przykłady przedmiotów
wykonanych z polietylenu;
pisze ogólny wzór alkinów
i zna zasady ich nazewnictwa;
pisze wzór sumaryczny etynu
(acetylenu);
dostateczną
dobrą
bardzo dobrą
Uczeń:
wymienia odmiany
pierwiastkowe węgla;
wyjaśnia, które związki chemiczne
nazywa się związkami organicznymi;
pisze wzory strukturalne
i półstrukturalne dziesięciu
początkowych węglowodorów
nasyconych;
wyjaśnia pojęcie: szereg
homologiczny;
tłumaczy, jakie niebezpieczeństwo
stwarza brak wystarczającej ilości
powietrza podczas spalania
węglowodorów nasyconych;
opisuje właściwości fizyczne etenu;
podaje przykłady przedmiotów
wykonanych z tworzyw sztucznych;
bada właściwości chemiczne
etenu;
opisuje właściwości fizyczne
acetylenu;
zna pochodzenie ropy naftowej
i gazu ziemnego;
wyjaśnia zasady obchodzenia
się z cieczami łatwo palnymi.
Uczeń:
wyjaśnia pochodzenie węgli
kopalnych;
podaje przykład doświadczenia
wykazującego obecność węgla
w związkach organicznych;
pisze równania reakcji spalania
węglowodorów nasyconych przy
pełnym i ograniczonym dostępie
tlenu;
buduje model cząsteczki i pisze
wzór sumaryczny i strukturalny
etenu;
pisze równania reakcji spalania
alkenów oraz reakcji przyłączania
wodoru i bromu;
wyjaśnia, na czym polega reakcja
polimeryzacji;
uzasadnia potrzebę
zagospodarowania odpadów
tworzyw sztucznych;
buduje model cząsteczki oraz
pisze wzór sumaryczny i strukturalny
etynu;
opisuje metodę otrzymywania
acetylenu z karbidu;
Uczeń:
tłumaczy, dlaczego węgiel tworzy
dużo związków chemicznych;
wyjaśnia, w jaki sposób właściwości
fizyczne alkanów zależą od liczby
atomów węgla w ich cząsteczkach;
bada właściwości chemiczne
alkanów;
uzasadnia nazwę: węglowodory
nasycone;
podaje przykład doświadczenia,
w którym można w warunkach
laboratoryjnych otrzymać etylen;
wykazuje różnice
we właściwościach węglowodorów
nasyconych i nienasyconych;
zapisuje przebieg reakcji
polimeryzacji na przykładzie
tworzenia się polietylenu;
omawia znaczenie tworzyw
sztucznych dla gospodarki człowieka;
bada właściwości chemiczne etynu;
wskazuje podobieństwa
we właściwościach alkenów i alkinów;
wyjaśnia rolę ropy naftowej i gazu
ziemnego we współczesnym świecie.
zna zastosowanie acetylenu;
wskazuje źródła występowania
węglowodorów w przyrodzie.
pisze równania reakcji spalania
alkinów oraz reakcji przyłączania
wodoru i bromu;
zna właściwości gazu
ziemnego i ropy naftowej.
Przykłady wymagań nadobowiązkowych
Uczeń:
wie, co to oznacza, że atom węgla jest tetraedryczny;
rozumie i wyjaśnia pojęcie izomerii;
zna wzory sumaryczne i nazwy alkanów o liczbie atomów węgla 11–15;
•
•
•
wie, co to są cykloalkany i węglowodory aromatyczne;
zna inne polimery, np. poli(chlorek winylu) i polipropylen;
stosuje zdobyte wiadomości w sytuacjach problemowych.
Dział 10. Pochodne węglowodorów
Wymagania na ocenę
dopuszczającą
dostateczną
dobrą
bardzo dobrą
Uczeń:
definiuje alkohol i podaje ogólny
wzór alkoholi jednowodorotlenowych;
wymienia właściwości alkoholu
metylowego i alkoholu etylowego;
zapisuje wzór grupy karboksylowej;
wymienia właściwości kwasów
tłuszczowych;
wie, że sole kwasów tłuszczowych
to mydła;
definiuje ester jako produkt reakcji
kwasu z alkoholem;
zna wzór grupy aminowej;
wie, co to są aminy i aminokwasy.
Uczeń:
pisze wzory sumaryczne
i strukturalne alkoholi o krótkich
łańcuchach;
wyjaśnia pojęcia: grupa
karboksylowa i kwas karboksylowy;
pisze wzory, omawia właściwości
kwasu octowego i kwasu
mrówkowego;
podaje przykłady nasyconych
i nienasyconych kwasów
tłuszczowych oraz pisze ich wzory;
prawidłowo nazywa sole kwasów
karboksylowych;
wie, co to jest twardość wody;
wie, jaką grupę funkcyjną mają
estry;
zna budowę cząsteczki aminy
(na przykładzie metyloaminy);
opisuje budowę cząsteczki
aminokwasu.
Uczeń:
wyjaśnia pojęcie: grupa funkcyjna;
omawia właściwości alkoholu
metylowego i alkoholu etylowego;
pisze równania reakcji spalania
alkoholi;
omawia trujące działanie alkoholu
metylowego i szkodliwe działanie
alkoholu etylowego na organizm
człowieka;
omawia właściwości kwasu
octowego i kwasu mrówkowego;
pisze równania reakcji spalania
i równania dysocjacji elektrolitycznej
(jonowej) kwasów:
mrówkowego i octowego;
pisze równania reakcji spalania
kwasów tłuszczowych;
wyjaśnia, czym różnią
się tłuszczowe kwasy nasycone
od nienasyconych;
pisze równania reakcji kwasu
oleinowego z wodorem i z bromem;
pisze równanie reakcji
otrzymywania stearynianu sodu;
omawia zastosowanie soli kwasów
karboksylowych;
wskazuje występowanie estrów;
pisze wzory, równania reakcji
otrzymywania i stosuje poprawne
nazewnictwo estrów;
omawia właściwości fizyczne
estrów;
wymienia przykłady zastosowania
wybranych estrów;
zna i opisuje właściwości
metylo­aminy;
opisuje właściwości glicyny.
Uczeń:
wyjaśnia proces fermentacji
alkoholowej;
podaje przykłady alkoholi
wielowodorotlenowych – glicerolu
(gliceryny, propanotriolu) oraz glikolu
etylenowego (etanodiolu);
pisze wzory sumaryczne
i strukturalne alkoholi
wielowodorotlenowych;
omawia właściwości fizyczne
alkoholi wielowodorotlenowych
i podaje przykłady ich zastosowania;
bada właściwości
rozcieńczonego roztworu kwasu
octowego;
pisze w formie cząsteczkowej
równania reakcji kwasów
karboksylowych
(mrówkowego i octowego)
z metalami, tlenkami metali
i z zasadami;
wyprowadza ogólny wzór kwasów
karboksylowych;
bada właściwości kwasów
tłuszczowych;
omawia warunki reakcji kwasów
tłuszczowych z wodorotlenkami
i pisze równania tych reakcji;
omawia przyczyny i skutki twardości
wody;
opisuje doświadczenie
otrzymywania estrów w warunkach
pracowni szkolnej;
pisze równania reakcji hydrolizy
estrów;
doświadczalnie bada właściwości
glicyny;
wyjaśnia, w jaki sposób obecność
grup funkcyjnych wpływa
na właściwości związków;
wyjaśnia, na czym polega wiązanie
peptydowe.
Przykłady wymagań nadobowiązkowych
Uczeń:
zna wzory i nazwy wybranych fluorowcopochodnych;
zna izomery alkoholi;
zna wzory innych kwasów, np. wzór kwasu szczawiowego;
pisze wzory i równania reakcji otrzymywania dowolnych estrów (w tym wosków i tłuszczów);
podaje przykłady peptydów występujących w przyrodzie;
stosuje zdobyte wiadomości w sytuacjach problemowych.
Dział 11. Substancje o znaczeniu biologicznym
Wymagania na ocenę
dopuszczającą
Uczeń:
definiuje tłuszcze;
podaje przykłady występowania
tłuszczów w przyrodzie;
wie, że aminokwasy
są podstawowymi jednostkami
budulcowymi białek;
podaje skład pierwiastkowy białek;
wie, że białko można wykryć za
pomocą reakcji charakterystycznych
(rozpoznawczych);
zna wzór glukozy;
wyjaśnia, z jakich surowców
roślinnych otrzymuje się sacharozę;
zna wzór sumaryczny skrobi;
zna wzór celulozy;
wymienia właściwości celulozy;
wymienia rośliny będące źródłem
pozyskiwania włókien celulozowych;
wskazuje zastosowania włókien
celulozowych;
omawia pochodzenie włókien
białkowych i ich zastosowanie.
dostateczną
dobrą
bardzo dobrą
Uczeń:
omawia pochodzenie tłuszczów i ich
właściwości fizyczne;
odróżnia tłuszcze roślinne
od zwierzęcych oraz stałe od ciekłych;
wie, jak odróżnić tłuszcz od oleju
mineralnego;
omawia rolę białek w budowaniu
organizmów;
omawia właściwości fizyczne białek;
omawia reakcję ksantoproteinową
i biuretową jako reakcje
charakterystyczne dla białek;
pisze równanie reakcji
otrzymywania glukozy w procesie
fotosyntezy;
wyjaśnia pojęcia: cukier
i węglowodany;
pisze wzór sumaryczny sacharozy;
omawia występowanie i rolę skrobi
w organizmach roślinnych;
pisze wzór sumaryczny skrobi
i celulozy;
omawia rolę celulozy
w organizmach roślinnych;
wyjaśnia budowę cząsteczki
celulozy;
omawia wady i zalety włókien
celulozowych;
omawia wady i zalety włókien
białkowych.
Uczeń:
pisze wzór cząsteczki tłuszczu
i omawia jego budowę;
wyjaśnia, na czym polega próba
akroleinowa;
tłumaczy pojęcie: reakcja
charakterystyczna (rozpoznawcza);
wyjaśnia rolę tłuszczów w żywieniu;
wyjaśnia rolę aminokwasów
w budowaniu białka;
wyjaśnia pojęcia: koagulacja
i denaturacja białka;
bada właściwości glukozy;
pisze równanie reakcji spalania
glukozy i omawia znaczenie
tego procesu w życiu organizmów;
bada właściwości sacharozy;
pisze równanie hydrolizy sacharozy
i omawia znaczenie tej reakcji
dla organizmów;
omawia rolę błonnika w odżywianiu;
wymienia zastosowania celulozy;
tłumaczy wady i zalety włókien
na podstawie ich składu
chemicznego.
Uczeń:
wykazuje doświadczalnie
nienasy­cony charakter oleju
roślinnego;
tłumaczy proces utwardzania
tłuszczów;
doświadczalnie sprawdza skład
pierwiastkowy białek;
wyjaśnia przemiany, jakim ulega
spożyte białko w organizmach;
bada działanie temperatury
i różnych substancji na białka;
wykrywa białko w produktach
spożywczych, stosując reakcje
charak­terystyczne (ksantoproteinową
i biuretową);
wykrywa glukozę w owocach
i warzywach, stosując reakcję
charakterystyczną (rozpoznawczą) –
próbę Trommera;
bada właściwości skrobi;
przeprowadza reakcję
charakterystyczną (rozpoznawczą)
skrobi i wykrywa skrobię
w produktach spożywczych;
proponuje doświadczenie
pozwa­lające zbadać właściwości
celu­lozy;
porównuje właściwości skrobi
i celulozy;
identyfikuje włókna celulozowe;
identyfikuje włókna białkowe;
wyjaśnia potrzebę
oszczędnego gospodarowania
papierem.
Przykłady wymagań nadobowiązkowych
Uczeń:
zna inne reakcje charakterystyczne dla glukozy, np. próbę Tollensa;
potrafi wyjaśnić, co to jest struktura pierwszorzędowa, drugorzędowa (trzeciorzędowa) białek;
zna przykłady włókien sztucznych, wie, jaką mają budowę;
wie, jakie dodatki i w jakim celu są stosowane do żywności;
wymienia sposoby konserwowania żywności i podaje przykłady środków konserwujących żywność;
analizuje etykiety artykułów spożywczych i wskazuje zawarte w nich barwniki, przeciwutleniacze, środki zapachowe, zagęszczające, konserwujące;
podaje podstawowe skutki użycia substancji uzależniających;
podaje kilka przykładów substancji uzależniających, wskazując ich miejsce występowania.
Cele edukacyjne z chemii:
pogłębianie wiedzy o procesach w otaczającym nas świecie,
zrozumienie znaczenia chemii w rozwoju cywilizacji,
rozbudzenie zainteresowania chemią poprzez interpretację jej osiągnięć,
rozwijanie zainteresowań poznawczych i postaw twórczych,
umiejętne planowanie i wykonywanie eksperymentów,
interpretacja wyników doświadczeń,
wykształcenie umiejętności samokształcenia poprzez zdobywanie informacji
z różnych źródeł,
bezpieczne posługiwanie się substancjami w laboratorium i w życiu codziennym,
Cele kształcenia:
kształcenie umiejętności myślenia prowadzącego do rozumienia przez ucznia poznawanej wiedzy, jak i nabycia umiejętności posługiwania się nią,
ukazanie użyteczności wiedzy chemicznej w życiu codziennym, jej powiązania z innymi naukami oraz kształtowanie podstaw w zakresie ochrony
środowiska w tym również własnego zdrowia i bezpieczeństwa.
Stosowane formy kontroli i oceny ucznia na lekcjach chemii:
- odpowiedź ustna
- kartkówka
- sprawdzian
- test
- aktywność (wypowiedzi ustne, udział w doświadczeniach, itp.)
- zadanie domowe
- praca dodatkowa.
W przypadku sprawdzianów przyjmuje się następującą skalę punktową:
Powyżej 90% - ocena bardzo dobra
Powyżej 75% - ocena dobra
Powyżej 50 % - ocena dostateczna
Powyżej 30% - ocena dopuszczająca
Do 30% - ocena niedostateczna
W przypadku kartkówek przyjmuje się następującą skalę punktową:
100% - 95% - ocena bardzo dobra
94% - 80% - ocena dobra
79% - 60% - ocena dostateczna
59% - 50% - ocena dopuszczająca
49% - 0% - ocena niedostateczna
Ocenę celującą uczeń uzyskuje w przypadku, gdy osiągnie 100% punktów i rozwiąże zadanie dodatkowe.
Ocena semestralna i na koniec roku szkolnego wystawiana jest na podstawie ocen cząstkowych uzyskanych w danym semestrze, przy czym największą wagę
mają oceny ze sprawdzianów i testów, następnie z kartkówek i odpowiedzi ustnych. Pozostałe formy oceniania spełniają funkcję wspomagającą. Przy
wystawianiu oceny końcowej wpływ ma praca ucznia przez cały rok szkolny. Ocenę klasyfikacyjną roczną można podwyższyć w wyniku egzaminu
sprawdzającego.
Oceny są jawne dla ucznia i rodziców.
Sprawdziany i testy obejmujące partie materiału obszerniejsze niż trzy ostatnie lekcje zapowiadane są z tygodniowym wyprzedzeniem. Uczeń zostaje
poinformowany o zakresie obowiązujących go wiadomości oraz umiejętności podlegających sprawdzeniu.
Uczeń nieobecny na sprawdzianie lub teście musi napisać go: w terminie ustalonym z nauczycielem do dwóch tygodni (w przypadku usprawiedliwionej
nieobecności), na lekcji na której uczeń jest obecny (w wypadku nieusprawiedliwionej nieobecności). Jeśli uczeń nie napisze pracy otrzymuje ocenę
niedostateczną.
Poprawione sprawdziany, testy przez nauczyciela (w terminie dwóch tygodni), uczniowie dostają do wglądu.
Każda ocena niedostateczna ze sprawdzianu lub testu musi zostać poprawiona przez ucznia, w terminie uzgodnionym z nauczycielem. W e-dzienniku
poprawiona ocena jest zapisywana obok poprzedniej z tą samą wagą.
Oceny z prac pisemnych poprawiamy na zajęciach dodatkowych w terminie dwóch tygodni od czasu jej otrzymania.
Ucznia obowiązuje bieżące przygotowywanie się z trzech ostatnich lekcji, które może być sprawdzane w formie odpowiedzi ustnej bądź niezapowiedzianej
kartkówki.
Wiadomości podstawowe i kluczowe mogą być sprawdzone w każdym momencie.
Uczniowie, którzy rozpoczęli pierwszą klasę nie otrzymują ocen niedostatecznych w okresie dwóch pierwszych tygodni roku szkolnego.
Na dzień przed egzaminem i dwa dni po nim nie robi się sprawdzianów i nie odpytuje się.
W pierwszym dniu po przerwie świątecznej, feriach oraz wycieczkach nie odpytuje się uczniów.
Uczeń bez uzasadnienia może zgłosić swoje nieprzygotowanie na początku lekcji raz w semestrze przy jednej godzinie tygodniowo lub dwa razy w semestrze
przy dwóch godzinach tygodniowo. Zostaje to odnotowane w e-dzienniku i nie ma wpływu na ocenę semestralną i roczną.
W ciągu miesiąca uczeń zostaje oceniony co najmniej raz.
Przy wystawianiu ocen klasyfikacyjnych bierze się pod uwagę osiągnięcia w konkursach chemicznych.
Uczeń za pracę na lekcji może otrzymać „+” (za aktywną pracę) lub „-” (za brak aktywności podczas wykonywanych zadań na zajęciach). Za uzyskanie trzech
plusów uczeń otrzymuje ocenę bardzo dobrą, za uzyskanie trzech minusów uczeń uzyskuje ocenę niedostateczną.
Jeżeli uczeń w sposób celowy źle obchodzi się z odczynnikami na lekcji otrzymuje ocenę niedostateczną z pracy na lekcji (nie stosowanie się do przepisów i
zasad bhp)
Uczeń ma obowiązek na bieżąco odrabiać zadania domowe. Za brak zadania domowego uczeń otrzymuje ocenę niedostateczną.
Prace dodatkowe są nieobowiązkowe. Uczeń ma prawo nie zgodzić się na wpisanie do dziennika oceny uzyskanej z tej pracy.
Wagi ocen wliczanych do średnich:
Waga 3 – sprawdziany, testy
Waga 2 – kartkówki, odpowiedzi ustne
Waga 1 – zadania domowe, aktywność, dodatkowe zadania.
Kryteria oceniania:
Ocenę celującą otrzymuje uczeń, który:
- posiada wiadomości i umiejętności znacznie wykraczające poza program nauczania,
- formułuje problemy oraz dokonuje analizy i syntezy nowych zjawisk,
- proponuje rozwiązana nietypowe,
-
osiąga sukcesy w konkursach i olimpiadach chemicznych szczebla wyższego niż szkolny;
Ocenę bardzo dobrą otrzymuje uczeń, który:
- opanował w pełnym zakresie wiadomości i umiejętności określone programem,
- stosuje zdobytą wiedzę do rozwiązywania problemów i zadań w nowych sytuacjach,
- wykazuje dużą samodzielność i bez pomocy nauczyciela korzysta z różnych źródeł wiedzy,
- planuje i bezpiecznie przeprowadza eksperymenty chemiczne,
-
biegle pisze i uzgadnia równania reakcji chemicznych oraz samodzielnie rozwiązuje zadania o dużym stopniu trudności;
Ocenę dobrą otrzymuje uczeń, który:
- opanował w dużym zakresie wiadomości i umiejętności określone programem,
- poprawnie stosuje wiadomości i umiejętności do samodzielnego rozwiązywania typowych zadań i problemów,
- bezpiecznie wykonuje doświadczenia chemiczne,
- pisze i uzgadnia równania reakcji chemicznych,
- samodzielnie rozwiązuje zadania o średnim stopniu trudności,
-
korzysta z układu okresowego pierwiastków, wykresów, tablic i innych źródeł wiedzy chemicznej;
Ocenę dostateczną otrzymuje uczeń, który:
- opanował w podstawowym zakresie wiadomości i umiejętności,
- korzysta z pomocą nauczyciela ze źródeł wiedzy,
- z pomocą nauczyciela poprawnie stosuje wiadomości i umiejętności przy rozwiązywaniu typowych zadań i problemów,
-
z pomocą nauczyciela pisze i uzgadnia równania reakcji chemicznych oraz rozwiązuje zadania o niewielkim stopniu trudności;
Ocenę dopuszczającą otrzymuje uczeń, który:
- ma braki w opanowaniu wiadomości i umiejętności określonych programem, ale braki te nie przekreślają możliwości dalszego kształcenia,
-
z pomocą nauczyciela rozwiązuje typowe zadania teoretyczne i praktyczne o niewielkim stopniu trudności,
-
z pomocą nauczyciela pisze proste wzory chemiczne i równania reakcji chemicznych;
Ocenę niedostateczną otrzymuje uczeń, który:
- nie opanował wiadomości i umiejętności określonych programem, które są konieczne do dalszego kształcenia,
- nie zna symboliki chemicznej,
- nawet z pomocą nauczyciela nie pisze prostych wzorów chemicznych i równań chemicznych,
- nie potrafi bezpiecznie posługiwać się prosty sprzętem laboratoryjnym i odczynnikami chemicznymi
- nie skorzystał z ustalonych dla niego form pomocy w celu uzupełnienia braków.