.............................................................
Pieczątka jednostki zlecającej
.............................................................
Lekarz zlecający badanie:
.............................................................
Data wystawienia skierowania
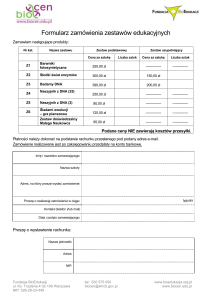
Skierowanie na badanie molekularne do Laboratorium Hematologii
Uniwersyteckie Centrum Kliniczne
80-952 Gdańsk, ul. Dębinki 7
Nazwisko i imię pacjenta:
Nr badania:
MPK:
(wypełnia laboratorium)
PESEL:
Podejrzenie/rozpoznanie i etap leczenia:
Materiał:
Przyjmowane leki:
DIAGNOSTYKA MOLEKULARNA MIKROBIOLOGICZNA I GENETYCZNA
Wirusologia
CMV DNA, ilościowo
Polyoma BK/JC DNA, ilościowo
– krew (EDTA), PMR
EBV DNA, ilościowo
mPolyoma BK/JC DNA, ilościowo
- krew (EDTA), PMR
- mocz
HSV-1/2 DNA, ilościowo/jakość
HBV DNA, ilościowo
- krew (EDTA), PMR
Grypa A(A/H1N1),B RNA, jakościowo
- wymaz (podłoże transportowe)
- krew (EDTA)
VZV DNA, ilościowo
Enterowirus RNA, jakościowo
- PMR, inne
HCV RNA, jakościowo
- krew (EDTA), PMR, wymaz
Parvowirus B19 DNA, ilościowo
- krew (EDTA), inne
- krew (EDTA)
Inne:
- krew (EDTA)
Mikrobiologia
Chlamydophila pneumoniae DNA
Gruźlica DNA + oporność
na Rifampicynę (półilościowo)
- plwocina, BAL, inne
- plwocina, BAL, inne
Mycoplasma pneumoniae DNA
Clostridium difficile DNA –
toksyna B, binarna, nap027 - kał
- plwocina, BAL, inne
Pneumocystis jiroveci DNA
Panel Ch. trachomatis/ N. gonnorh.
Chlamydia trachomatis DNA
- wymaz (podł. transportowe), mocz
Neisseria gonnorhoeae DNA
– wymaz (podł. transport.), mocz
Inne:
- wymaz (podł. transportowe), mocz
- plwocina, BAL, wymaz, inne
Genetyka
Mutacja Leiden – krew (EDTA)
Mutacje C677T, A1298C
w genie MTHFR – krew (EDTA)
Mutacja G20210A w genie
Mutacja C677T w genie MTHFR
– krew (EDTA)
protrombiny – krew (EDTA)
w genie HFE – krew (EDTA)
Warianty E2, E3, E4 w genie ApoE
– krew (EDTA)
Pobieranie krwi i przyjmowanie materiału:
Gdańsk, ul. Dębinki 7, budynek 8:
pon. – pt.: 6.15 – 14.00
sob.: 8.00 – 13.00
Mutacje H63D, S65C, C282Y
Kontakt:
Gdańsk ul. Kliniczna 1a:
pon. – pt.: 7.30 – 14.00
Gdańsk, Al. Zwycięstwa 30
pon. - pt.: 7.30 - 14.00
tel. 58 349 25 96
e-mail: [email protected]
DIAGNOSTYKA MOLEKULARNA CHORÓB MIELOPROLIFERACYJNYCH
Fuzja BCR-ABL jakościowo
metodą RT-PCR
p210
p190
Mutacja JAK2 V617F
metodą ARMS PCR
p230
Fuzja BCR-ABL ilościowo
metodą Real-Time PCR (p210)
Mutacja MPL exon 10
Mutacja CALR exon 9
Materiał:
metodą sekwencjonowania DNA
Transport materiału:
metodą sekwencjonowania DNA
Kontakt:
BCR-ABL – krew (10 ml), szpik (2 ml)
JAK2, CALR, MPL – krew (po 2 ml)
do 24h w temp. +4oC Nie wolno zamrażać!
Czas transportu próbki - mniej niż 24 godziny
tel. 58 349 22 16
e-mail: [email protected]
Pobieranie krwi:
Przyjmowanie materiału z jednostek zewnętrznych:
Gdańsk, ul. Dębinki 7, budynek 8:
pon. – czw.: 6.15 – 10.00
Klinika Hematologii i Transplantologii, Pracownia Diagnostyki Molekularnej, bud. 26, parter:
pon. - czw.: do godz. 11.00 (w piątki materiał nie jest przyjmowany!)
Osoba pobierająca materiał:
Data i godzina pobrania:
v. 3
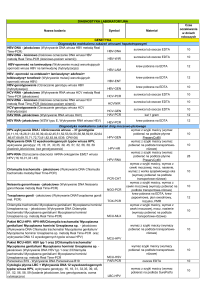
Wskazówki dotyczące pobierania i przesyłania materiału do badań molekularnych
wykonywanych w Laboratorium Hematologii UCK w Gdańsku
Badanie:
CMV DNA,
EBV DNA,
HSV-1/2 DNA,
VZV DNA,
HBV DNA,
Polyoma BK DNA,
Parvovirus B19 DNA
Rodzaj, sposób pobierania i objętość
krew (EDTA) – 3 ml
PMR (sucha, jałowa probówka) – min. 0,5 ml (dotyczy tylko CMV,
EBV, HSV, VZV)
Stabilność i przechowywanie:
krew, PMR, wymaz - do 24 h w temp. +40C ;
>24h
- w temp. -200C
krew >24h
- oddzielić osocze od krwinek
i przechowywać w temp. -200C
do 6 h
>24h
- w temp. +40C ,
- oddzielić osocze od krwinek
i przechowywać w temp. -200C
mPolyoma BK/JC mocz poranny pierwszy strumień – 10 - 50 ml,
do 24h
>24h
w temp. +40C,
w temp. -200C
Enterowirus RNA PMR (sucha, jałowa probówka) - min. 0,5 ml
do 72 h
>72h
w temp. +40C ,
w temp. -200C
do 72 h
w temp. +40C
Ch. pneumoniae DNA plwocina - min. 0,5 ml (przed pobraniem plwociny należy
do 24h
M. pneumoniae DNA dwukrotnie przepłukać usta wodą),
>24h
P. jiroveci DNA BAL - min. 10 ml,
wymaz - sucha, syntetyczna wymazówka (dotyczy tylko P. jiroveci)
w temp. +40C,
w temp. -200C
UWAGA: w przypadku zlecenia trzech i więcej badań u jednego
pacjenta konieczna jest dodatkowa probówka i/lub zwiększenie
objętości PMR
wymaz – sucha, syntetyczna wymazówka (dotyczy tylko HSV)
HCV RNA krew (EDTA) – 3 ml
UWAGA: w przypadku zlecenia badania HCV RNA z jednym lub
kilkoma badaniami z listy badań powyżej konieczna jest dodatkowa
probówka
Grypa A(A/H1N1),B RNA wymaz z nosogardzieli (podłoże transportowe i wymazówka wraz
z instrukcją pobrania materiału do odbioru w laboratorium)
Gruźlica DNA plwocina - min. 1 ml,
BAL - min. 10 ml,
PMR (sucha, jałowa probówka) - min 1 ml,
krew pełna/EDTA – min. 3 ml,
mocz – min. 10 ml
Plwocina do 10 dni
BAL, PMR, krew pełna do 72 h
mocz do 24 h
dłuższe przechowywanie
Clostridium difficile DNA Kał nieuformowany (jałowy pojemnik)
do 24h
UWAGA – badanie PCR należy zlecić jednokrotnie w celu
>24h
potwierdzenia czy szczep C.difficile należy do toksynotwórczych
i hiperwirulentnych, wykonanie kolejnego badania PCR zasadne jest
dopiero po upływie 6 – 8 tyg.
w temp. +40C,
w temp. -200C
Ch. trachomatis/ wymaz (podłoże transportowe do CT/NG wraz z instrukcją pobrania wymaz: do 60 dni
N. gonnorhoeae DNA materiału do odbioru w laboratorium),
mocz: do 7 dni
mocz poranny pierwszy strumień - 10 - 50 ml (lub po okresie co
najmniej 3 godz. wstrzymywania się od oddawania moczu,
UWAGA – należy zebrać nie więcej niż 50 ml moczu - nie należy
rozcieńczać materiału!)
Mutacje: Krew (EDTA) - 3 ml
Leiden, Protrombina,
MTHFR, HFE, ApoE
do 7 dni
>7 dni
w temp. +40C ;
w temp. +40C ;
w temp. +40C
w temp. -200C
w temp. +40C;
w temp. +40C
w temp. +40C,
w temp. -200C
(nie oddzielać osocza, mrozić
krew pełną)
UWAGA – pacjent nie musi być na czczo w przypadku żadnego z powyższych badań !
v. 3