WODA
RA
TU
RA
PO
WI
ER
ZC
HNI
E
POWIETRZ
E
A
AP
PRAKTYCZNY PRZEWODNIK
MONITOROWANIA
ŚRODOWISKA
W SZPITALACH
Współpraca i recenzja:
Profesor GL French, MD FRCPath DipHIC
Honorowy Konsultant Mikrobiologii
Guy’s & Thomas’s Hospital
Profesor wizytujący
King’s College, London, UK
3
PRZEDMOWA
Środowisko szpitali i instytucji ochrony zdrowia postrzegane jest jako źródło
zakażeń szpitalnych od ponad wieku. Już w 1860 roku Florence Nightingale
pisała: „większą część opieki nad pacjentem stanowi utrzymywanie czystości
w szpitalu”. Mimo, że rygorystyczne przestrzeganie zasad higieny i dbałość
o czystość środowiska szpitalnego pozostają niezbędne w salach operacyjnych
i gabinetach zabiegowych, to standardy ogólnej higieny szpitalnej zostały
obniżone wraz z wprowadzeniem do lecznictwa antybiotyków, które dały
złudne poczucie bezpieczeństwa i wiarę w możliwość zwalczenia każdej
infekcji.
Tym niemniej, zakażenia zwiększają ryzyko zagrażające bezpieczeństwu pacjenta
- zwłaszcza wobec stale wzrastającej złożoności nowoczesnej medycyny,
rosnącej podatności pacjentów z racji skrajnych przedziałów wiekowych,
immunosupresji, rozległych zabiegów operacyjnych i długotrwałej intensywnej
opieki medycznej oraz pojawianie się patogenów wielolekoopornych (MDR).
Rozprzestrzenianie się genów oporności między szczepami, a także między
gatunkami bakterii, oraz powszechne występowanie na całym świecie
wysoce opornych szczepów MDR, jest obecnie największym zagrożeniem dla
zdrowia publicznego i testuje naszą zdolność zwalczania zakażeń szpitalnych
i umiejętność zapewnienia bezpieczeństwa i skuteczności opieki zdrowotnej
(Boucher et al, 2009; European Commission, 2011; World Economic Forum
Report, 2014). Zapobieganie zakażeniom krzyżowym między pacjentami
jest ważne nie tylko ze względu na zmniejszenie liczby zakażeń, lecz także
ogranicza rozprzestrzenianie się wieloopornych bakterii i genów oporności.
Wszystkie elementy środowiska szpitalnego: powietrze, woda, aparatura
medyczna i suche powierzchnie są potencjalnym siedliskiem drobnoustrojów
i źródłem zakażenia.
W niniejszym praktycznym przewodniku omówiono różne rodzaje środowiskowej
transmisji zakażeń szpitalnych oraz sposoby zapobiegania im i ich zwalczania,
a także przegląd rekomendowanych metod mikrobiologicznego badania
środowiska szpitalnego.
Profesor GL French, MD FRCPath DipHIC
1
2
SPIS TREŚCI
WPROWADZENIE ..........................................................................................................................................4
PRZENOSZENIE ZAKAŻEŃ PRZEZ POWIETRZE..........6
PRZENOSZENIE ZAKAŻEŃ PRZEZ WODĘ........................ 14
PRZENOSZENIE ZAKAŻEŃ PRZEZ .................................................... 17
APARATURĘ MEDYCZNĄ
PRZENOSZENIE ZAKAŻEŃ PRZEZ ....................................................20
SUCHE POWIERZCHNIE
ORGANIZACJA I ZARZĄDZANIE ...............................................................30
POBIERANIE PRÓBEK ŚRODOWISKOWYCH...................32
PIŚMIENNICTWO......................................................................................................................................38
3
WPROWADZENIE
Środowisko szpitalne może być zanieczyszczone rozmaitymi środowiskowymi
bakteriami oraz drobnoustrojami chorobotwórczymi, przeniesionymi przez
skolonizowanych lub zakażonych pacjentów lub na rękach personelu.
Zakażenie może rozwinąć się po bezpośrednim przeniesieniu drobnoustroju
np. do rany lub w inne miejsce na ciele pacjenta. Alternatywnie, etapem
poprzedzającym zakażenie jest kolonizacja skóry i błon śluzowych pacjenta;
do infekcji dochodzi w przypadku przełamania zdolności obronnych organizmu
przez drobnoustrój.
Drogi przenoszenia drobnoustrojów są złożone i często obejmują także
środowisko szpitalne, zarówno w sposób bezpośredni, jak i pośredni.
Środowiskowymi źródłami zakażenia mogą być:
Powietrze
Woda
Sprzęt i aparatura medyczna
Powierzchnie
Żywność i napoje
4
Rycina 1.
Potencjalne drogi transmisji zakażeń szpitalnych, obejmujące środowisko
[wg Otter et al., 2011]
Zanieczyszczone
powierzchnie
i sprzęt
Skolonizowany
lub zakażony
pacjent
Zanieczyszczone
ręce personelu
Pacjent
podatny na
zakażenie
Zanieczyszczone
powietrze
Bezpośredni
kontakt
między
pacjentami
5
PRZENOSZENIE
ZAKAŻEŃ
PRZEZ POWIETRZE
Drobnoustroje obecne w powietrzu dostają się do organizmu człowieka
bezpośrednio: są wdychane lub np. osiadają na powierzchni ran, lub za
pośrednictwem narzędzi i aparatury, na które biernie opadają i następnie
są przenoszone na pacjentów.
Niektóre patogeny powodujące kolonizację i zakażenia pacjentów są
z większym prawdopodobieństwem przenoszone wraz z powietrzem
z uwagi na odporność na wysychanie, przeżywanie w cząsteczkach kurzu
i kroplach wilgoci.
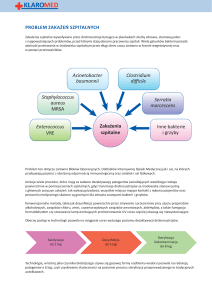
Drobnoustroje najczęściej przenoszone drogą powietrzną:
• Staphylococcus aureus
• Gronkowce koagulazo-ujemne (CoNS)
• Streptococcus pyogenes
• Acinetobacter spp.
• Mycobacterium tuberculosis (TB)
• Norowirus
• Wirus grypy
• Koronawirus zespołu niewydolności oddechowej Środkowego Wschodu
(MERS-CoV)
• Przetrwalniki Clostridium
• Legionella spp.
• Aspergillus spp.
Staphylococcus aureus
Szczepy meticylino-wrażliwe (MSSA) i meticylino-oporne (MRSA) są
najczęstszą przyczyną zakażeń ran operacyjnych, skóry i tkanek miękkich.
MSSA kolonizuje błonę śluzową nosa i skórę krocza oraz innych okolic ciała u około
30% zdrowych osób. Do środowiska dostaje się wraz z drobinami złuszczającego
się naskórka, jest przenoszony przez powietrze i doskonale przeżywa w cząstkach
kurzu i pyłu. Ruch powietrza wznosi te cząstki i może spowodować przeniesienie
komórek S. aureus na powierzchnię ran pacjentów i sprzęt medyczny.
MRSA jest przenoszony rzadziej, lecz rozprzestrzenia się z łatwością wśród
chorych. Przeważnie jest przenoszony z zakażonych lub skolonizowanych
pacjentów za pośrednictwem rąk personelu, lecz także drogą powietrzną
w skażonym środowisku.
6
Gronkowce koagulazo-ujemne (CoNS)
Są to drobnoustroje o niskiej wirulencji, kolonizujące skórę zdrowego
człowieka. Występują także w powietrzu i mogą dostawać się do ran i osiadać
na sprzęcie medycznym, powodując zakażenia związane z wszczepieniem
protez, głównie podczas operacji ortopedycznych i kardiochirurgicznych.
Streptococcus pyogenes
Drobnoustrój kolonizuje błonę śluzową gardła u około 5% zdrowych osób.
Powoduje zakażenia ran operacyjnych, skóry i tkanek miękkich podobnie jak
S. aureus.
ZAPOBIEGANIE I KONTROLA ZAKAŻEŃ
Zapobieganie zakażeniom polega na systematycznym stosowaniu
standardowych środków higieny i utrzymywania czystości (CDC, 2003; WHO,
2008), aby nie doszło do zanieczyszczenia powierzchni. Kontrola czystości
powietrza w pomieszczeniach wysokiego ryzyka, jak sale operacyjne,
wymaga przestrzegania czyszczenia pomieszczeń oraz częstej wymiany
i filtracji powietrza (patrz ramka poniżej). W chirurgii z wszczepieniem protez
dodatkowe zabezpieczenie ran i narzędzi przed CoNS stanowi ultra czyste
powietrze z nawiewu pionowego, tzw. stropu laminarnego nad polem
operacyjnym lub stosowanie kabin operacyjnych z nawiewem laminarnym.
KONTROLA PRZENOSZENIA ZAKAŻEŃ DROGĄ
POWIETRZNĄ W SALACH OPERACYJNYCH
I INNYCH POMIESZCZENIACH WYSOKIEGO RYZYKA
(Dharan & Pittet, 2002; Hoffman et al, 2002; CDC 2003)
Przenoszeniu drobnoustrojów drogą powietrzną zapobiega:
• Systematyczna wymiana powietrza, filtracja powietrza i redukcja
ruchów powietrza.
• Ograniczenie personelu do minimum podczas operacji.
• Właściwa relacja ciśnień utrzymywanych między pomieszczeniami w celu
zachowania przepływu powietrza od sal aseptycznych, jak sale operacyjne,
sale intensywnej opieki medycznej, gabinety zabiegowe (relatywnie wyższe
ciśnienie) w stronę pomieszczeń septycznych z podciśnieniem.
• Wymiana powietrza z częstotliwością zależną od przeznaczenia
pomieszczenia i związanego z nim standardu czystości: np. w salach
pacjentów wymianę powietrza zaleca się 6 razy na godzinę, w salach OIOM
- 10 razy na godzinę, w salach operacyjnych chirurgii jednego dnia - 15 razy
na godzinę i w salach operacyjnych ogólnych - 25 razy na godzinę.
• Stosowanie stropów laminarnych (ultra czysta wentylacja, UCV)
podczas operacji z wszczepieniem implantów.
7
Mimo, że nie ma jednolitych norm dotyczących pobierania próbek
powietrza oraz częstotliwości tych badań, liczne autorytety zalecają
monitorowanie czystości powietrza w przypadku:
• Sal operacyjnych oddanych do użytku;
• Sal w nowych lub remontowanych budynkach (Hoffman et al, 2002);
• Jako kontrola jakości sprzątania i czyszczenia
JAKOŚĆ POWIETRZA POLA OPERACYJNEGO
• Pusta sala operacyjna:
< 35 komórek drobnoustrojów (cfu)/m3, przy czym
< 1 komórka Clostridium perfringens i S. aureus / m3
• Podczas operacji, całkowita liczba: <180 cfu / m3
(uśrednione w czasie 5 minut)
(Konsensus z: Dharan & Pitted, 2002; Hoffman et al, 2002; CDC, 2003)
Acinetobacter spp.
(Peleg et al, 2008; Tacconelli et al, 2014)
Pałeczki Gram-ujemne są mniej odporne na wysychanie niż bakterie Gramdodatnie, i generalnie nie są przenoszone droga powietrzną. Wyjątkiem
jest Acinetobacter spp. – niefermentujące Gram-ujemne ziarniako-pałeczki
szeroko rozpowszechnione w środowisku, w wodzie i w glebie, kolonizujące
błony śluzowe u około 25% zdrowych osób.
Acinetobacter baumanii jest najczęściej izolowanym, a także najszybciej
nabywającym geny oporności gatunkiem. Jest odpowiedzialny za liczne
epidemie szpitalne, w ostatnich latach wywoływane coraz częściej przez
szczepy MDR. Powoduje ciężkie i trudne do wyleczenia zakażenia
u pacjentów w immunosupresji, zwłaszcza na oddziałach intensywnej terapii.
Pałeczki Acinetobacter spp. mogą przeżywać tygodniami i miesiącami
na suchych powierzchniach i są przenoszone z cząsteczkami kurzu,
na zanieczyszczonych narzędziach i aparaturze oraz wraz z aerozolem
wytwarzanym przez skażone nawilżacze powietrza.
Szczepy powodujące epidemie szpitalne mają źródło w zanieczyszczonym
środowisku szpitalnym lub zostają przeniesione poprzez ręce ze skóry
skolonizowanych pacjentów. Epidemię może wywołać pojedynczy szczep
epidemiczny, lub liczne różne izolaty tworzące kompleks o mieszanej,
epidemicznej i endemicznej epidemiologii.
Blisko 50% wszystkich izolatów A. baumanii pochodzi z dróg oddechowych
pacjentów; coraz częściej są to szczepy oporne na karbapenemy (Munoz-Price
et al, 2013).
8
PRZENOSZENIE ZAKAŻEŃ PRZEZ POWIETRZE
ZAPOBIEGANIE I KONTROLA ZAKAŻEŃ
Kontrola środowiskowa polega na:
• Rygorystycznym przestrzeganiu procedur mycia i dezynfekcji rąk
• Skutecznym czyszczeniu pomieszczeń
• Izolacji skolonizowanych i zakażonych pacjentów.
Skrajnie oporne szczepy Acinetobacters spp. wywołują zakażenia bardzo
trudne lub wręcz niemożliwe do wyleczenia. Obecność w szpitalu tego
rodzaju patogenów MDR wymaga zastosowania podwyższonych środków
kontroli w celu ograniczenia rozprzestrzeniania się szczepów w oddziałach
szpitalnych wysokiego ryzyka. Oznacza to wysoki reżim sanitarny i ścisłe
przestrzeganie procedur, częstsze i dokładniejsze czyszczenie pomieszczeń,
szybkie wykrywanie skolonizowanych nosicieli poprzez badania przesiewowe
oraz izolację skolonizowanych i zakażonych chorych w salach z podciśnieniem
i filtrowaniem powietrza.
Trudno jest zapobiegać zakażeniom endemicznym, za które często odpowiada
intensywnie skażone środowisko szpitala. Identyfikacji i eliminowaniu źródeł
i dróg przenoszenia szpitalnych szczepów bakterii służy typowanie genetyczne
izolatów pochodzących od chorych i ze środowiska. Regularne czyszczenie
pomieszczeń zapobiega wystąpieniu zakażeń epidemicznych, natomiast
czasowe zamykanie „skażonych” sal podczas czyszczenia może pomóc
w ograniczeniu zakażeń endemicznych (Tacconelli et al, 2014).
Prątki gruźlicy
Najczęstszą postacią gruźlicy (TB) jest gruźlica płuc. Pacjenci, którzy
wydalają prątki M. tuberculosis wraz z plwociną, mają tzw. gruźlicę
czynną i są zakaźni dla otoczenia. Chorzy z gruźlicą płuc są często
hospitalizowani i stanowią wówczas źródło zakażenia drogą powietrznokropelkową dla innych chorych, personelu i odwiedzających. Szczególnie
podatni na zakażenie są pacjenci w immunosupresji, łącznie z chorymi
z HIV/AIDS. Liczne pozycje piśmiennictwa dotyczą epidemii szpitalnych
oraz wskazują na niebezpieczeństwo związane z zakażeniami wieloopornymi prątkami gruźlicy (MDR-TB) w instytucjach opieki zdrowotnej.
ZAPOBIEGANIE I KONTROLA ZAKAŻEŃ
(Hannan et al, 2000; CDC, 2005; NICE, 2011)
• Identyfikacja zakażonych pacjentów: jest podstawą profilaktyki, ponieważ
chodzący niezdiagnozowani pacjenci z czynną gruźlicą mogą przyczynić się
do rozprzestrzenienia prątków gruźlicy po całej placówce.
• Izolacja zakażonych pacjentów do czasu, gdy staną się niezakaźni, łącznie
ze stosowaniem specjalnych masek, ograniczających wydzielanie prątków
do otoczenia.
• Ocena ryzyka wystąpienia oporności na antybiotyki i zakażenia HIV
w przypadku wszystkich chorych z TB. Wobec pacjentów ze zdiagnozowaną
lub podejrzewaną MDR-TB należy stosować specjalny reżim sanitarny
(patrz str. 10).
9
• Izolacja pacjentów, z podejrzeniem czynnej gruźlicy płuc, szczególnie
odizolowanie ich od chorych w immunosupresji. Powinni oni przebywać
w izolatkach z podciśnieniem lub wentylacją z ujściem na zewnątrz
budynku. Zabiegi związane z generowaniem aerozolu, jak bronchoskopia,
pobieranie indukowanej plwociny lub nebulizacja, powinny być wykonywane
w odpowiednio wentylowanym pomieszczeniu.
• Stosowanie masek (z filtrami cząsteczkowymi), odzieży ochronnej i osłon
twarzy zaleca się personelowi opiekującemu się chorymi ze zdiagnozowaną
lub podejrzewaną TB, oraz podczas wykonywania procedur generujących
aerozole, podczas których ryzyko zakażenia TB jest wysokie.
• Chorzy hospitalizowani z czynną gruźlicą płuc powinni zakładać maseczki
chirurgiczne podczas opuszczania swoich sal, do czasu upływu dwóch
tygodni od rozpoczęcia leczenia.
GRUŹLICA WIELOLEKOOPORNA
MDR-TB jest poważnym, często nie poddającym się leczeniu lekami
przeciwprątkowymi zakażeniem, które wymaga stosowania specjalnych
środków zapobiegających jego rozprzestrzenieniu.
• Pomieszczenia z podciśnieniem i stale monitorowanym przepływem
powietrza, dla pacjentów ze zdiagnozowaną lub podejrzewaną MDR-TB,
do czasu, gdy przestaną prątkować.
• Maski FFP3 dla personelu i odwiedzających, przez cały czas prątkowania
pacjenta. Maski powinny odpowiadać wymogom określonym przez
Health and Safety Executive (Inspektorat Zdrowia i Bezpieczeństwa
Pracy Wielkiej Brytanii) (2013). Personel opiekujący się takimi chorymi
powinien być przeszkolony w używaniu masek FFP3.
Zespół niewydolności oddechowej
Środkowego Wschodu (MERS) i inne
zakażenia wirusowe dróg oddechowych
W kwietniu 2012 roku opisano na Środkowym Wschodzie pierwsze przypadki
ostrego, często kończącego się śmiercią zakażenia dróg oddechowych,
wywołanego nowym koronawirusem (Co-V). Rezerwuarem wirusa są
nietoperze, lecz w przenoszeniu zakażenia na człowieka mogą uczestniczyć
wielbłądy. Dotychczas wiedza na temat epidemiologii MERS jest ograniczona.
Mimo różnic, wirus jest podobny do koronawirusa odpowiedzialnego za
światową epidemię zespołu ostrej niewydolności oddechowej (SARS)
w latach 2002-3. Doświadczenia nabyte podczas epidemii SARS przydały
się, gdy pojawiły się epidemiczne zakażenia MERS. Zabezpieczenie przed
zakażeniem polega głównie na ochronie dróg oddechowych, lecz transmisja
wirusa zachodzi także poprzez kropelki przenoszone na rękach oraz przez
zanieczyszczone środowisko. Ograniczenie epidemii osiągano dzięki
stosowaniu standardowych procedur profilaktyki i kontroli zakażeń (IPC),
zwracając szczególną uwagę na mycie rąk (Shaw, 2006).
10
PRZENOSZENIE ZAKAŻEŃ PRZEZ POWIETRZE
Wirus MERS wydaje się być mniej ekspansywny od wirusa SARS, lecz
powoduje zakażenia obarczone wyższą śmiertelnością (40 – 50%). Przenosi
się drogą powietrzno-kropelkową. Transmisję wirusa obserwowano wśród
członków rodzin osób chorych i wśród pracowników służby zdrowia
opiekujących się chorymi. Jednakże nieznany jest dokładny sposób zakażenia
oraz nie ma żadnych dowodów na utrwaloną transmisję wirusa na ludzi, którzy
nie stykali się bezpośrednio z chorymi. Dotychczas nie wywołał epidemii
o większym zasięgu. Dokładny rezerwuar i droga szerzenia się tego wirusa nie
zostały jak dotąd poznane.
MERS stanowi aktualne zagrożenie, lecz w każdej chwili mogą pojawić się
inne groźne zakażenia wirusowe dróg oddechowych mogące przybrać postać
pandemii, jak SARS, lub ptasia czy świńska grypa. Zapobieganie przenoszeniu
drogą powietrzną oraz ograniczenie innych źródeł środowiskowych wirusów
odpowiedzialnych za ciężkie zakażenia, polega na wdrożeniu tych samych
zasad postępowania, jak w przypadku MERS.
ZAPOBIEGANIE I KONTROLA ZAKAŻEŃ
Nie ma leku przeciwwirusowego skutecznego wobec MERS, zatem głównym
środkiem ochrony jest wprowadzenie ścisłych standardów IPC i stosowanie
ich przez cały czas.
Szczegółowe, aktualne wytyczne i rekomendacje dotyczące prewencji
i postępowania podczas opieki nad przypadkami podejrzanymi i potwierdzonymi
uwzględniające zmienną epidemiologię, diagnostykę i leczenie MERS znajdują
się na stronach WHO (World Health Organisation), CDC (Centers for Disease
Prevention and Control) i PHE (Public Health England).
Zasady kontroli zakażeń są następujące:
• Przeszkoleni pracownicy opieki medycznej powinni być wyczuleni
na możliwość pojawienia się chorych podejrzanych o zakażenie MERS,
szczególnie w przypadku osób przybyłych ze Środkowego Wschodu.
• Ścisłe przestrzeganie w praktyce standardów IPC przez wszystkie
osoby personelu, przez cały czas (niezależnie od obecności pacjentów
z potwierdzonym lub podejrzanym MERS), łącznie z personelem
niemedycznym, jak sprzątaczki i sanitariusze.
• Należy wykrywać potencjalne przypadki zachorowań, zgłaszać je do
lokalnych władz sanitarnych i postępować z chorymi zgodnie z lokalnymi
przepisami i zaleceniami. Materiał do badania powinien być pobierany
i opracowywany zgodnie z przepisami lokalnych organów zarządzających
zdrowiem publicznym oraz procedurami laboratoryjnymi.
• Podwyższone środki ochrony (podciśnienie w izolatce oraz stosowanie
przez personel środków ochrony osobistej [PPE, niezbędne maski FFP3])
muszą być stosowane przez uprzednio właściwie przeszkolony personel
opiekujący się pacjentem z potwierdzonym lub podejrzanym MERS.
• Najbardziej prawdopodobny scenariusz to niespodziewane przyjęcie na
oddział intensywnej opieki medycznej pacjenta z niewydolnością oddechową
o nieznanej etiologii. Personel oddziału powinien być wyczulony na takie
przypadki, zaznajomiony z ryzykiem i właściwym działaniem w zakresie IPC,
musi być wyposażony w odpowiednie maski i umieć ich używać.
11
Aspergillus
Zarodniki grzybów Aspergillus spp. powszechnie występują w przyrodzie;
ich stężenie w powietrzu bardzo wzrasta w okolicy rozbiórek i budów
domów. Zarodniki zwykle nie stanowią zagrożenia dla zdrowych osób, lecz
u chorych w immunosupresji, zwłaszcza w neutropenii, mogą wywołać ciężkie
zakażenia ogólnoustrojowe. Prowadzone w szpitalu prace budowlane wiążą
się z ryzykiem zakażenia dla pacjentów, głównie oddziałów onkologicznych,
hematologicznych oraz intensywnej terapii.
Nie stwierdzono prostego związku między liczbą zarodników Aspergillus
w powietrzu a wystąpieniem zakażeń inwazyjnych, także u pacjentów
w neutropenii. W przypadku niektórych epidemii szpitalnych zaobserwowano
związek z prowadzoną w pobliżu budową lub remontem. Do opieki nad
pacjentem dochodzą wówczas działania polegające na zmniejszeniu
ekspozycji na pył poprzez jak najbardziej szczelne oddzielenie pomieszczeń
z chorymi (osłonę lub zamknięcie), odpylanie i nawilżanie terenu budowy.
ZAPOBIEGANIE I KONTROLA ZAKAŻEŃ PODCZAS
BUDOWY LUB REMONTU
• Pacjenci po przeszczepie szpiku kostnego rutynowo są chronieni
przed zakażeniami przenoszonymi drogą powietrzną, łącznie z infekcjami
wywołanymi przez grzyby Aspergillus, gdyż przebywają w szczelnie
zamykanych izolatkach z podwyższonym ciśnieniem, wyposażonych
w wysoce wydajne filtry cząsteczkowe HEPA.
• Pozostali pacjenci w immunosupresji zwykle przebywają w mniej
chronionym otoczeniu. Jeżeli stężenie zarodników jest wysokie, zagrożeni
chorzy są przenoszeni do innych pomieszczeń na czas budowy lub remontu.
• Ogólne rekomendacje mające na celu zmniejszenie ryzyka
ekspozycji na zarodniki Aspergillus na miejscu budowy są następujące
(CDC, 2003; UK Department of Health Estates and Facilities, 2013):
- Planowanie działań od samego początku z zaangażowaniem zespołu ds. IPC
- Wprowadzenie programu kontroli zanieczyszczenia przed rozpoczęciem
prac budowlanych.
- Zamykanie i uszczelnianie okien w pomieszczeniach wrażliwych pacjentów.
- Całkowite oddzielenie sali pacjentów od miejsca prac barierami sięgającymi
od podłogi do sufitu.
- Zwilżanie terenu prac w celu redukcji zapylenia.
- Stosowanie odkurzaczy z filtrami HEPA.
Norovirus
Norowirus jest przyczyną wysoce zakaźnych, zwykle pozaszpitalnych biegunek
epidemicznych, przebiegających z wymiotami. W szpitalach dzięki szybkiej
transmisji wywołuje duże epidemie, zarówno wśród pacjentów jak i personelu,
co doprowadza nawet do zamknięcia oddziałów.
12
PRZENOSZENIE ZAKAŻEŃ PRZEZ POWIETRZE
Główną drogą przenoszenia jest droga człowiek-człowiek, za pośrednictwem
zanieczyszczonych rąk. Ponadto, wymioty mogą wystąpić nagle i często są
bardzo gwałtowne, co sprzyja skażeniu otoczenia i szybkiemu rozprzestrzenieniu
wirusa. Wirus ma zdolność przeżycia w środowisku od kilku godzin do kilku
tygodni i dlatego środowisko odgrywa ważną rolę w pośredniej transmisji
zakażenia. Wykazano, że wirus może zostać przeniesiony w powietrzu podczas
wymiotów i wywołać zakażenie u osób z najbliższego otoczenia (Marks, 2000,
2003). Tym niemniej, powietrze jest mniej istotną drogą przenoszenia wirusów
pokarmowych i nie wymaga stosowania specjalnych środków ochrony, poza
izolowaniem lub kohortowaniem zakażonych chorych (Harris, 2013).
ZAPOBIEGANIE I KONTROLA ZAKAŻEŃ
Profilaktyka i kontrola zakażeń norowirusowych w szpitalu opiera się
na czterech kluczowych działaniach (CDC Guidelines, 2011):
• Wypisywanie objawowych pacjentów (o ile to możliwe) oraz odsunięcie
od pracy z chorymi zakażonego personelu.
• Niezbędna ścisła izolacja kontaktowa pacjentów do 48 godzin
po ustąpieniu objawów.
• Ograniczenie ruchu pacjentów.
• Częsta dezynfekcja rąk i czyszczenie pomieszczeń.
Przetrwalniki Clostridium
Formy przetrwalnikowe Clostridium są wydalane z kałem i mogą przeżywać
w środowisku miesiącami, a nawet latami. Przenoszenie spor Clostridium
difficile, drobnoustroju odpowiedzialnego za biegunki i rzekomobłoniaste
zapalenie jelit, zachodzi głównie na drodze bezpośredniego kontaktu człowiekczłowiek drogą fekalno-oralną.
Spory Clostridium perfringens teoretycznie mogą zostać przeniesione
od operowanego pacjenta z zainfekowaną raną, poprzez powietrze nad polem
operacyjnym do otwartych ran chirurgicznych innych pacjentów i wywołać
u nich gangrenę, lecz jest to mało prawdopodobne w nowoczesnej chirurgii.
Pacjentów ze zgorzelą gazową umieszcza się na końcu listy operacyjnej
i dokładnie czyści się po nich salę.
ZAPOBIEGANIE I KONTROLA ZAKAŻEŃ
Podstawowym środkiem ochrony przed sporami Clostridium jest izolacja
kontaktowa chorych oraz podwyższona higiena rąk (przede wszystkim mycie)
i czyszczenie pomieszczeń.
Standardowe środki ochrony stosowane w salach operacyjnych, jak wymiana
i filtracja powietrza oraz czyszczenie sal są wystarczające, aby zapobiec
egzogennym zakażeniom Clostridium perfringens.
13
PRZENOSZENIE
ZAKAŻEŃ PRZEZ WODĘ
Zanieczyszczenie drobnoustrojami wody w szpitalach może prowadzić
do epidemii zakażeń:
• Legionella, która pochodzi z zanieczyszczonej instalacji wodnej lub
z systemu klimatyzacji.
• Pseudomonas; zakażenia związane ze sprzętem i aparaturą medyczną
(patrz strona 17), zwłaszcza z endoskopami optycznymi (nieskuteczna
dezynfekcja) lub z basenami do hydroterapii.
• Gram-ujemne pałeczki oportunistyczne, ich źródłem w różnych oddziałach
może być woda z kranu oraz nawilżacze powietrza..
Legionella
Choroba legionistów jest potencjalnie śmiertelnym zapaleniem płuc
wywołanym przez pałeczki Legionella. Jest najlepiej poznaną i najcięższą
postacią kliniczną legionelozy. Każdy może zarazić się, jednak wyższe ryzyko
występuje u osób powyżej 45 roku życia, u palaczy, osób nadużywających
alkoholu, z przewlekłymi chorobami dróg oddechowych i nerek, u diabetyków,
osób z chorobami płuc i serca oraz z defektami odporności.
Pałeczki Legionella często zanieczyszczają instalację wodociągową
wewnątrz szpitala, w tym wieże chłodnicze, kondensatory ewaporacyjne, rury
dostarczające ciepłą i zimną wodę oraz baseny kąpielowe, zwłaszcza takie,
w których woda nie jest wymieniana tylko podlega recyrkulacji. Chętnie bytują
tam, gdzie powstają osady, kamień i tworzy się biofilm.
Pałeczki Legionella przeżywają w niskiej temperaturze, namnażają się
w zakresie 20-45°C i giną w wyższej temperaturze. W optymalnej temperaturze
namnażają się w wodzie w wielkich ilościach i powodują zakażenia osób
inhalujących wysoce skażony aerozol. Często ma to miejsce w przypadku
korzystania z długo nie używanych pryszniców lub kranów, gdy bakterie
namnożą się w wodzie stojącej w doprowadzających do nich rurach. Zakażenia
związane z klimatyzacją w szpitalach zwykle występują epidemicznie,
zwłaszcza, że narażeni na nie są pacjenci ze współistniejącymi chorobami
podstawowymi.
14
ZAPOBIEGANIE I KONTROLA ZAKAŻEŃ (WHO, 2007)
Inhalacyjny charakter zakażeń pałeczkami Legionella sprawia, że pod szczególną
kontrolą powinny znaleźć się wszystkie urządzenia, wytwarzające aerozol
wodno-powietrzny. Zmniejszeniu ryzyka epidemii o etiologii Legionella służy
instalacja bezpiecznego systemu dostarczania wody, oraz odpowiednia
eksploatacja i konserwacja, zapobiegająca namnażaniu się pałeczek
Legionella. Szpital powinien podporządkować się ogólnokrajowym przepisom,
zawierającym szczegółowe wymagania, dotyczące kontroli zakażeń Legionella.
Zasady kontroli i zapobiegania namnażania się pałeczek Legionella są
następujące:
• Szpitale powinny opracować politykę postępowania wobec Legionella –
przy zaangażowaniu zespołu złożonego z lekarzy, pielęgniarek, mikrobiologa
i przedstawiciela zespołu profilaktyki i kontroli zakażeń (IPC), w celu oceny
ryzyka zanieczyszczenia, wprowadzenia programów zmniejszających
to ryzyko, obejmujących monitorowanie stopnia skażenia, szybką
identyfikację zakażonych pacjentów oraz przeprowadzenie dochodzenia
epidemiologicznego w przypadku wystąpienia epidemii.
• Wyznaczenie osoby odpowiedzialnej przed właściwymi władzami za
zarządzanie systemem kontroli i zastosowanymi środkami ochrony.
• Nadzór techniczny wewnętrznej instalacji wodociągowej powinien
obejmować następujące działania:
- eliminację zastoju wody poprzez likwidację wszystkich tzw. „ślepych”
odcinków instalacji
- dostarczanie zimnej wody o temperaturze poniżej 25°C, najlepiej poniżej 20°C
- utrzymywanie temperatury wody gorącej na poziomie wystarczającym do
zabicia komórek Legionella, jednocześnie niepowodującym poparzenia,
tj. powyżej 50°C; zwykle zaleca się temperaturę 60°C
- zapobieganie procesom korozji, tworzenia kamienia i biofilmu
- regularne płukanie kranów i pryszniców niezależnie od ich używania
- monitorowanie stężenia Legionella i wprowadzanie dodatkowych cykli
dezynfekcji w celu utrzymania liczby bakterii na niskim poziomie.
Wielooporne pałeczki Gram-ujemne
(CDC, 2003; Tacconelli et al, 2014)
Liczne gatunki Gram-ujemnych, oportunistycznych pałeczek bytują i namnażają
się w wilgotnych rezerwuarach w środowisku szpitalnym, jakim jest instalacja
wodno-kanalizacyjna, armatura, maszyny do lodu, łaźnie wodne, baseny
do hydroterapii, itp., skąd bakterie mogą być przeniesione na inne elementy
otoczenia i bezpośrednio na pacjentów.
Takimi wodnymi drobnoustrojami są pałeczki niefermentujące z rodzaju
Pseudomonas, Acinetobacter, Flavobacterium, oraz Serratia. Bakterie te są
naturalnie oporne na wiele antybiotyków, a ponadto mają zdolność łatwego
nabywania nowych genów oporności.
15
ZAPOBIEGANIE I KONTROLA ZAKAŻEŃ
Wielooporne pałeczki Gram-ujemne mogą zanieczyszczać i przeżywać
w jałowych roztworach lub zbiornikach czystej wody używanej do aparatury
medycznej. Epidemiczne zakażenia szpitalne wieloopornymi szczepami
bakterii występują po podaniu pacjentom niesterylnych płynów infuzyjnych lub
w wyniku nieskutecznego procesu dekontaminacji i dezynfekcji sprzętu, takiego
jak aparatura do monitorowania ciśnienia krwi, endoskopy, ssaki, nawilżacze,
nebulizatory i odciągacze pokarmu. W podobny sposób może dojść do
zanieczyszczenia wieloopornymi pałeczkami Klebsiella, Serratia i Enterobacter,
zimnych produktów spożywczych oraz mieszanin do żywienia pozajelitowego.
Gram-ujemne pałeczki niefermentujące są stosunkowo odporne na działanie
środków dezynfekcyjnych i czynników bakteriostatycznych. Zanieczyszczenie
płynów dezynfekcyjnych, preparatów i leków konfekcjonowanych do
wielokrotnego użytku może prowadzić do epidemicznych zakażeń
wieloopornymi bakteriami; przykładem jest pooperacyjne wewnętrzne
zapalenie oka o etiologii Pseudomonas aeruginosa lub Burkholderia cepacia,
związane z zanieczyszczonymi kroplami do oczu (CDC, 1996; Lalitha et al, 2014).
ZAPOBIEGANIE I KONTROLA ZAKAŻEŃ
Profilaktyka i kontrola zakażeń Gram-ujemnymi pałeczkami MDR polega
na eliminacji wilgotnych źródeł środowiskowych poprzez stosowanie
standardowych środków:
• Preparaty dezynfekcyjne powinny być świeżo sporządzone, rozlane do
wysterylizowanych butelek; optymalnie, gdyby jedna była przeznaczona do
użytku w otoczeniu jednego pacjenta.
• Urządzenia zawierające wodę (maszyny do lodu, łaźnie wodne,
nawilżacze) powinny być regularnie czyszczone i napełniane świeżą wodą.
W miarę możliwości, można do wody dodać środka dezynfekcyjnego, aby
zahamować rozwój bakterii.
• Specjalne instrukcje określają sposób badania zanieczyszczenia
mikrobiologicznego poszczególnych urządzeń, jak:
- baseny rehabilitacyjne (strona 34)
- podgrzewacze do mleka (NICE 2010)
- woda do dializ (strona 35)
- giętkie endoskopy optyczne (strona 17)
• W innych przypadkach podstawowym działaniem jest mycie i dezynfekcja
sprzętu lub urządzenia pomiędzy używaniem go dla kolejnych pacjentów.
• Duże sprzęty, jak wentylatory czy inkubatory, należy poddawać dodatkowej
dezynfekcji nadtlenkiem wodoru w specjalnych komorach.
16
PRZENOSZENIE
ZAKAŻEŃ PRZEZ
APARATURĘ MEDYCZNĄ
W szpitalach epidemiczne zakażenia często są związane ze sprzętem
i aparaturą medyczną, głównie z używaniem endoskopów optycznych.
W miarę możliwości elementy aparatury mające kontakt z pacjentem
powinny być wymienialne lub jednorazowego użytku. W przypadku sprzętu
wielorazowego użytku należy opracować i ściśle przestrzegać procedury
dekontaminacji i dezynfekcji.
Sprzęt medyczny powinien być myty i dezynfekowany przez przeszkolone
osoby, w odpowiednich certyfikowanych i audytowanych jednostkach.
Endoskopy optyczne
Giętkie endoskopy optyczne są przykładem urządzeń medycznych, które
są wprowadzane do ciała pacjenta i mają styczność zarówno z miejscami
jałowymi, jak i niejałowymi; endoskop zanieczyszczony mikrobiologicznie
może spowodować zakażenie.
Endoskopy optyczne są wrażliwe na wysoką temperaturę i mogą być
dezynfekowane tylko metodą chemiczną. Nie jest ona tak skuteczna, jak
autoklawowanie, i zdarza się, że endoskop pozostaje skażony a jego użycie
wywoła u pacjenta zakażenie wieloopornymi pałeczkami Gram-ujemnymi
związanymi ze środowiskiem wodnym, jak Pseudomonas spp.
Zdarzają się epidemie wywołane przez środowiskowe gatunki Mycobacterium
spp., zanieczyszczające punkty czerpalne wody i stosunkowo odporne na
działanie preparatów dezynfekcyjnych. Gdy w szpitalu pojawią się przypadki
zakażeń tymi drobnoustrojami, należy upewnić się, czy dekontaminacja
endoskopów jest skuteczna, a sam sprzęt bezpieczny.
ZAPOBIEGANIE I KONTROLA ZAKAŻEŃ
(Department of Health, England, 2013; BSG Report, 2014; ASG & SHEA 2011)
Dekontaminacja endoskopów optycznych jest specjalistyczną procedurą,
którą powinien wykonywać tylko przeszkolony personel w akredytowanych,
przeznaczonych do tego jednostkach.
Procedurę tę należy dostosować do lokalnych wymogów sanitarnych, oraz
przestrzegać zaleceń producenta w kwestii obsługi automatycznych myjni
17
(AWD), używanych do mycia i dezynfekcji różnego typu endoskopów oraz
stosowanych w nich środków chemicznych.
Umyte endoskopy giętkie są dezynfekowane w myjni AWD specjalnym
chemicznym roztworem, w następnych cyklach płukane i suszone. Stosuje
się także działanie enzymatyczne w celu usunięcia biofilmu.
Skuteczna dezynfekcja zależy od:
• Prawidłowej obsługi AWD
• Używania właściwego preparatu dezynfekcyjnego, w odpowiednim
stężeniu i czasie ekspozycji
• Używania czystej wody do końcowego płukania.
Poniżej zebrano ogólne zasady kontroli zakażeń; lokalne wymogi mogą być
bardziej szczegółowe:
• Kontrola skuteczności procesu mycia i dezynfekcji oraz bezpieczeństwa
przechowywania i transportu
• W przypadku stwierdzenia nieskuteczności procesu lub wystąpienia
zakażeń związanych z badaniami endoskopowymi, należy wycofać
z użytkowania zanieczyszczone endoskopy, określić rodzaj, źródło i drogi
przenoszenia drobnoustroju powodującego zakażenia, oraz usunąć usterkę
AWD.
• Najskuteczniejszą metodą sterylizacji jest działanie wysoką temperaturą
przy podwyższonym ciśnieniu w autoklawie (sprzęt odporny na wysoką
temperaturę, jak metalowe narzędzia chirurgiczne czy sztywne endoskopy).
• Giętkie endoskopy optyczne są wrażliwe na wysoką temperaturę i nie
mogą być autoklawowane; stosuje się wobec nich dezynfekcję wysokiego
stopnia zamiast sterylizacji. Nowoczesne myjnie AWD przeprowadzają
dezynfekcję chemiczną wysokiego stopnia za pomocą kwasu nadoctowego,
a następnie wykonują cykle płukania wodą.
• Woda do płukania endoskopów żołądkowo-jelitowych (które mają
kontakt z błonami śluzowymi, wydzielinami i wydalinami, lecz nie są
wprowadzane w jałowe przestrzenie ciała) – wystarczająca jest o jakości
wody pitnej.
• Woda do płukania endoskopów wprowadzanych do jałowych jam ciała
(np. artroskopów) musi mieć wysoki standard czystości.
• Po końcowym płukaniu wodą w AWD w świetle endoskopu może zostać
niewielka liczba bakterii. Nie powinno to stanowić zagrożenia dla pacjenta –
ani ryzyka infekcji, ani ryzyka błędnej diagnozy na skutek zanieczyszczenia
pobieranej za pomocą endoskopu próbki (wycinka lub aspiratu).
18
PRZENOSZENIE ZAKAŻEŃ PRZEZ APARATURĘ MEDYCZNĄ
Monitorowanie czystości mikrobiologicznej AWD:
• Raz w tygodniu test jakości wody z końcowego płukania. Polega na
określeniu liczby zdolnych do życia komórek bakterii (total bacterial viable
count, TVC), wyrażonej w jednostkach tworzących kolonie (colony forming
unit, cfu) na 100 mL.
• Kwartalne i coroczne testy z przedłużoną inkubacją, która pozwoli wykryć
obecność wszystkich kontaminujących mykobakterii.
Za bezpieczny poziom TVC zwykle uznaje się
< 10 cfu / 100 ml.
Za bezpieczny poziom mykobakterii zwykle
uznaje się brak mykobakterii w 200 ml wody.
W przypadku wzrostu TVC do 100 cfu w 100 ml wody, należy wykonać cykl
samo-dezynfekcji AWD.
Jeżeli poziom TVC pozostaje wysoki, (w próbce wody pobranej z myjni
liczba bakterii wynosi >100 cfu / 100 ml) myjnię należy wycofać z użytkowania
i poddać przeglądowi w celu wykrycia usterki.
Regularne badania mikrobiologiczne wykryją nieznaczne wahania małej liczby
bakterii oraz pozwolą na szybkie działanie w przypadku wystąpienia tendencji
zwyżkowej. Po uzyskaniu nieprawidłowych wyników badań, należy pobrać do
badania próbki wody użytej do końcowego płukania (wodę doprowadzaną
do myjni oraz ze zbiornika wewnątrz myjni). Ponadto należy zbadać, i w razie
potrzeby wymienić, filtry, przewody i pompy.
Środki dezynfekcyjne – strona 27.
19
PRZENOSZENIE
ZAKAŻEŃ PRZEZ
POWIERZCHNIE SUCHE
Do niedawna kontrola infekcji skupiała się na zakażeniach florą
endogenną pacjentów, która uważana była za główne źródło krzyżowych
zakażeń szpitalnych, przenoszona poprzez ręce personelu z zakażonych
lub skolonizowanych chorych. Obecnie za ważne źródło infekcji uważa
się zanieczyszczone szpitalne środowisko, leki oraz wodę.
Ostatnio zwrócono uwagę na rolę suchych elementów środowiska szpitalnego
jako potencjalnego nośnika drobnoustrojów MDR, odpowiedzialnych za
zakażenia (Boyce, 2007; Otter et al, 2011, 2013. Weber et al, 2010, 2013; Gebel et al, 2013;
Tacconelli et al, 2014).
WZRASTA LICZBA DOWODÓW NA WAŻNĄ ROLĘ ŚRODOWISKA
SZPITALNEGO W WYWOŁYWANIU ZAKAŻEŃ:
(Carling et al, 2013)
Groźne szpitalne patogeny są zdolne do długiego
przeżycia w suchym środowisku szpitalnym
Najważniejsze szpitalne patogeny, meticylino-oporne i meticylino-wrażliwe
szczepy Staphylococcus aureus (MRSA, MSSA),wankomycynooporne
i wrażliwe Enterococcus spp. (VRE, VSE), Clostridium difficile, Acinetobacter spp.
i norowirusy, mogą miesiącami przeżywać na suchych powierzchniach
(Tabela 1). Bakterie Gram-ujemne inne niż Acinetobacter są mniej wytrzymałe
na wysychanie, lecz pałeczki Pseudomonas aeruginosa i Klebsiella spp.
zdolne są do długiego przetrwania w suchym środowisku i wywołania zakażeń
krzyżowych.
20
Tabla 1.
Przeżywanie patogenów szpitalnych na suchych powierzchniach.
[na podstawie Otter et al, 2013]
Drobnoustrój
Czas przeżycia
Clostridium difficile (spory)
> 5 miesięcy
Acinetobacter spp.
od 3 dni do 11 miesięcy
Enterococcus spp. łącznie z VRE
od 5 dni do >46 miesięcy
Pseudomonas aeruginosa
od 6 godzin do 16 miesięcy
Klebsiella spp.
od 2 godzin do >30 miesięcy
Staphylococcus aureus łącznie z MRSA
od 7 dni do >12 miesięcy
Norowirusy (i koci kaliciwirus)
Od 8 godzin do >2 tygodni
Powierzchnie w szpitalu, otaczające zakażonych
i skolonizowanych pacjentów, są często, nawet w dużym
stopniu, zanieczyszczone szpitalnymi szczepami bakterii.
(Weber et al, 2013)
Częstość występowania patogenów szpitalnych w próbkach środowiskowych,
pobranych w sali zakażonego lub skolonizowanego danym patogenem
pacjenta, oceniono na 1-64% w przypadku MRSA, 7-70% dla VRE, 3-74%
dla C. difficile i 3-50% dla Acinetobacter spp. W niektórych doniesieniach
opisano występowanie w jednej sali kilku szczepów danego patogenu,
np. MRSA; ponadto były to szczepy inne, niż szczep kolonizujący pacjenta
aktualnie tam przebywającego. Świadczy to o zdolności długiego przeżycia
drobnoustrojów w środowisku, w tym przypadku szczepów pochodzących od
dawniej hospitalizowanych chorych.
Kontakt personelu z powierzchniami lub sprzętem
medycznym prowadzi do zanieczyszczenia rąk
i/lub rękawiczek
Badania wykazały, że zanieczyszczenie rąk personelu po pobycie w izolatce
jest podobne zarówno w przypadku bezpośredniego kontaktu z pacjentem jak
i w przypadku kontaktu z tzw. strefą pacjenta, czyli najbliższym otoczeniem
(Tabla 2).
21
Tabla 2.
Transfer patogenów szpitalnych z powierzchni na ręce personelu służby zdrowia.
[na podstawie Otter et al, 2013]
Bezpośredni kontakt z pacjentem
Kontakt wyłącznie
z otoczeniem
52% z 44 osób przeniosło VRE
na rękach lub rękawiczkach
45% z 50 osób przeniosło MRSA
na rękawiczkach
45% z 50 osób przeniosło MRSA
na rękawiczkach
50% z 30 osób przeniosło Clostridium
difficile na rękawiczkach
50% z 30 osób przeniosło
Clostridium difficile na rękawiczkach
Przestrzeganie higieny rąk: 80%
Przestrzeganie higieny rąk: 50%
Rycina 2.
Najczęstsze źródła i drogi transmisji patogenów
szpitalnych i potencjalne strategie dezynfekcji
środowiska.
[na podstawie Donskey, 2013]
Zidentyfikowany
pacjent
skolonizowany
lub zakażony
Ekspozycja
Powierzchnie
w izolatce
Przenośne
wyposażenie
i sprzęt
4
Niezidentyfikowany
nosiciel
Skóra, pościel
i ubranie
Pacjent skolonizowany lub zakażony szczepem szpitalnym jest źródłem rozprzestrzeniania
się takiego szczepu poprzez swoją skórę, odzież i najbliższe otoczenie. Inni wrażliwi
chorzy mogą nabyć patogen przez bezpośredni kontakt z powierzchnią lub aparaturą,
lub za pośrednictwem rąk personelu. Określono cztery źródła patogenów szpitalnych
i potencjalne strategie dezynfekcji środowiska, mające na celu przerwanie drogi transmisji:
1 zanieczyszczone powierzchnie mimo czyszczenia izolatki stwarzają ryzyko
przeniesienia szczepu szpitalnego na kolejnego pacjenta leżącego w tej izolatce
(działanie interwencyjne: zwiększenie skuteczności czyszczenia i dezynfekcji sali
po poprzednim pacjencie);
22
PRZENOSZENIE ZAKAŻEŃ PRZEZ POWIERZCHNIE SUCHE
Ryzyko zanieczyszczenia rąk personelu zależy od stopnia kontaminacji
środowiska. Najczęściej dotykane powierzchnie są najsilniej zanieczyszczone.
Takie same obserwacje opisał Morgan i wsp. (Crit Care Med., 2012): szczep
A. baumanii MDR został przeniesiony podczas jednego z trzech kontaktów
personelu ze skolonizowanym pacjentem. Zanieczyszczenie środowiska
bakteriami MDR jest najbardziej prognostycznym czynnikiem dla przeniesienia
zanieczyszczenia na pracownika służy zdrowia. Istnieje także silny związek
między kolonizacją lub zakażeniem pacjenta a kontaminacją otoczenia
pacjenta przez A. baumanii (Munoz-Price et al, 2013).
Mimo, że transfer patogenów szpitalnych między pacjentami najczęściej
zachodzi za pośrednictwem rąk personelu, to zanieczyszczone powierzchnie
i przedmioty stanowią istotną bezpośrednią lub pośrednią drogę przenoszenia
(Rycina 2).
1
2
Ręce
personelu
medycznego
Pacjent podatny
na zakażenie
3
zanieczyszczone powierzchnie w izolatce stwarzają ryzyko zanieczyszczenia
rąk personelu (działanie interwencyjne: codzienna dezynfekcja powierzchni
i przedmiotów najczęściej dotykanych);
3 zanieczyszczenie przenośnego sprzętu i wyposażenia (działanie interwencyjne:
dezynfekcja sprzętu pomiędzy użyciem go między jednym a drugim pacjentem lub
używanie w izolatkach jednorazowych elementów wyposażenia);
4 zanieczyszczenie powierzchni w salach niezidentyfikowanych nosicieli szczepów
szpitalnych (działanie interwencyjne: zwiększenie skuteczności czyszczenia
i dezynfekcji wszystkich sal na oddziałach wysokiego ryzyka lub w całym szpitalu).
2
23
Pacjent przyjmowany do sali, w której uprzednio
leżał chory skolonizowany lub zakażony patogenem
szpitalnym jest narażony na większe ryzyko kolonizacji
lub zakażenia tym drobnoustrojem
Dotyczy to MRSA, VRE, C. difficile, P. aeruginosa i Acinetobacter (Rycina 3)
i jest ważnym dowodem na rolę zanieczyszczonych powierzchni w szpitalnych
zakażeniach krzyżowych.
Rycina 3.
Wykres przedstawiający wzrost ryzyka związanego z poprzednim pacjentem.
[na podstawie Otter et al, 2013]
MRSA
VRE
P. aeruginosa
VRE (2 tygodnie)*
VRE**
C. difficile
A. baumannii
0
1
2
3
4
Różny stopień ryzyka
* Każdy pacjent skolonizowany lub zakażony VRE przebywający wciągu 2 tygodni przed przyjęciem
pacjenta, dla którego było oceniane ryzyko.
** Pacjent bezpośrednio poprzedzający tego, dla którego oceniano ryzyko, był skolonizowany lub
zakażony VRE.
24
PRZENOSZENIE ZAKAŻEŃ PRZEZ POWIERZCHNIE SUCHE
Zwiększenie skuteczności sprzątania sal pacjentów
i czyszczenia izolatek prowadzi do zmniejszenia liczby
zakażeń
Prowadzone badania wykazały, że mycie pomieszczeń szpitalnych za
pomocą podchlorynu powoduje zmniejszenie częstości zakażeń C. difficile,
zaś częstsze i bardziej skuteczne czyszczenie wiąże się z redukcją zakażeń
MRSA i VRE. (Donskey et al., 2013).
Podobnie, w przypadku poprawy skuteczności czyszczenia izolatek po pobycie
skolonizowanych pacjentów, a przed przyjęciem nowych, nie skolonizowanych,
zaobserwowano zmniejszenie liczby zakażeń u nowych pacjentów. Passaretti
i wsp. używali par nadtlenku wodoru (HPV) do dezynfekcji izolatek po pacjentach
skolonizowanych lub zakażonych szczepami bakterii MDR:
• Dekontaminacja za pomocą HPV redukuje stopień zanieczyszczenia
bakteriami MDR o 35%.
• Pacjenci przyjęci do sal dekontaminowanych HPV znacznie rzadziej
nabywali szczepy MDR (redukcja o 64%) niż pacjenci położeni w salach
dezynfekowanych konwencjonalnymi metodami.
• Występuje znaczna 80% redukcja ryzyka nabycia VRE od poprzedniego
pacjenta i tylko nieznaczna redukcja ryzyka nabycia MRSA, C. difficile
i Gram-ujemnych pałeczek MDR.
STRATEGIE REDUKCJI I KONTROLI
ZANIECZYSZCZENIA SUCHYCH POWIERZCHNI
Poprawa jakości sprzątania
Liczne badania wykazały, że jakość sprzątania w szpitalach często jest
obniżana poniżej akceptowanych standardów i wówczas w wyniku
konwencjonalnego procesu czyszczenia stopień skażenia mikrobiologicznego
powierzchni zostaje zredukowany jedynie o 50% (Otter et al, 2011; Weber et al, 2013).
Wyższa jakość sprzątania może spowodować spadek liczby zakażeń:
• 66% redukcja stopnia kolonizacji VRE w przypadku podniesienia jakości
codziennego czyszczenia otoczenia o 75% (Hayden et al, 1996).
• 50% i 28% redukcja kolonizacji, odpowiednio MRSA i VRE w wyniku poprawy
sprzątania o 80% (Datta et al, 2011).
25
Programy edukacyjne prowadzą do zwiększenia efektywności czyszczenia
otoczenia chorych, a tym samym do ograniczenia kontaminacji środowiska,
a w niektórych przypadkach pośrednio do zmniejszenia liczby zakażeń
(Donskey, 2013).
Ze względu na rolę, jaką zanieczyszczenie środowiska odgrywa w zakażeniach
szpitalnych, Centers for Disease Control and Prevention (CDC) opracowało
zestaw narzędzi, pomagających szpitalom postępować zgodnie z wytycznymi
zawartymi w praktycznym przewodniku CDC z 2004 i poprawiać jakość
sprzątania (patrz poniżej).
PRAKTYCZNY ZESTAW NARZĘDZI CDC
Zestaw narzędzi został opracowany jako przewodnik wdrożeniowy
przez Centers for Disease Control and Prevention (CDC) (Guh & Carling,
2010) aby pomóc szpitalom we wdrażaniu rekomendacji CDC z 2003 roku
dotyczących „wprowadzenia w życie procedur czyszczenia i dezynfekcji
powierzchni znajdujących się w najbliższym otoczeniu pacjenta, które
często są dotykane, zarówno przez pacjenta, jak i personel medyczny”
(Sehulster et al, 2004).
Zestaw narzędzi to plan działania na dwóch poziomach dekontaminacji
izolatki po pobycie pacjenta:
• Poziom I - składa się z podstawowych działań optymalizujących
dezynfekcję i mycie, procedur, materiałów edukacyjnych i szkoleniowych
dla personelu.
• Poziom 2 - wszystkie elementy poziomu 1 plus obiektywne
monitorowanie wykonania praktycznego, poprzez ocenę „czystości”
(pomiar obciążenia biologicznego na powierzchniach) lub ocenę
„sprzątania” (ocena, czy sprzątanie jest dobrze wykonane):
- Obciążenie biologiczne można ocenić poprzez pomiar
bioluminescencji adenozyno-trójfosforanu (ATP) w wymazie lub
odcisku pobranym z badanej powierzchni. Tym niemniej, dotąd nie
przyjęto ogólnie akceptowanych standardów sprzątania i czystości
(Carling, 2013).
- Sprzątanie może być na bieżąco kontrolowane poprzez praktyczną
obserwację oraz przy pomocy markerów fluorescencyjnych.
Badanie zanieczyszczenia środowiska
Pobieranie próbek do badania mikrobiologicznego
Nie zaleca się rutynowego pobierania próbek do badania mikrobiologicznego
z powierzchni w pomieszczeniach szpitalnych. Badania wykonuje się w celu:
• Identyfikacji środowiskowego źródła epidemii;
• Potwierdzenia skuteczności procedur dezynfekcji i mycia;
• Monitorowania zgodności sposobu sprzątania z odpowiednimi procedurami.
26
PRZENOSZENIE ZAKAŻEŃ PRZEZ POWIERZCHNIE SUCHE
• Wymazy pozwalają zidentyfikować patogeny i orientacyjnie ocenić ich
ilość. Pobranie wymazów i posiew ich na podłoża agarowe wymaga więcej
czasu niż użycie płytek kontaktowych (patrz poniżej). Metoda ta jest głównie
stosowana w badaniach efektywności sprzątania oraz do identyfikacji
poszczególnych patogenów, co ułatwia poznanie epidemiologii zakażeń
podczas epidemii.
• Bezpośrednia metoda płytek odciskowych wykorzystuje dwustronne
płytki typu „dip slides” lub okrągłe płytki kontaktowe pokryte warstwą
podłoża agarowego do bezpośredniego pobierania próbki środowiskowej
z powierzchni. Liczba kolonii uzyskanych na powierzchni agarowej wskazuje
na stopień obciążenia mikrobiologicznego.
Inne metody oceny kontaminacji środowiska
i skuteczności sprzątania
• Żel fluorescencyjny jest stosowany do kontroli dokładności procesu mycia.
Żel jest nanoszony w sposób niewidoczny dla osoby sprzątającej w celu
zaznaczenia miejsc, które powinny być umyte. Po sprzątaniu widać w świetle
ultrafioletowym, czy żel został usunięty, a tym samym mycie dokładnie
wykonane. Metoda ta jest stosowana podczas praktycznych szkoleń
personelu sprzątającego.
• Technologia bioluminescencji adenozynotrójfosforanu (ATP)
pozwala wykryć obecność materii organicznej, w tym zarówno
żywych, jak i martwych komórek drobnoustrojów na powierzchniach.
Półautomatyczny system, powszechnie używany do monitorowania
zanieczyszczenia powierzchni w przemyśle spożywczym, został niedawno
zaadaptowany do badania czystości w obiektach służby zdrowia.
Tym niemniej, z powodu ogólnie niższego stopnia zanieczyszczenia
w szpitalu oraz detekcji także martwych drobnoustrojów, czułość
i swoistość tej metody wynosi około 57%. Ma ona ograniczone
zastosowanie do oceny kontaminacji środowiska szpitalnego (Mulvet
et al, 2011), jedynie może być stosowana do monitorowania skuteczności
sprzątania.
Środki dezynfekcyjne
Na potrzeby dezynfekcji i sterylizacji, narzędzia i sprzęt medyczny pod
względem ryzyka zakażenia można podzielić na krytyczny, półkrytyczny
i niekrytyczny (CDC, Rutala & Weber, 2008).
27
Sprzęt krytyczny jest wprowadzany do jałowych tkanek; są to narzędzia
chirurgiczne, cewniki naczyniowe i moczowe, oraz implanty. W przypadku
kontaminacji takie przedmioty stanowią wysokie ryzyko zakażenia
pacjenta. Powinny one być jałowe, jednorazowego użytku; jeżeli są do
wielokrotnego użytku, wówczas wymagają sterylizacji (autoklawowania)
przed kolejnym użyciem.
Narzędzia i sprzęt wrażliwy na wysoką temperaturę, jak giętkie
endoskopy optyczne, powinien być poddawany dezynfekcji chemicznej
wysokiego stopnia; ze względu na potencjalne ryzyko związane z tą
metodą, procedura dezynfekcji powinna być szczegółowo opisana, a jej
wykonywanie dokładnie monitorowane (patrz strona 17-18).
Sprzęt półkrytyczny ma kontakt z błonami śluzowymi lub z uszkodzoną
skórą; jest to sprzęt używany podczas znieczulania oraz do terapii
respiratorowej, niektóre endoskopy, ostrza laryngoskopów i cystoskopy.
Są one poddawane po umyciu dezynfekcji chemicznej wysokiego stopnia
(zabija wirusy i bakterie, lecz pozostawia spory).
Sprzęt niekrytyczny ma kontakt wyłącznie z nienaruszoną skórą, bez
kontaktu z błonami śluzowymi; są to baseny, mankiety aparatów do
mierzenia ciśnienia, stetoskopy, kule inwalidzkie i komputery. Przedmioty
te mogą być czyszczone standardowymi preparatami myjącymi
i przecierane środkiem dezynfekcyjnym. Częste używanie wielorazowych
mankietów i opasek od ciśnieniomierzy zwiększa częstość krzyżowego
przenoszenia patogenów szpitalnych MDR.
Powierzchnie w szpitalu, takie jak podłogi czy blaty stolików
przyłóżkowych, są sklasyfikowane jako niekrytyczne. Przeważa pogląd,
że wystarczające jest mycie ich detergentem (Ruden & Daschner, 2002), jednak
niektórzy badacze zalecają także stosowanie preparatów dezynfekcyjnych
(Rutala & Weber, 2002, 2008). Ryzyko transmisji bakterii MDR spowodowało
wprowadzenie specjalnych procedur dezynfekcji łóżek, na których leżeli
skolonizowani lub zakażeni pacjenci, polegającej na dekontaminacji za
pomocą gorącej pary wodnej lub nadtlenku wodoru.
Pojawiają się coraz liczniejsze dowody świadczące o roli czyszczenia izolatek
po pacjentach skolonizowanych bakteriami MDR i czyszczenia oddziału lub
otoczenia łóżka pacjenta w trakcie lub po epidemii zakażeń C. difficile lub
norowirusami.
Ponadto, wraz ze wzrostem świadomości na temat roli środowiska szpitalnego
w transmisji zakażeń, rutynowa dezynfekcja podłóg i innych powierzchni
jest coraz częstszą praktyką, mimo, że nie ma wielu dowodów, że działania
te zmniejszą liczbę infekcji.
28
PRZENOSZENIE ZAKAŻEŃ PRZEZ POWIERZCHNIE SUCHE
Najczęściej używane preparaty do dezynfekcji powierzchni zawierają fenole
i czwartorzędowe zasady amoniowe, lecz związki te nie są aktywne wobec
drobnoustrojów wytwarzających przetrwalniki, jak C. difficile, ani wobec
wirusów, np. norowirusów. Często stosowane są podchloryny, które zabijają
wirusy, lecz wykazują zmienną aktywność wobec spor. Trwają badania nad
preparatami działającymi na spory.
Dezynfekcja powinna być integralną częścią profilaktyki i kontroli zakażeń,
z określonymi standardami i kontrolami (Gebel et al, 2013). Niezbędne jest:
• Określenie podstawowych zasad czyszczenia i dezynfekcji.
• Wprowadzenie tych zasad w życie: opisanie procedur poszczególnych
działań, przeprowadzenie szkoleń oraz odpowiednich audytów.
• Opracowanie procedur testowania skuteczności działania preparatów
dezynfekcyjnych w różnych sytuacjach.
Powierzchnie w szpitalu - materiały i wykonanie
Efektywność sprzątania w szpitalu zależy w dużej mierze od materiałów,
z jakich wykonane są myte i dezynfekowane powierzchnie, meble i inne
przedmioty. Ważne jest, czy materiały te są odporne na zanieczyszczenie
i łatwe do umycia. Nowoczesne materiały, używane do produkcji sprzętów
szpitalnych mają powłokę antybakteryjną, która redukuje zanieczyszczenie
powierzchni. Mimo to nie wykazano ich bezpośredniego wpływu
na odsetek zakażeń. Jednakże w jednym z ostatnio przeprowadzonych badań
zaobserwowano, że zastosowanie w sali szpitalnej powierzchni pokrytych
miedzią spowodowało zmniejszenie liczby zakażeń szpitalnych o ponad 50%
(Salgado et al, 2013).
Nowe technologie dekontaminacji powierzchni
Z powodu problemów związanych z konwencjonalnymi sposobami sprzątania
i dezynfekcji sal po pacjentach, wprowadzono szereg nowych metod dekontaminacji.
Jedną z nich jest automatyczny system wykorzystujący promieniowanie
UV i pary nadtlenku wodoru (H2O2) (Otter et al, 2013). Automatyka eliminuje
niedoskonałości związane z ludzką pracą, a system jest przedstawiany jako
„dezynfekcja bezdotykowa” (NTD). Stosowanie H2O2 jest skuteczne zarówno
w zmniejszeniu ryzyka kolonizacji pacjenta szczepami MDR, jak i kontaminacji
otoczenia (Passaretti et al, 2013; Mitchell et al, 2014). Ograniczenia zastosowania H2O2
wynikają z wysokich kosztów oraz konieczności opróżnienia i zamknięcia sali
na czas dezynfekcji.
29
ORGANIZACJA
I ZARZĄDZANIE
Środowisko placówek służby zdrowia jest podatne na zanieczyszczenie
potencjalnie chorobotwórczymi drobnoustrojami, z których wiele to
wielooporne szczepy bakterii (MDR). Sytuacja ta jest pod nadzorem
Zespołu Zakażeń Szpitalnych (ZZS), który składa raporty bezpośrednio
do zarządu szpitala, lub za pośrednictwem działu zarządzania ryzykiem
lub działu organizacji pracy klinicznej. Skład ZZS jest interdyscyplinarny,
w jego skład wchodzą: mikrobiolog, pielęgniarka, lekarz, kierownik
administracji, apteki i centralnej sterylizatorni (Rycina 4). W dużych
szpitalach zaleca się wydzielenie osobnego podzespołu ZZS ds.
dekontaminacji.
Szkolenia i ćwiczenia praktyczne powinny uświadomić personelowi
problemy związane z zakażeniami szpitalnymi i wielką rolę higieny otoczenia
chorych w profilaktyce i kontroli zakażeń. Przeprowadzone audyty wykazują
skuteczność takich szkoleń.
Należy spisać i na bieżąco aktualizować zasady działania w każdej dziedzinie
związanej z kontrolą zakażeń, oparte na opublikowanych wytycznych
i przepisach. Zgodność wykonania z zasadami powinna być audytowana.
System nadzoru powinien umożliwić szybkie wykrycie zakażenia
szpitalnego i możliwości wystąpienia epidemii. W przypadku spodziewanego
rozprzestrzenienia zakażeń epidemicznych, należy zidentyfikować źródła
i drogi szerzenia zakażeń, określić czynnik etiologiczny, i w razie potrzeby
wykonać typowanie (np. genetyczne). Wykrycie grupy podobnych przypadków
zakażeń wymaga zbadania, czy nie jest to epidemia, i podjęcia odpowiednich
działań interwencyjnych, aby do niej nie doszło.
Dochodzenie epidemiczne powinno wskazać możliwe źródła środowiskowe.
Należy wówczas pobrać odpowiednie próbki ze środowiska. Zaraz po
tym, gdy incydent zakażeń mających związek ze środowiskiem zostanie
zidentyfikowany i objęty kontrolą, należy wprowadzić zmiany w zasadach
działania i praktyce nadzoru nad zakażeniami, które zapobiegną powtórzeniu
podobnej sytuacji.
30
Rycina 4.
Przykład powiązań jednostek organizacyjnych szpitala podczas dochodzenia
epidemiologicznego.
Zarząd Szpitala
Dział
Zarządzania
Ryzykiem
Dział
Organizacji Pracy
Klinicznej
Zespół
Zakażeń
Szpitalnych
Serwis
sprzątający
Dział gospodarczy
Dział techniczny
Centralna
sterylizatornia
Lekarze
Przedstawiciele
jednostek
organizacyjnych
i zawodów
Pielęgniarki
Mikrobiolog
Blok operacyjny
Apteka
Pracownia
endoskopowa
31
POBIERANIE PRÓBEK
ŚRODOWISKOWYCH
DO BADANIA
MIKROBIOLOGICZNEGO
Podczas badań mikrobiologicznych środowiska należy uwzględnić rodzaj
i cel pobierania próbek, oraz jaki wynik chcemy uzyskać – ilościowy czy
jakościowy. Niezbędna jest wiedza, jak interpretować wyniki badań
i jakie działania podjąć po ich uzyskaniu. Interpretacja może sprawiać
trudności z powodu braku standardów definiujących zanieczyszczenie
mikrobiologiczne.
Badanie czystości powietrza
Próbki powietrza pobiera się zazwyczaj w celu oceny czystości powietrza
w obszarach chronionych, jak sale operacyjne, izolatki z podwyższonym
ciśnieniem, sterylne boksy w aptece itp.
Przed pobieraniem próbek należy określić:
• Rodzaj szukanego drobnoustroju;
• Rodzaj użytego podłoża do hodowli;
• Objętość badanego powietrza;
• Sposób wyrażenia wyniku: jakościowy czy ilościowy;
• Jakie działania, w zależności od wyniku, zostaną podjęte.
Sposób pobierania próbek może być bierny lub czynny:
• Bierne pobieranie próbek powietrza polega na ekspozycji w badanym
pomieszczeniu otwartych płytek Petriego z podłożem agarowym przez
określony czas (zwykle 30 minut, rzadziej do 4 godzin). Płytki po ekspozycji
są przechowywane w temp. 1-8°C do czasu poddania właściwej inkubacji
tego samego dnia lub najpóźniej w ciągu 24 godzin od pobrania. Inkubację
należy prowadzić w temp. 30±1°C przez 3 dni w przypadku bakterii
oraz 22,5±2,5°C przez 5 dni w przypadku drożdżaków i pleśni. Wynik
jest obliczany na podstawie liczby kolonii drobnoustrojów uzyskanych
w określonym czasie. Należy kontrolować czynniki mające wpływ na wynik,
jak ruchy powietrza i aktywność ludzi.
• Aktywne pobieranie próbek powietrza wykonuje się przy pomocy
automatycznych próbników, które pobierają określoną objętość
powietrza bezpośrednio na podłoże agarowe lub na filtr. Na podstawie
liczby uzyskanych kolonii można dokładnie obliczyć liczbę komórek
drobnoustrojów na jednostkę objętości powietrza. Użycie próbnika
zapewnia standaryzację badań i śledzenie procesu uzyskiwania wyników.
32
Można oceniać liczbę komórek drobnoustrojów
ogółem i/lub stosując odpowiednie selektywne
podłoża, liczbę drożdżaków i pleśni.
Próbnik powietrza (SAMPL’AIR™)
Normy czystości mikrobiologicznej
powietrza
Nie ma standardowych zaakceptowanych norm dla próbek powietrza
pobieranych metodą aktywną. CDC rekomenduje badanie liczby zarodników
grzybów pleśniowych podczas kontroli występowania aspergillozy.
Pobieranie próbek zaleca się także do oceny skuteczności filtracji powietrza.
Ramka poniżej zawiera konsensus określający wartości satysfakcjonujące.
Odbiegające od nich wyniki wymagają podjęcia natychmiastowych działań.
JAKOŚC POWIETRZA POLA OPERACYJNEGO
(AKTYWNE POBIERANIE PRÓBEK)
Badanie wykonane przy uruchamianiu
lub po remoncie bloku operacyjnego
• Liczba kolonii drobnoustrojów tlenowych < 10 cfu / m3
Badanie w pustych salach
• Liczba kolonii drobnoustrojów tlenowych < 35 cfu / m3
Badanie podczas operacji chrurgicznych
• Liczba kolonii drobnoustrojów tlenowych < 180 cfu / m3
Badanie czystości wody
W większości krajów ustawowe wymagania dotyczące badania jakości wody
dotyczą jedynie wody pitnej. Jednakże, wytyczne na temat badania wody
znajdują się w niektórych dokumentach dotyczących dobrej praktyki:
• Ogólne wytyczne (CDC, 2003; Tacconelli et al, 2014);
• Kontrola Legionella (UK Health and Safety Executive, 2000; World Health Organization, 2007);
• Woda do płukania endoskopów (Department of Health, England, 2013; BSG Report,
2014; ASG & SHEA, 2011);
• Baseny rekreacyjne i baseny do hydroterapii (WHO, 2006; HPE, 2008; Pool Water
Treatment Advisory Group, 2009);
• Woda do dializ (UK Renal Association, 2009).
Wszystkie informacje zostały zebrane przez Public Health England (PHE, Agencja
wykonawcza Ministerstwa Zdrowia UK, 2013).
33
Próbki wody należy pobrać aseptycznie, do jałowych butelek. Zwykle w trakcie
badania do próbki wody dodaje się czynnik neutralizujący działanie środków
dezynfekcyjnych (włącznie ze związkami chloru), które mogłyby zahamować
wzrost drobnoustrojów obecnych w próbce. Neutralizator należy dobrać
odpowiednio do używanego preparatu dezynfekcyjnego i wykonać badanie
wg szczegółowych rekomendacji.
Pobieranie próbek wody
(należy zapoznać się z wytycznymi zawartymi w dokumentach wymienionych powyżej)
Woda z kranu
• Badanie jakości wody przepływającej przez kran: kran przed pobraniem
próbki wody nie powinien być czyszczony ani dezynfekowany; należy
pobrać pierwszą porcję wody.
• Badanie jakości wody przed kranem: należy wyczyścić i zdezynfekować
kran roztworem podchlorynu sodu (1% roztwór chloru aktywnego) i odkręcić
wodę na 2-3 minuty przed pobraniem próbki. Próbkę pobrać aseptycznie
do jałowej butelki o pojemności 1000 lub 500 ml, zawierającej neutralizator
(20 mg/l tiosiarczanu sodu).
Baseny do hydroterapii
Zwykle pobiera się próbkę wody (lub kilka próbek z dużego basenu)
w miejscu, gdzie ruch wody jest najmniejszy, jak najdalej od dopływu i odpływu
wody. Próbki wody należy także pobrać ze zbiornika przelewowego i z filtra
oraz pobrać wymazy z wnętrza i z tyłu każdego wpustu wody, jak również
z pokrywy basenu, jeżeli taka jest używana.
• Należy przetrzeć z zewnątrz alkoholem jałową butelkę o pojemności 500 ml,
zawierającą neutralizator (120 mg/l tiosiarczanu sodu).
• Aseptycznie otworzyć butelkę, zanurzyć w basenie i nabrać wody.
• Zamknąć butelkę i potrząsnąć, aby wymieszać neutralizator.
Jeżeli trzeba wykonać badanie w kierunku Legionella, należy w ten sam sposób
pobrać dodatkowy 1 litr wody.
Badanie wody w kierunku Legionella
UWAGA: Podczas badania wody w kierunku Legionella, należy pamiętać
o ryzyku zakażenia i stosować odpowiednie środki ochrony.
Pobieranie próbek wody jest jednym z elementów oceny ryzyka i przeglądu
całej instalacji wodnej. Wodę należy pobierać z miejsc, w których pałeczki
Legionella mogły się namnożyć, takich jak cieplejsze odcinki rur z zimną wodą,
chłodniejsze fragmenty rur z ciepłą wodą oraz z miejsc zastoju wody.
34
POBIERANIE PRÓBEK ŚRODOWISKOWYCH DO BADANIA MIKROBIOLOGICZNEGO
Woda z basenów i z kranów (próbki przed płukaniem), patrz powyżej.
Woda z pryszniców, należy pobrać 1 litr w następujący sposób:
• Przed odkręceniem kurka nastawić temperaturę na wartość środkową
w bateriach zwyczajnych lub na zazwyczaj używaną temperaturę
w bateriach termostatycznych (35˚C do 43˚C).
• Odłączyć sitko prysznica i do jałowej butelki z neutralizatorem pobrać wodę.
• Zakręcić butelkę i wymieszać wodę z neutralizatorem.
Podczas rutynowego badania wody w ramach konserwacji instalacji
wodnej i zapobiegania zakażeniom przenoszonym drogą wodną, należy
używać podłoży agarowych lub płytek dwustronnych typu „dip slides”,
umożliwiających wyhodowanie Legionella.
Woda i płyny do dializ
Próbki wody należy pobrać z miejsc, gdzie możliwe jest największe stężenie
bakterii, tj. próbkę wody powracającej z pętli dystrybucji oraz po filtracji
końcowej. W ramach kontroli sanitarnej należy zbadać także próbkę wody
surowej przed zbiornikiem oraz próbki z urządzeń po różnych etapach
uzdatniania wody: za kolejnymi filtrami, po zmiękczaczu oraz za układem
odwróconej osmozy. Jeżeli próbka wody jest pobierana z kranu używanego
wyłącznie do tego celu, należy zdezynfekować jego wylot, jak opisano
powyżej. Próbki należy pobierać aseptycznie, do jałowych, apirogennych
butelek.
Woda do płukania automatycznej myjni-dezynfektora AWD
Do badania na obecność bakterii, łącznie z mykobakteriami, należy
aseptycznie pobrać z odpowiedniego portu dwie próbki wody, po 100 ml,
używanej do końcowego płukania podczas ostatniego cyklu.
Postępowanie z próbkami wody
Próbki wody, poza próbkami w kierunku Legionella, należy przed
wysłaniem do laboratorium przechowywać w temp. 1-8°C, wysłać je najlepiej
tego samego dnia, lecz nie później niż 24 godziny od pobrania.
Próbki wody do badania w kierunku Legionella należy przechowywać
w temperaturze otoczenia (około 20˚C), w ciemności i dostarczyć do
laboratorium jak najszybciej, najlepiej tego samego dnia, lecz nie później niż
w ciągu 24 godzin.
Ilościowe badanie wody wykonuje się zwykle metodą filtracji określonej
objętości wody przez filtry o średnicy porów <0,45 µm. Filtry umieszcza się na
odpowiednich selektywnych i nieselektywnych podłożach agarowych, które
inkubuje się w temp. 28-32˚C. Uzyskane kolonie są zliczane po inkubacji przez
48 godzin, a także po 5 dniach. Test wykonuje się w duplikacie.
Kwartalne badania wody do płukania z myjni AWD w kierunku mykobakterii
wykonywane są podobnie metodą filtracji, przy czym inkubacja podłoży
wzrostowych trwa do 28 dni.
35
Normy czystości mikrobiologicznej wody
Obecność drobnoustrojów w wodzie w liczbie nie przekraczającej normy nie
wymaga podejmowania żadnych działań.
Woda z basenów do hydroterapii
Badana co tydzień
• E. coli
• Bakterie typu coli w 37°C
• Pseudomonas aeruginosa
• Bakterie tlenowe ogółem
0 cfu / 100 mL
0 cfu / 100 mL
0 cfu / 100 mL
0-10 cfu / mL
Woda wodociągowa w kierunku Legionella
Badana w ramach programu kontroli i zapobiegania zakażeniom
oraz podczas podejrzenia epidemii
• Legionella spp.
0-100 cfu / L
Woda z kranu w oddziałach pacjentów z grup ryzyka
Badana w ramach programu kontroli i zapobiegania zakażeniom
oraz podczas podejrzenia epidemii
• Pseudomonas aeruginosa
i inne gatunki Pseudomonas
0 cfu / 100 mL
Płyn dializacyjny i woda używana do przygotowania tego płynu
Badana co miesiąc
• Bakterie tlenowe ogółem
• Endotoksyny /mL
0-50 cfu / mL
< 0,125 EU / mL
Woda do ostatniego płukania myjni - dezynfektora endoskopów
Badana co miesiąc
• Bakterie tlenowe ogółem
• Endotoksyny /mL
Badana co tydzień
< 10 cfu / 100 mL
< 0,03 EU / mL
• Bakterie tlenowe ogółem
< 1 cfu / 100 mL
Badana kwartalnie
• Prątki saprofityczne
0 cfu / 200 mL
cfu = colony forming unit, jednostki, czyli komórki, tworzące kolonie; EU = jednostki endotoksyny
[Szczegóły na temat przekroczenia poziomów alarmowych i podejmowanych
działań dostępne w: PHE 2013]
36
Pobieranie próbek z powierzchni
Pobieranie próbek z suchych powierzchni wymaga użycia jałowego płynu
do ich zwilżenia, jak sól fizjologiczna lub zbuforowana woda peptonowa.
Należy także zastosować odpowiedni neutralizator, jeżeli na badanej
powierzchni mogą występować pozostałości środka dezynfekcyjnego.
• Ilościowe pobieranie próbek można wykonać metodą wymazów z określonej
powierzchni (przy użyciu jałowego szablonu), w wystandaryzowany sposób,
aby uzyskać porównywalne wyniki podczas badania różnych miejsc oraz
podczas badania tych samych miejsc w różnym czasie. Do badania
ilościowego służą także agarowe płytki kontaktowe.
• Jakościowe badanie próbek jest niezbędne podczas dochodzenia
epidemiologicznego i szukania źródła infekcji. Wówczas większa zbadana
powierzchnia daje większą możliwość znalezienia patogenu.
• Wymazy można pobierać wymazówkami z bawełnianym wacikiem,
a w przypadku większych powierzchni – jałową gąbką; metoda ta zapewnia
bardziej wydajny odzysk drobnoustrojów.
• Drobnoustroje zostają następnie wypłukane z wymazówki lub gąbki
do roztworu fizjologicznego i przeniesione na odpowiednie podłoże agarowe
(np. agar tryptozo-sojowy lub agar Sabouraud z chloramfenikolem).
• Po inkubacji (zwykle 30+/-1˚C przez 3 dni dla bakterii i 22,5+/-2,5˚C przez
5 dni dla grzybów pleśniowych i drożdżaków) kolonie są zliczane,
a obciążenie biologiczne obliczane jako liczba komórek (cfu) na jednostkę
powierzchni. Kolonie na płytkach kontaktowych lub dwustronnych typu „dip
slides” są bezpośrednio zliczane, a wynik obliczany podobnie, w oparciu
o powierzchnię płytki.
• Nie istnieją normy zanieczyszczenia mikrobiologicznego powierzchni
w instytucjach ochrony zdrowia. Zwykle prowadzi się jakościowe badania
mikrobiologiczne w przypadku wystąpienia zakażeń epidemicznych lub
w ramach kontroli skuteczności sprzątania, lub do celów badań naukowych.
• Podczas epidemii o określonej etiologii bardzo przydatne do badania
zanieczyszczenia powierzchni są podłoża chromogenne, wybiórcze
w stosunku do poszczególnych wieloopornych patogenów szpitalnych,
jak VRE, MRSA, pałeczki ESBL+, pałeczki wytwarzające karbapenemazy,
P. aeruginosa i C. difficile.
Aplikator i płytki kontaktowe
do wystandaryzowanego pobierania próbek z powierzchni
(Count-Tact®)
37
PIŚMIENNICTWO
Ogólne
Boucher HW, Talbot GH, Bradley JS et al. Bad Bugs, No Drugs: No ESKAPE! An Update from the
Infectious Diseases Society of America. Clinical Infectious Diseases 2009; 48:1–12.
European Commission. Communication from the Commission to the European Parliament
and the Council. Action plan against the rising threats from Antimicrobial Resistance. Brussels
15th November 2011.
Centers for Disease Control and Prevention (CDC). Guidelines for Environmental Infection
Control in Health-Care Facilities. Recommendations of CDC and the Healthcare Infection Control
Practices Advisory Committee (HICPAC). MMWR 2003;52(RR10):1-42. www.cdc.gov/ncidod/hip/
enviro/guide.htm
Centers for Disease Control and Prevention (CDC). Guidelines for preventing health-careassociated pneumonia, 2003: recommendations of CDC and the Healthcare Infection Control
Practices Advisory Committee (HICPAC). MMWR 2004;53(RR03):1-36.
Global Risks 2014, Ninth Report. World Economic Forum. 2014
Nightingale F. Notes on nursing: what it is and what it is not. New York 1860. Appleton And
Company.
Tacconelli E, Cataldo MA, Dancer SJ et al. ESCMID guidelines for the management of the infection
control measures to reduce transmission of multidrug-resistant Gram-negative bacteria in hospitalized patients. Clin Microbiol Infect 2014; 20 (Suppl. 1): 1–55.
World Health Organisation (WHO). WHO Guidelines on Hand Hygiene in Health Care. First
Global Patient Safety Challenge Clean Care is Safer Care. Geneva 2009.
Powietrze
Centers for Disease Control and Prevention (CDC). Guidelines for Preventing the Transmission of
Mycobacterium tuberculosis in Health-Care Settings, 2005. MMWR 2005; 54(No. RR-17).
Centers for Disease Control and Prevention (CDC). Interim Infection Prevention and Control
Recommendations for Hospitalized Patients with Middle East Respiratory Syndrome Coronavirus
(MERS-CoV). May 2014. http://www.cdc.gov/coronavirus/mers/infection-prevention-control.html
Centers for Diseases Control and Prevention (CDC). Guideline for the prevention and control
of norovirus gastroenteritis outbreaks in healthcare settings. MacCannell T, Umscheid CA, 2;
Rajender K. Agarwal RK et al. and the Healthcare Infection Control Practices Advisory Committee
(HICPAC).410:21 27/10/2014. http://www.cdc.gov/hicpac/pdf/norovirus/Norovirus-Guideline-2011.pdf
38
Department of Health (England. Health Technical Memorandum HTM 03-01). Heating and
ventilation systems: specialised ventilation for healthcare premises.
Department of Health, Estates and Facilities (England). Health Building Note HBN 00-09. Infection
control in the built environment. 2013.
Dharan S, Pittet D. Environmental controls in operating theatres. J Hosp Infect. 2002 Jun;
51(2):79-84.
French GL. Prevention of hospital acquired Aspergillosis infection during demolition and building
work. Hospital Engineering and Facilities Management 2005; 2:31-36.
Hannan MM, Azadian BS, Gazzard BG et al. Hospital infection control in an era of HIV infection
and multi-drug resistant tuberculosis. J Hosp Infect 2000;44:5-11.
Harris JP, Lopman BA, Cooper BS, et al. Does spatial proximity drive norovirus transmission
during outbreaks in hospitals? BMJ Open 2013;3:e003060 doi:10.1136/bmjopen-2013-003060
Health and Safety Executive UK (HSE). Respiratory protective equipment at work. A practical
guide. HSG53. Fourth edition, 2013.
Health and Safety Executive (UK) (HSE). Legionnaires’ disease. The control of legionella bacteria
in water systems. London, 2013.
Health Protection England. A guide to the FFP3 respirator. London, August 2013.
Hoffman PN, Williams J, Stacey AM et al. Microbiological commissioning and monitoring of
operating theater suites. A report of a working party of the Hospital Infection Society. Journal of
Hospital Infection 2002; 52:1-28.
Humphreys H. Microbes in the air - when to count! (The role of air sampling in hospitals)
[Editorial]. J. Med. Microbiol 1992; 37:81-82.
Marks PJ, Vipond IB, Carlisle D et al. Evidence for airborne transmission of Norwalk-like virus
(NLV) in a hotel restaurant. Epidemiol Infect 2000;124:481–487.
Marks PJ, Vipond IB, Regan FM, Wedgwood K, Fey RE, Caul EO. A school outbreak of Norwalklike virus: evidence for airborne transmission. Epidemiol Infect. 2003;131:727-736.
McDonald LC, Walker M, Carson L et al. Outbreak of Acinetobacter spp. bloodstream infections
in a nursery associated with contaminated aerosols and air conditioners. Pediatr Infect Dis J.
1998; 17:716-22.
Munoz-Price LS, Fajardo-Aquino Y, Arheart KL, Cleary T, DePascale D, Pizano L, Namias N,
Rivera JI, O’Hara JA, Doi Y. Aerosolization of Acinetobacter baumannii in a trauma ICU. Crit Care
Med. 2013; 41:1915-8.
National Institute for Health and Care Excellence. Tuberculosis: Clinical diagnosis and management
of tuberculosis, and measures for its prevention and control. NICE guidelines [CG117]. March 2011.
Otter JA, French GL. Survival of nosocomial bacteria and spores on surfaces and inactivation by
hydrogen peroxide vapor. J Clin Microbiol 2009; 47:205-7.
Peleg AY, Seifert H, Paterson DL. Acinetobacter baumannii: emergence of a successful pathogen.
Clin Microbiol Rev 2008; 21: 538–582.
Public Health England. Middle East respiratory syndrome coronavirus (MERS-CoV). Infection
Control Advice. 28 June 2013.
Shaw K. The 2003 SARS outbreak and its impact on infection control practices. Public Health
2006; 120:8-14.
World Health Organization. Essential environmental health standards in health care. Adams J,
Bartram J, Chartier Y (Eds). Geneva 2008.
39
Woda
Berrouane, YF et al. Outbreak of severe Pseudomonas aeruginosa infections caused by a
contaminated drain in a whirlpool bathtub. Clinical Infectious Diseases 2000; 31:1331-7.
Centers for Disease Control and Prevention (CDC). Outbreaks of postoperative bacterial
endophthalmitis caused by intrinsically contaminated ophthalmic solutions—Thailand, 1992, and
Canada, 1993. MMWR Morb Mortal Wkly Rep 1996;45:491–494.
Department of Health Estates and Facilities Division (2006). The control of Legionella, hygiene,
safe hot water, cold water and drinking water systems. Department of Health, HTM 04-01.
Department of Health England. Decontamination of flexible endoscopes: Testing methods.
London 2013.
Department of Health England. Decontamination of flexible endoscopes: Operational management.
London 2013.
Department of Health (England). Health Technical Memorandum 04-01 Addendum:
Pseudomonas aeruginosa – advice for augmented care units. London, 2013.
Department of Health (England). Water sources and potential Pseudomonas aeruginosa
contamination of taps and water systems. Advice for augmented care units. London, March 2012.
Health and Safety Executive (UK). Legionnaires’ disease. The control of legionella bacteria
in water systems. Approved Code of Practice and guidance on regulations. L8 (Fourth edition)
Published 2013.
Health Protection Agency (England) (HPA). Investigation of Pseudomonas aeruginosa on
biofilms in water tap assemblies from neonatal units in Northern Ireland. London, May 2012.
Health Protection Agency (England) (HPE). Management of spa pools: controlling the risks of
infection. London, 2008.
Kelsey M. Pseudomonas in augmented care: should we worry? J Antimicrob Chemother 2013;
68(12):2697-700.
Lalitha L, Das M, Purva PS et al. Postoperative endophthalmitis due to Burkholderia cepacia
complex from contaminated anaesthetic eye drops. Br J Ophthalmol 98(11):1498-502.
Medical Devices Agency. Device Bulletin DB(NI)2002/05. Decontamination of endoscopes.
December 2002.
National Institute for Health and Clinical Excellence (NICE). Clinical guideline CG93. Donor milk
banks: the operation of donor milk bank services. London, February 2010.
Public Health England (PHE). Examining food, water and environmental samples from healthcare
environments . Microbiological Guidelines: London, June 2013.
Report of a working party of the British Society of Gastroenterology (BSG) Endoscopy
Committee. BSG guidance on for decontamination of equipment for gastrointestinal endoscopy.
June 2014.
The American Society for Gastrointestinal Endoscopy and the Society for Healthcare Epidemiology
of America. Multisociety guideline on reprocessing flexible gastrointestinal endoscopes: 2011.
Gastrointestinal Endoscopy 2011;73:1075-1084.
UK Renal Association. 2009. Renal Association Guidelines – Haemodialysis. Available at: http://
www.renal.org.
World Health Organization (WHO). Water Safety in Buildings. Geneva, March 2011.
World Health Organization (WHO). Legionella and the prevention of legionellosis. Geneva 2007.
Powierzchnie suche
Boyce JM. Environmental contamination makes an important contribution to hospital infection.
J Hosp Infect 2007; 65(2):50–54.
Carling P. Methods for assessing the adequacy of practice and improving room disinfection.
American Journal of Infection Control 2013; 41:S20-S25.
Donskey CJ. Does improving surface cleaning and disinfection reduce health care-associated
infections? American Journal of Infection Control 2013;41:S12-S19.
Gebel J, Exner M, French G et al. The role of surface disinfection in infection prevention. GMS
Hygiene and Infection Control 2013; 8:1-12.
40
PIŚMIENNICTWO
Guh A, Carling P and the Environmental Evaluation Workgroup. Options for evaluating environmental cleaning. http://www.cdc.gov/HAI/pdfs/toolkits/Environ- Cleaning-Eval-Toolkit12-2-2010.pdf.
Kramer A, Schwebke I, Kampf G. How long do nosocomial pathogens persist on inanimate
surfaces? A systematic review. BMC Infect Dis 2006; 6:130.
Mitchell BG, Digney W, Locket P, Dancer SJ. Controlling methicillin resistant Staphylococcus
aureus (MRSA) in a hospital and the role of hydrogen peroxide decontamination: an interrupted
time series analysis. BMJ Open 2014; 4:e004522.
Morgan DJ, Rogawski E, Thom KA, Johnson JK, Perencevich EN, Shardell M, Leekha S, Harris
AD. Transfer of multidrug-resistant bacteria to healthcare workers’ gloves and gowns after patient
contact increases with environmental contamination. Crit Care Med. 2012;40:1045-51.
Munoz-Price LS, Namias N, Cleary T, Fajardo-Aquino Y, Depascale D, Arheart KL, Rivera JI, Doi
Y. Acinetobacter baumannii: association between environmental contamination of patient rooms
and occupant status. Infect Control Hosp Epidemiol. 2013;34:517-20
Mulvey D, Redding P, Robertson C, Woodall C, Kingsmore P, Bedwell D, Dancer SJ. Finding a
benchmark for monitoring hospital cleanliness. J Hosp Infect 2011; 77:25-30.
Otter JA, Yezli S, French GL. The role played by contaminated surfaces in the transmission of
nosocomial pathogens. Infect Control Hosp Epidemiol 2011; 32:687–699.
Otter JA, Yezli S, Perl TM, Barbut F, French GL. The role of ‘no-touch’ automated room disinfection systems in infection prevention and control. J Hosp Infect 2013; 83:1–13.
Otter JA, Yezli S, Salkeld JAG, French GL. Evidence that contaminated surfaces contribute to
the transmission of hospital pathogens and an overview of strategies to address contaminated
surfaces in hospital settings. Am J Infect Control 2013; 41 (suppl 5):S6–S11.
Passaretti CL, Otter JO, Reich NG, Myers J, Shepard J, Ross T, Carroll KC, Lipsett P, Perl TM.
An evaluation of environmental decontamination with hydrogen peroxide vapor for reducing
the risk of patient acquisition of multidrug-resistant organisms. Clinical Infectious Diseases 2013;
56(1):27–35.
Ruden H, Daschner F. Should we routinely disinfect floors? J. Hosp. Infect. 2002; 51:309.
Rutala WA, Weber DJ and the Healthcare Infection Control Practices Advisory Committee (HICPAC).
CDC Guideline for Disinfection and Sterilization in Healthcare Facilities, 2008.
Rutala WA, Weber DJ. Should we routinely disinfect floors? Reply to Professor F. Daschner.
J. Hosp. Infect. 2002; 51:309-11.
Salgado CD, Sepkowitz KA, John JF, et al. Copper surfaces reduced the rate of healthcareacquired infections in the intensive care unit. Infect Control Hosp Epidemiol. 2013; 34:479–486.
Sehulster LM, Chinn RYW, Arduino MJ, Carpenter J, Donlan R, Ashford D, Besser R, Fields B,
McNeil MM, Whitney C, Wong S, Juranek D, Cleveland J. Guidelines for environmental infection
control in health-care facilities. Recommendations from CDC and the Healthcare Infection Control
Practices Advisory Committee (HICPAC). Chicago IL; American Society for Healthcare Engineering/
American Hospital Association 2004.
Weber DJ, Anderson D, Rutala WA. The Role of the Surface Environment in Healthcare-Associated
Infections. Curr Opin Infect Dis. 2013; 26(4):338-344.
Weber DJ, Rutala WA, Miller MB, et al. Role of hospital surfaces in the transmission of emerging
healthcare-associated pathogens: norovirus, Clostridium difficile, and Acinetobacter species.
Am J Infect Control 2010; 38:S25–S33.
Rekomendacje pobierania próbek na badania bakteriologiczne
Department of Health England. Decontamination of flexible endoscopes: Testing methods.
London 2013.
Tacconelli E, Cataldo MA, Dancer SJ et al. ESCMID guidelines for the management of the infection
control measures to reduce transmission of multidrug-resistant Gram-negative bacteria in
hospitalized patients. Clin Microbiol Infect 2014; 20 (Suppl. 1): 1–55.
UK Renal Association. 2009. Renal Association Guidelines – Haemodialysis. Available at:
http://www.renal.org.
World Health Organisation (WHO). Guidelines for safe recreational water environments.
Volume 2: Swimming pools and similar environments. Geneva 2006.
World Health Organization (WHO). Legionella and the prevention of legionellosis. Geneva 2007.
41
07-15 / 9301112/010/PL/A / Niniejszy dokument nie ma mocy prawnej. bioMérieux zastrzega sobie prawo wprowadzenia zmian w specyfikacjach bez wcześniejszego powiadomienia. / BIOMERIEUX, niebieskie logo, COUNT-TACT i SAMPL’AIR są używanymi, zarejestrowanymi i/lub będącymi w trakcie rejestracji
znakami towarowymi należącymi do bioMérieux S.A. lub jednego z jego podmiotów zależnych lub jednej z jego firm / bioMérieux S.A. 673 620 399 RCS Lyon / Wydrukowano we Francji / théra • RCS Lyon B 398 160 242.
Other educational booklets are available.
Consult your local bioMérieux representative.
Więcej informacji na temat protokołów monitorowania
środowiska na www.biomerieux-culturemedia.com
™
bioMérieux Polska Sp. z o.o.
ul. Gen. Józefa Zajaczka 9
01-518 Warszawa
Tel. : +48 22 569 85 00
Fax : +48 22 569 85 54
www.biomerieux.pl
www.biomerieux.com