Chemia analityczna
Redoksymetria
Zakład Chemii Medycznej
Pomorskiego Uniwersytetu Medycznego
Miareczkowanie redoksymetryczne
Oksydymetria - miareczkowanie reduktora
utleniaczem (częstsze - utleniacz nie reaguje z
tlenem z powietrza)
Reduktometria - miareczkowanie utleniacza
reduktorem
Typy miareczkowań
bezpośrednie
manganometria
odwrotne
pośrednie
jodometria
Miareczkowanie redoksymetryczne
Podział ze względu na stosowane odczynniki
(titranty)
w procesie miareczkowania redoksymetrycznego
dochodzi do wymiany elektronów
w przypadku utleniaczy obserwujemy zmniejszenie
stopnia utlenienia danego pierwiastka, a więc
pobranie elektronów
w przypadku reduktorów obserwujemy wzrost
stopnia utlenienia związany z oddaniem elektronów
Miareczkowanie redoksymetryczne
Podczas miareczkowania zachodzi jednocześnie redukcja
i utlenianie
Punkt równoważnikowy wynika ze stężeń i stopni utlenienia
wszystkich składników reakcji
Aox + Bred
Ared + Box
np.:
Ce4+ + Fe2+
Ce3+ + Fe3+
Miareczkowanie redoksymetryczne
ogólne równanie reakcji analitycznej redoks
sprzężona reakcja redoks zapisana w postaci:
molowo-równoważnych ilości reagentów
jednoelektronowa
lub równoważna jednoelektronowej
tylko dwaj określeni partnerzy tej samej reakcji
Miareczkowanie redoksymetryczne
np. manganometryczne oznaczanie żelaza
10 FeSO4 + 2 KMnO4+ 8 H2SO4
5Fe2(SO4)3 + 2MnSO4+ K2SO4+ 8H2O
+2
-1/5
bilans ładunku jonów
+8/5
+3
+2/5 + 4/5
Potencjał redoks
reakcjom redoks towarzyszy ruch elektronów
czyli prąd elektryczny
aby mógł popłynąć prąd elektryczny musi istnieć
różnica potencjałów
właściwości układu redoks charakteryzuje pewien
potencjał elektryczny zwany potencjałem redoks
Potencjał redoks
Potencjał termodynamiczny (normalny) reakcji połówkowej
opisuje równanie Nernsta
Potencjał redoks
Po podstawieniu stałych, zamianie ln na lg i dla t=25oC i
zamianie aktywności na stężenia potencjał normalny może
być wyrażony potencjałem formalnym (rzeczywistym w
danym układzie)
dla autl= ared potencjał normalny danego układu redoks
równy jest potencjałowi zerowemu
Miareczkowanie
redoksymetryczne - bezpośrednie
Bezpośrednie
manganometria
Mn7+ Mn6+, Mn4+, Mn2+w zależności od pH
cerometria
Ce4+
Ce3+
chromianometria
roztwór K2Cr2O7
Cr6+
bromianometria
roztwór KBrO3 - Br5+
Cr3+
Br-
jodometria
mianowany roztwór jodu -
I2o
2I-
Miareczkowanie
redoksymetryczne - pośrednie
jodometria
miareczkowanie wydzielonego jodu
titrant -tiosiarczan sodu Na2S2O3
stosowana dla analitów o wyższym potencjale
utleniającym niż I2/2I-
Wskaźniki redoksometryczne
Dzielimy je na:
klasyczne wskaźniki redox (zmieniają barwę w
zależności od potencjału układu)
wskaźniki specyficzne (reagują ze składnikami
reakcji redox)
Wskaźniki redoksometryczne
Zasada działania wskaźników redoksometrycznych
wskaźniki potencjometryczne (za pomocą elektrod
jonoselektywnych)
nadmiar titrantu (np. manganometria)
wskaźnik jodoskrobiowy - uniwersalny w jodometrii
wskaźniki wizualne:
jednobarwne – zanika lub pojawia się w PK
dwubarwne – pojawienie się nowej barwy na tle poprzedniej
wskaźniki nieodwracalne – np. oranż metylowy-utleniony jest
bezbarwny
Wskaźniki redoksometryczne
Dobór wskaźnika redoks dwubarwnego
Potencjał redoks wskaźnika
Trzy zakresy barwy:
barwa pierwotna
barwa przejściowa
barwa nowa
Wskaźniki redoksometryczne
Przyjęto, że aby zauważyć zmianę barwy musi
nastąpić 10% konwersja jednej formy w drugą.
dla oksydymetrii
lub
dla reduktometrii
zakres zmiany barwy to E=+0,059/n
Wskaźniki redoksometryczne
Przykłady wskaźników redoksometrycznych
jednobarwne
pochodne difenyloaminy –difenylobenzydyna
(trudno rozpuszczalne w wodzie)
sól sodowa lub barowa kwasu N,N'difenylobenzydynosulfonowego (łatwo
rozpuszczalna w wodzie)
postać zredukowana - bezbarwna
postać utleniona - fioletowa
Wskaźniki redoksometryczne
difenyloamina
Wskaźniki redoksometryczne
Kwas difenylobenzydynosulfonowy forma
zredukowana
Kwas difenylobenzydynosulfonowy forma
utleniona
Specyficzne wskaźniki redoksometryczne
Nadmanganian:
silny utleniacz
własna barwa (fioletowa) jest wystarczająca, a
więc sam titrant jest wskaźnikiem
Oranż metylowy:
w miareczkowaniach bromianometrycznych, po
punkcie równoważnikowym, zaczyna wydzielać
się brom (w reakcji bromków z bromianami)
brom nieodwracalnie odbarwia wskaźnik, co jest
sygnałem końca miareczkowania
Specyficzne wskaźniki redoksometryczne
Skrobia:
skrobia + I3- = ciemnoniebieski kompleks
wskaźnik szybki, tani i łatwy w detekcji
jod jest chętnie używanym titrantem, mimo że jest
raczej słabym utleniaczem
czasami stosuje się indykator w postaci kompleksu
jodu ze skrobią (w miareczkowaniach pośrednich,
gdy titrant jest utleniaczem)
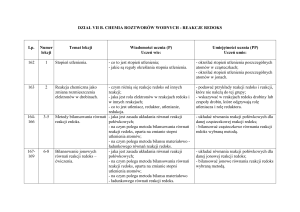
Charakterystyka
wybranych wskaźników redoks