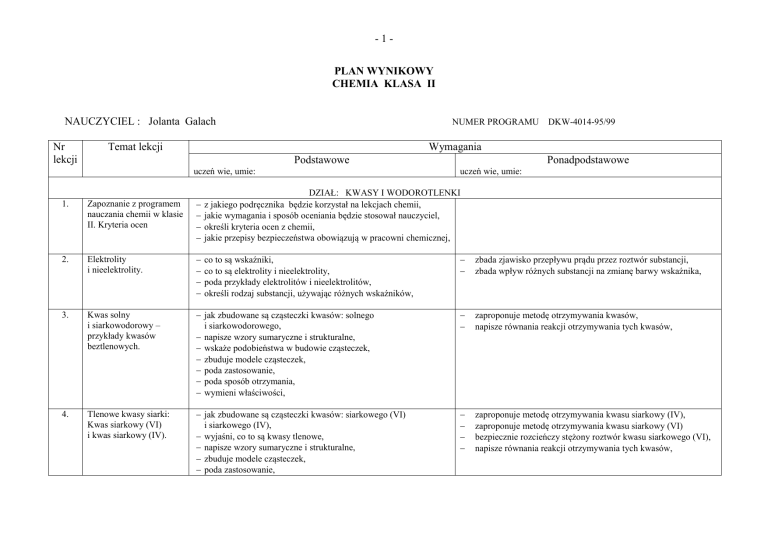
-1PLAN WYNIKOWY
CHEMIA KLASA II
NAUCZYCIEL : Jolanta Galach
Nr
lekcji
NUMER PROGRAMU
Temat lekcji
DKW-4014-95/99
Wymagania
Podstawowe
uczeń wie, umie:
Ponadpodstawowe
uczeń wie, umie:
1.
Zapoznanie z programem
nauczania chemii w klasie
II. Kryteria ocen
DZIAŁ: KWASY I WODOROTLENKI
z jakiego podręcznika będzie korzystał na lekcjach chemii,
jakie wymagania i sposób oceniania będzie stosował nauczyciel,
określi kryteria ocen z chemii,
jakie przepisy bezpieczeństwa obowiązują w pracowni chemicznej,
2.
Elektrolity
i nieelektrolity.
co to są wskaźniki,
co to są elektrolity i nieelektrolity,
poda przykłady elektrolitów i nieelektrolitów,
określi rodzaj substancji, używając różnych wskaźników,
3.
Kwas solny
i siarkowodorowy –
przykłady kwasów
beztlenowych.
4.
Tlenowe kwasy siarki:
Kwas siarkowy (VI)
i kwas siarkowy (IV).
zbada zjawisko przepływu prądu przez roztwór substancji,
zbada wpływ różnych substancji na zmianę barwy wskaźnika,
jak zbudowane są cząsteczki kwasów: solnego
i siarkowodorowego,
napisze wzory sumaryczne i strukturalne,
wskaże podobieństwa w budowie cząsteczek,
zbuduje modele cząsteczek,
poda zastosowanie,
poda sposób otrzymania,
wymieni właściwości,
zaproponuje metodę otrzymywania kwasów,
napisze równania reakcji otrzymywania tych kwasów,
jak zbudowane są cząsteczki kwasów: siarkowego (VI)
i siarkowego (IV),
wyjaśni, co to są kwasy tlenowe,
napisze wzory sumaryczne i strukturalne,
zbuduje modele cząsteczek,
poda zastosowanie,
zaproponuje metodę otrzymywania kwasu siarkowy (IV),
zaproponuje metodę otrzymywania kwasu siarkowy (VI)
bezpiecznie rozcieńczy stężony roztwór kwasu siarkowego (VI),
napisze równania reakcji otrzymywania tych kwasów,
-2 poda sposób otrzymania,
wyjaśni, co to są tlenki kwasowe,
wymieni właściwości kwasów,
5.
Kwas azotowy (V) i kwas
azotowy (III).
jak zbudowane są cząsteczki kwasów: azotowego (V)
i azotowego (III),
napisze wzory sumaryczne i strukturalne,
zbuduje modele cząsteczek,
poda zastosowanie,
poda sposób otrzymania,
wymieni właściwości,
zaproponuje metodę otrzymywania kwasu azotowego (V)
i azotowego (III),
napisze równania reakcji otrzymywania tych kwasów,
otrzyma kwas fosforowy (V),
otrzyma kwas węglowy,
zbada właściwości kwasu fosforowego (V) i węglowego,
napisze równania reakcji otrzymywania tych kwasów,
6.
Przykłady innych
kwasów: kwas fosforowy
(V) i kwas węglowy.
jak zbudowane są cząsteczki kwasów: fosforowego (V)
i węglowego,
napisze wzory sumaryczne i strukturalne,
zbuduje modele cząsteczek,
poda zastosowanie,
poda sposób otrzymania,
wymieni właściwości,
7.
Na czym polega
dysocjacja jonowa
(elektrolityczna)
kwasów?
Ćwiczenia w pisaniu
równań reakcji dysocjacji
jonowej kwasów.
dlaczego roztwory niektórych substancji przewodzą prąd
elektryczny,
jak przebiega dysocjacja elektrolityczna kwasów,
co to są jony, kationy i aniony,
co to są kationy wodoru i aniony reszty kwasowej,
napisze i odczyta równania reakcji dysocjacji kwasów /HCl, H2S,
H2SO4, H2SO3, HNO3, HNO2, H3PO4, H2CO3/,
wyjaśni przyczynę odczynu kwasowego,
Wodorotlenek sodu
i wodorotlenek potasu.
8.
9.
jak zbudowane są cząsteczki wodorotlenków sodu i potasu,
napisze wzory sumaryczne i strukturalne,
zbuduje modele cząsteczek,
poda zastosowanie,
poda sposób otrzymania,
wyjaśni, co to są tlenki zasadowe,
wymieni właściwości,
przeprowadzi modelowanie przebiegu reakcji dysocjacji kwasów,
napisze i odczyta równania reakcji dysocjacji stopniowej
kwasów,
napisze i odczyta równania reakcji dysocjacji dowolnego kwasu,
otrzyma zasadę sodową,
zbada właściwości zasady sodowej,
napisze równania reakcji otrzymywania zasad: sodowej
i potasowej,
-310.
Wodorotlenek wapnia.
11.
Przykłady innych
wodorotlenków.
12.
13.
14.
15.
otrzyma zasadę wapniową,
zbada jej właściwości,
napisze równania reakcji otrzymywania,
jak zbudowane są cząsteczki wodorotlenków,
napisać wzory sumaryczne i strukturalne wodorotlenków na
podstawie wartościowości metalu,
zbudować modele cząsteczek wodorotlenków,
jaka jest różnica między wodorotlenkiem a zasadą,
jak korzystać z tabeli rozpuszczalności wodorotlenków,
podać przykłady zasad i wodorotlenków, analizując tabelę
rozpuszczalności,
zaproponować, jak można otrzymać wodorotlenek miedzi (II)
i żelaza (III),
zapisać równania reakcji otrzymywania wodorotlenku miedzi (II)
i żelaza (III),
podaje przykłady wodorotlenków mających zastosowanie
w gospodarce człowieka,
Na czym polega
dysocjacja jonowa
(elektrolityczna) zasad?
Ćwiczenia w pisaniu
równań reakcji dysocjacji
jonowej zasad
Odczyn roztworu, pH.
jak przebiega dysocjacja elektrolityczna zasad,
co to są kationy metalu i aniony wodorotlenkowe,
napisze i odczyta równania reakcji dysocjacji poznanych na lekcji
zasad,
wyjaśni przyczynę odczynu zasadowego,
przeprowadzi modelowanie przebiegu reakcji dysocjacji zasad,
napisze i odczyta równania reakcji dysocjacji dowolnej zasady,
Podsumowanie
wiadomości o kwasach
i wodorotlenkach.
wskazać wzory i nazwy kwasów i wodorotlenków spośród wzorów
i nazw różnych substancji,
rozróżni kwasy tlenowe i beztlenowe,
określi sposób otrzymania kwasów tlenowych i beztlenowych,
poda różnicę między zasada a wodorotlenkiem,
określi sposoby otrzymywania zasad i wodorotlenków,
poda właściwości najważniejszych kwasów i wodorotlenków,
pisze i prawidłowo odczytuje równania reakcji dysocjacji
poznanych na lekcji kwasów i wodorotlenków,
jak zbudowana jest cząsteczka wodorotlenku wapnia,
napisze wzór sumaryczny i strukturalny,
zbuduje model cząsteczki,
poda najważniejsze właściwości,
wymieni zastosowanie,
poda sposób otrzymywania,
co jest przyczyną odczynu kwasowego i zasadowego,
kiedy odczyn roztworu jest obojętny,
co to jest pH roztworu,
do czego służy skala pH,
określić pH za pomocą papierka wskaźnikowego,
doświadczalnie sprawdzić odczyn roztworu,
zaproponować sposób zmiany odczynu roztworu,
otrzymać roztwór obojętny,
napisać jonowo równania reakcji zobojętniania.
wykaże związek między budową cząsteczek kwasów
a podobieństwem w ich właściwościach,
wykaże związek między budową cząsteczek zasad
a podobieństwem w ich właściwościach,
napisze i prawidłowo odczyta równania reakcji otrzymywania
kwasów i wodorotlenków,
pisze i prawidłowo odczytuje równania reakcji dysocjacji
dowolnych kwasów i wodorotlenków,
wyjaśnia zależność między liczbą jonów H+ i OH- w roztworze a
-4-
jego odczynem i pH,
wskaże tlenki kwasowe i zasadowe spośród tlenków różnych
pierwiastków,
określi substancje na podstawie analizy chemografu,
ustala wzór sumaryczny i strukturalny soli na podstawie nazwy ,
zapisze i odczyta równania dysocjacji jonowej soli znanych
kwasów,
zapisze i odczyta równania dysocjacji kilku cząsteczek soli,
obliczy ilość jonów wchodzących w skład jednej i kilku
cząsteczek soli,
wyjaśni dlaczego sole są elektrolitami,
16.
„Kwasy i wodorotlenki” –
sprawdzenie wiadomości.
17.
Budowa cząsteczki
i nazewnictwo soli.
18.
Dysocjacja jonowa
(elektrolityczna) soli.
19.
Reakcja zobojętniania
jako jeden ze sposóbów
otrzymywania soli.
Test sprawdzający wiadomości i umiejętności.
DZIAŁ: SOLE
jak zbudowana jest cząsteczka soli,
jaka jest rola wartościowości przy poprawnym zapisie wzoru
sumarycznego soli,
jak tworzy się nazwy soli,
ustali wzór sumaryczny i strukturalny soli kwasów /HCl, H2S,
H2SO4, H2SO3, HNO3, HNO2, H3PO4, H2CO3 / na podstawie nazwy,
zapisuje ogólny wzór soli,
poda definicję soli ze względu na dysocjację jonową,
wie jak przebiega dysocjacja jonowa soli,
wie jakie jony powstają w czasie dysocjacji soli w wodzie,
napisze i odczyta równania reakcji dysocjacji soli kwasów /HCl,
H2S, H2SO4, H2SO3, HNO3, HNO2, H3PO4, H2CO3,
zdefiniuje pojęcie reakcja zobojętniania,
wie na czym polega reakcja zobojętniania,
poda substraty i produkty reakcji zobojętniania,
zapisze w formie cząsteczkowej równania reakcji zachodzące
kwasem /HCl, H2S, H2SO4, H2SO3, HNO3, HNO2, H3PO4, H2CO3/
a zasadą /NaOH, KOH, Mg(OH)2, Ca(OH)2/,
20.
Otrzymywanie soli w
reakcji metali z kwasami.
poda kolejną metodę otrzymywania soli (działanie kwasem na
metale,
wymieni substraty i produkty tej reakcji,
wyjaśni jaka jest rola wskaźnika w reakcji zobojętniania,
czym się różnią: cząsteczkowy, jonowy i jonowy skrócony zapis
równania reakcji,
zaproponuje sposób przeprowadzenia i przeprowadzi reakcję
zobojętniania,
napisze przebieg reakcji cząsteczkowo, jonowo i jonowo w
sposób skrócony,
odczyta zapisane w formie cząsteczkowej i jonowej równania
reakcji,
zapisze w formie cząsteczkowej i jonowej równanie reakcji
otrzymywania soli w wyniku działania znanym kwasem na metal
aktywny,
-5-
21.
22.
23.
Otrzymywanie soli
w wyniku reakcji tlenków
metali z kwasami.
Inne metody
otrzymywania soli.
Otrzymywanie soli trudno
rozpuszczalnych.
wie co to jest szereg aktywności metali,
zapisze w formie cząsteczkowej równania reakcji zachodzące
pomiędzy kwasem /HCl, H2S, H2SO4, H2SO3, HNO3, HNO2,
H3PO4, H2CO3/ i metalem aktywnym,
odczyta zapisane równanie reakcji,
przeprowadzi reakcję metalu aktywnego z kwasem,
zidentyfikuje gazowy produkt tej reakcji,
korzysta z szeregu aktywności metali,
przewidzi, czy zajdzie reakcja między kwasem a danym metalem,
poda kolejną metodę otrzymywania soli (działanie kwasu na tlenek
metalu),
wymieni substraty i produkty tej reakcji,
zapisze w formie cząsteczkowej równania reakcji zachodzące
pomiędzy kwasem /HCl, H2S, H2SO4, H2SO3, HNO3, HNO2,
H3PO4, H2CO3/ i tlenkiem metalu /Cao, MgO, CuO/,
zapisze w formie cząsteczkowej i jonowej równanie reakcji
otrzymywania soli w wyniku reakcji kwasu z niektórymi
tlenkami metali,
odczyta zapisane równanie reakcji,
zaproponuje i przeprowadzi reakcję tlenków metali z kwasami,
zapisze i odczyta równanie reakcji tlenku wapnia z dwutlenkiem
węgla,
wie, że sole powstają w wyniku reakcji substancji o charakterze
kwasowym z substancjami o charakterze zasadowym,
wyjaśni, co to są sole trudno rozpuszczalne,
wyjaśni jak powstają sole trudno rozpuszczalne,
korzystając z tabeli rozpuszczalności:
poda nazwy soli dobrze i trudno rozpuszczalnych w wodzie,
określi substancje, których roztwory należy zmieszać, aby
otrzymać osady soli trudno rozpuszczalnych w wodzie,
24.
Elektroliza wodnych
roztworów soli.
na czym polega elektroliza,
co to są: katoda i anoda,
na czym polegają reakcje elektrodowe,
określi zastosowanie procesu elektrolizy,
wie jak przebiega reakcja bezwodników kwasowych z tlenkami
zasadowymi,
wie jak przebiega reakcja zasad z bezwodnikami kwasowymi,
wie jak przebiega reakcja metali z niemetalami,
zapisze i odczyta równania reakcji otrzymywania soli poznanymi
metodami,
korzystając z tabeli rozpuszczalności poda wzory sumaryczne
soli dobrze i trudno rozpuszczalnych w wodzie,
napisze równania reakcji powstawania soli trudno
rozpuszczalnych cząsteczkowo, jonowo i jonowo w sposób
skrócony,
zaproponuje i przeprowadzi reakcje tworzenia soli trudno
rozpuszczalnej,
określi zastosowanie reakcji strąceniowych,
na podstawie tabeli rozpuszczalności przewidzi przebieg reakcji
soli z kwasem, zasadą lub inną solą,
zaproponuje, jakich odczynników należy użyć do wytrącenia
danej soli,
określi produkty elektrolizy roztworu chlorku miedzi (II),
napisze równania reakcji elektrodowych,
-625.
Sole w życiu codziennym.
poda przykłady praktycznego wykorzystania soli w życiu
codziennym,
poda i wyjaśni przykłady szkodliwego działania soli na człowieka
i jego środowisko,
26.
Ćwiczenia w pisaniu
równań reakcji
otrzymywania soli.
Podsumowanie
wiadomości o solach.
pisze i odczytuje równania dysocjacji jonowej soli,
pisze równania reakcji zobojętniania i strąceniowych w postaci
cząsteczkowej, jonowej i jonowej skróconej,
potrafi przewidzieć przebieg reakcji soli z kwasem, zasadą lub
inna solą,
28.
„Sole” – sprawdzenie
wiadomości i
umiejętności.
Test sprawdzający wiadomości i umiejętności.
29.
Skład pierwiastkowy
skorupy ziemskiej.
30.
Skały wapienne – ich
skład, właściwości
i zastosowanie.
jakie właściwości charakterystyczne wykazują skały wapienne,
co jest głównym składnikiem wapieni,
co to jest : wapno palone, wapno gaszone, zaprawa murarska,
na czym polega „gaszenie” wapna palonego,
jakie jest znaczenie wapieni w budownictwie,
przeprowadzi reakcję charakterystyczną wapieni,
zapisze równanie tej reakcji,
przeprowadzi reakcje termicznego rozkładu wapieni,
przeprowadzi „gaszenie” wapna palonego,
objaśni przemiany chemiczne od skał wapiennych do zaprawy
murarskiej,
31.
Skały gipsowe – ich
skład, właściwości
i zastosowanie.
w jakich minerałach występuje siarczan (VI) wapnia,
jakie właściwości charakterystyczne wykazują skały gipsowe,
do czego służy gips,
otrzyma zaprawę gipsową,
wyjaśni, co to są hydraty,
wie, czym się różni gips krystaliczny od gipsu palonego,
napisze wzory gipsu i anhydrytu,
otrzyma gips palony,
zapisze równanie tej reakcji,
32.
Tlenek krzemu (IV), jego
odmiany i zastosowanie
w produkcji szkła.
w jakich minerałach występuje tlenek krzemu (IV),
jakie są właściwości krzemionki,
do czego służy krzemionka,
zbada właściwości krzemionki,
wyjaśni, czym się różni substancja krystaliczna od
bezpostaciowej,
27.
zna nazewnictwo i budowę cząsteczek soli,
pisze i odczytuje równania dysocjacji jonowej niektórych soli,
pisze wzory sumaryczne na podstawie nazwy soli i odwrotnie,
pisze równania reakcji otrzymywania soli trzema podstawowymi
metodami,
rozumie na czym polega proces elektrolizy soli,
DZIAŁ: SUROWCE I TWORZYWA POCHODZENIA MINERALNEGO
co to jest skorupa ziemska,
wie, w jakiej postaci występują pierwiastki na Ziemi,
jakie najważniejsze pierwiastki występują w skorupie ziemskiej,
wskaże miejsca występowania w Polsce pierwiastków w stanie
wolnym,
co to są minerały, skały, surowce mineralne,
porówna skład pierwiastkowy Ziemi, wszechświata i ciała
człowieka,
-7
wymieni rodzaje szkła,
wyjaśni istotę otrzymywania metali z rud,
zbada właściwości metali,
określi wspólne i różniące cechy metali,
wyjaśni, na czym polega korozja metali,
wyjaśni, dlaczego częściej używa się stopów niż metali czystych,
33.
Metale – występowanie w
przyrodzie, otrzymywanie
i zastosowanie.
w jakiej postaci występują metale w skorupie ziemskiej,
co to są rudy metali,
poda przykłady rud metali,
poda właściwości metali,
z czego składają się znane stopy metali: mosiądz, stal, brąz,
do czego służą stopy metali,
34.
Surowce energetyczne –
węgle kopalne, ropa
naftowa, gaz ziemny.
jakie są rodzaje węgli kopalnych,
jak powstały złoża węgli kopalnych i ropy naftowej,
jakie są właściwości fizyczne ropy naftowej,
co powstaje w wyniku destylacji ropy naftowej,
wskaże na mapie Polski złoża węgli kopalnych i ropy naftowej,
określi zastosowanie niektórych produktów ropy naftowej,
określi zastosowanie produktów ropy naftowej,
zbada właściwości fizyczne i palność ropy naftowej,
opisze sposób przeprowadzenia destylacji ropy naftowej,
35.
Węgiel kamienny jako
paliwo i jako źródło
cennych produktów.
Wie, że węgiel kamienny jest jednym z rodzajów węgli kopalnych,
Wymieni produkty suchej destylacji węgla,
Określi do czego służą niektóre produkty suchej destylacji węgla,
Wymieni pozawęglowe źródła energii,
Podsumowanie
wiadomości o surowcach
i tworzywach
pochodzenia mineralnego.
co to jest skorupa ziemska,
z czego jest zbudowana skorupa ziemska,
jaki jest udział soli w budowie skorupy ziemskiej,
odróżnić skały wapienne od innych skał,
podać zastosowanie wapieni i gipsu,
określić skład skał wapiennych i gipsowych,
określić właściwości i zastosowanie krzemionki,
określić występowanie i znaczenie metali,
określić co to są surowce energetyczne,
„Surowce i tworzywa
pochodzenia
mineralnego” –
sprawdzenie wiadomości.
Test sprawdzający wiadomości i umiejętności.
36.
37.
zaproponuje sposób przeprowadzenia suchej destylacji węgla
kamiennego,
uzasadni, dlaczego sucha destylacja węgla jest waznym procesem
przemysłowym,
wyjaśni przyczyny poszukiwania nowych źródeł energii,
oceni zalety i wady pozawęglowych źródeł energii,
przedyskutować problemy ekologiczne związane z eksploatacja
i wykorzystaniem surowców energetycznych,
wyjaśnić konieczność poszukiwania i stosowania alternatywnych
źródeł energii,
-8-