Fenotypowe typowanie ß-laktamaz enterobakterii na podstawie charakterystyki
strefy zahamowania wzrostu
Prowadzący ćwiczenia:
dr Agata Krawczyk-Balska
Wstęp:
Enterobakterie to monotypowy rząd (Enterobacteriales) i rodzina (Enterobacteriaceae)
gramujemnych, niesporulujących bakterii jelitowych o kształcie pałeczek. Komórki bakteryjne są
urzęsione, niektóre szczepy są otoczkowe. Enterobacteriaceae są względnymi beztlenowcami.
Różnicuje się je poprzez posiew szeregu izolacyjnego, wykrywając zdolność do fermentacji laktozy,
wytwarzania indolu z tryptofanu, rozkładu mocznika (test obecności ureazy), wytwarzania
siarkowodoru. Większość bakterii Gram-ujemnych wykrywanych w tlenowych hodowlach stolca
należy do rodziny Enterobacteriaceae. Większość Enterobacteriaceae stanowią wszechobecne,
niechorobotwórcze bakterie, które występują w dużych ilościach w jelicie grubym człowieka, ale
mogą znajdować się również na skórze i w ustnej części gardła oraz w wodzie. Wiele bakterii z
rodziny Enterobacteriaceae to drobnoustroje oportunistyczne, tj. zakażające osoby o osłabionym
układzie odpornościowym. W takich przypadkach Enterobacteriaceae związane są z zakażeniami
przyrannymi, zakażeniami układu moczowego, posocznicą, wtórnymi zapaleniami płuc, a także
zakażeniami szpitalnymi. Do rodziny Enterobacteriaceae należą między innymi bakterie z rodzaju:
Citrobacter, Erwinia, Escherichia, Klebsiella, Kluyvera, Proteus, Salmonella, Serratia, Shigella,
Yersinia.
Antybiotyki β-laktamowe (β-laktamy) są (dzięki szerokiemu spektrum działania wobec
bakterii gramujemnych i gramdodatnich oraz niskiemu poziomowi efektów ubocznych) jednymi z
najczęściej stosowanych w lecznictwie związków chemicznych o działaniu antybakteryjnym.
Wspólną ich cechą jest obecność w cząsteczce pierścienia β-laktamowego. W ciągu ponad 80 lat,
począwszy od wykrycia w 1929 r. penicyliny, związki te stały się najliczniejszą grupą antybiotyków.
β-laktamy podzielone są na kilka grup o odmiennej budowie strukturalnej, w której wyróżnia się
rdzeń typowy dla danej grupy i określoną liczbę różnych podstawników. Zaliczane są do nich
penicyliny, cefalosporyny, monobaktamy, karbapenemy oraz inhibitory betalaktamaz. Antybiotyki te
mają różny zakres działania przeciwbakteryjnego w zależności od przynależności do grupy.
Antybiotyki β-laktamowe łączą się z białkami PBP (ang. penicillin binding protein), co prowadzi do
utraty aktywności transpeptydazowej tych enzymów, a w efekcie do zahamowania syntezy ściany
komórkowej i śmierci komórki bakteryjnej.
Gwałtowny wzrost oporności bakterii na antybiotyki stosowane w leczeniu zakażeń, w tym
na antybiotyki β-laktamowe, które w wielu przypadkach stanowią leki pierwszego wyboru, stanowi
obecnie jeden z najpoważniejszych problemów współczesnej medycyny. Oporność bakterii na
antybiotyki ß-laktamowe może być spowodowana kilkoma niezależnymi od siebie mechanizmami.
Wyróżnia się cztery ich rodzaje: (I) mechanizmy związane z białkami wiążącymi penicylinę, (II)
zmniejszenie przepuszczalności osłon komórkowych bakterii, (III) wypompowywanie leku z
komórki bakteryjnej, (IV) wytwarzanie przez bakterie β-laktamaz.
Wydaje się, że najważniejszym mechanizmem oporności na antybiotyki β-laktamowe jest
wytwarzanie przez bakterie β-laktamaz, czyli specyficznych enzymów katalizujących hydrolizę
pierścienia β-laktamowego w cząsteczce leku. Wraz z wprowadzeniem do lecznictwa β-laktamów
pojawiły się nowe β-laktamazy (nabyte), wcześniej nieobserwowane u bakterii danego gatunku.
Obecnie znanych jest ponad 1150 ß-laktamaz, które na podstawie różnic strukturalnych dzielone są
na 4 klasy (klasyfikacja wg Ambler,1980) – do klasy A, C i D należą serynowe β-laktamazy, a do
klasy B - metalo-beta-laktamazy. Równie popularna co klasyfikacja wg Ambler jest klasyfikacja wg
Busch (1995) dzieląca te enzymy na 4 grupy (1, 2, 3, 4), dokonana w oparciu o różnice
funkcjonalne. Enzymy ESBL (ESBL, ang. extended-spectrum β-lactamase) zaliczane są do klasy A
według Amblera, grupy 2be i 2d według Bush. β-laktamazy typu ESBL inaktywują penicyliny i
1
przede wszystkim cefalosporyny I-III generacji oraz monobaktamy (aztreonam), a wykazują słabą
aktywność wobec cefamycyn i nie inaktywują karbapenemów. Ich działanie jest hamowane przez
inhibitory β-laktamaz, tj. kwas klawulanowy czy sulbaktam. Geny, które je kodują zlokalizowane są
z reguły na plazmidach koniugacyjnych, przez co ulegają szybkiemu rozprzestrzenianiu, nawet
pomiędzy szczepami należącymi do różnych gatunków. Ponadto, mogą one występować w obrębie
lub w pobliżu elementów transpozycyjnych (transpozonów, sekwencji insercyjnych), co umożliwia
ich przeniesienie pomiędzy różnymi replikonami DNA. Enzymy ESBL stanowią obecnie poważny
problem kliniczny. Wytwarzane są przede wszystkim przez szpitalne szczepy pałeczek z rodziny
Enterobacteriaceae, choć w ostatnim okresie obserwuje się je także w szczepach wywołujących
zakażenia pozaszpitalne. Identyfikowane są również u niektórych pałeczek niefermentujących,
takich jak: Pseudomonas aeruginosa, Acinetobacter baumannii i Alcaligenes xylosoxydans. βlaktamazy AmpC są enzymami zaliczanymi do klasy C według Amblera i grupy 1 według Bush. Są
to cefalosporynazy o zróżnicowanym poziomie aktywności w zależności od gatunku bakterii.
Cefalosporynazy AmpC rozkładają wszystkie penicyliny i cefalosporyny (głównie I i II generacji) z
wyjątkiem cefepimu (IV generacja cefalosporyn), nie hydrolizują aztreonamu, chociaż niektóre
mogą go wiązać. Enzymy te nie hydrolizują karbapenemów i nie są hamowane przez kwas
klawulanowy, natomiast ich aktywność jest hamowana przez β-laktamy z grupy oksacylin (np.
kloksacylinę). Metalo-beta-laktamazy (MBL) to enzymy hydrolizujące szerokie spektrum
antybiotyków β-laktamowych, w tym karbapenemy. Charakterystyczną ich cechą jest obecność jonu
cynku w centrum aktywnym. MBL zaklasyfikowano do klasy B według Amblera, grupy 3 według
Bush. Są one niewrażliwe na inhibitory β-laktamaz, natomiast ich aktywność jest hamowana przez
EDTA, co jest związane z chelatującym działaniem tego związku w stosunku do jonów metali
dwuwartościowych. MBL nie rozkładają aztreonamu. Geny kodujące MBL zlokalizowane są w
chromosomie lub plazmidach, gdzie występują w postaci kaset w integronach. Sprzyja to łatwemu
rozprzestrzenianiu się tych genów. β-laktamazy MBL występują u gramujemnych pałeczek, głównie
tlenowych, np. Stenotrophomonas maltophilia, Pseudomonas spp, Aeromonas spp. i Acinetobacter
spp., a także u niektórych z rodziny Enterobacteriaceae, np. Klebsiella spp., Enterobacter spp.,
Morganella spp. Osobną rodzinę karbapenemaz o dużym znaczeniu klinicznym stanowią
karbapenemazy KPC, zaklasyfikowane do klasy A według Amblera i grupy 2f według Bush.
Enzymy te hydrolizują karbapenemy, penicyliny, cefalosporyny oraz aztreonam, a ich aktywność
jest hamowana przez kwas klawulanowy oraz tazobaktam. β-laktamazy typu KPC wykryto m.in. w
szczepach Klebsiella spp., Enterobacter spp., Salmonella enterica, Pseudomonas aeruginosa i
Serratia spp.
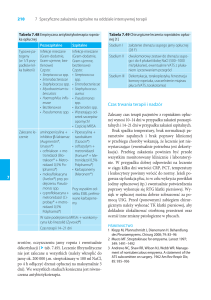
Na podstawie testu dwóch krążków, DDST (ang. double-disc synergy test) można oznaczyć
obecność różnych typów β-laktamaz w szczepach Enterobacteriaceae, a także u pałeczek
niefermentujących. W teście tym o obecności ESBL świadczą odkształcenia (powiększenia) stref
wokół krążków z cefalosporynami od strony krążka z inhibitorem betalaktamaz. Powiększenia te
mogą mieć bardzo różny kształt. Produkcję AmpC można wykazać przeprowadzając test DDST na
podłożu MHA z kloksacyliną, gdyż jak już wspomniano, kloksacylina hamuje aktywność enzymów
AmpC, wobec czego można obserwować powiększenie stref zahamowania wzrostu na podłożu z
kloksacyliną w porównaniu z rozmiarem stref na podłożu bez tego antybiotyku. Produkcję MBL
można oznaczyć przeprowadzając test DDST, używając krążków z karbapenemem i EDTA.
Odkształcenia (powiększenia) strefy wokół krążków z karbapenemem od strony krążka z EDTA
świadczą o obecności MBL w danym szczepie. Produkcję KPC można oznaczyć przeprowadzając
test DDST, używając krążków z karbapenemem oraz karbapenemem i kwasem boronowym
(inhibitor KPC). Powstanie większej strefy wokół krążków z karbapenemem i kwasem boronowym
w porównaniu z rozmiarem strefy wokół krążka z samym karbapenemem świadczy o obecności
KPC w danym szczepie.
2
Cel ćwiczenia: Przeprowadzenie typowania obecności β-laktamaz typu ESBL, AmpC, MBL oraz
KPC w izolatach gramujemnych bakterii środowiskowych opornych na cefalosporyny III generacji.
Fenotypowe typowanie β-laktamaz typu ESBL i AmpC na podstawie charakterystyki
strefy zahamowania wzrostu
1. Z jedniodniowych hodowli badanych szczepów na podłożu stałym pobrać kilka kolonii i zawiesić
w roztworze soli fizjologicznej - przygotować zawiesinę o gęstości 0.5 McFarlanda.
2. Nanieść przygotowane zawiesiny sterylną wymazówką na szalki z podłożem stałym MullerHinton (MHA) oraz podłożem stałym Muller-Hinton zawierającym oksacylinę (MHA + Oxa)
3. Wykonać tzw. Test dwóch krążków - DDST (ang. Double Disc Synergy Test). W tym celu na
przygotowane szalki nałożyć krążki antybiotykowe według schematu:
4. Szalki inkubować przez 20 godzin w temperaturze 35 oC ( 2 oC). Na podstawie rozmiaru oraz
kształtu stref zahamowania wzrosu wykonać typowanie ekspresji ß-laktamaz typu ESBL i AmpC
według schematu:
3
4
Fenotypowe typowanie karbapenemaz typu MBL oraz KPC na podstawie
charakterystyki strefy zahamowania wzrostu
1.Umieścić sterylnie puste krążki na sterylnej szalce Petriego, na każdy nanieść 10 l 0,5 M EDTA,
pH 7,3-7,5.
2.Umieścić sterylnie krążki z meropenem na sterylnej szalce petriego, na każdy nanieść 20 l kwasu
fenyloboronowego o stężeniu 15 mg/ml.
3.Oba rodzaje krążków wstawić do wysuszenia na 20 minut do 37 oC.
4.Z jedniodniowych hodowli badanych szczepów na podłożu stałym pobrać kilka kolonii i zawiesić w
roztworze soli fizjologicznej - przygotować zawiesinę o gęstości 0.5 McFarlanda.
5.Nanieść przygotowane zawiesiny sterylną wymazówką na szalki z podłożem stałym Muller-Hinton
(MHA).
6.Wykonać tzw. test dwóch krążków - DDST (ang. Double Disc Synergy Test). W tym celu na
przygotowane szalki nałożyć krążki antybiotykowe według schematu:
7. Szalki inkubować przez 20 godzin w temperaturze 35 oC ( 2 oC).
8. Wykonać pomiary średnic stref zahamowania wzrostu wokół krążków z meropenemem i
meropenemem i kwasem fenyloboronowym – o obecności karbapenemazy typu KPC
świadczy licząca 5 mm (lub większa) różnica stref zahamowania wzrostu pomiędzy tymi
krążkami.
9. Określić obecność odkształceń stref zahamowania wzrostu wokół imipenemu i/lub ceftazydymu od
strony krążka z EDTA - o obecności karbapenemazy typu MBL świadczy poszerzenie stref w
kierunku krążka z EDTA.
Opracowanie wyników:
Po przeprowadzonych ćwiczeniach należy opisać na podstawie wykonanych testów DDST
fenotyp wszystkich badanych na ćwiczeniach szczepów operując określeniami ESBL+ lub
ESBL-, AmpC+ lub AmpC-, MBL+ lub MBL- oraz KPC+ lub KPC-. Określony fenotyp
nanieść do tabeli i krótko uzasadnić
5
Nr szczepu
Fenotyp
Uzasadnienie
Literatura:
1. Ambler R.P., Coulson A.F., Frere J.M., Ghuysen J.M., Joris B., Forsman M., Levesque R.C.,
Tiraby G., Waley S.G.: A standard numbering scheme for the class A beta-lactamases.
Biochem. J. 1991, 276, 269-270.
2. Bush K., Jacoby G. A., Medeiros A.A.: A functional classification scheme for β-lactamases
and its correlation with molecular structure. Antimicrob. Agents Chemother. 1995, 39, 12111233.
3. Drieux L., Brossier F., Sougakoff W., Jarlier V.: Phenotypic detection of extended spectrum
-lactamase production in Enterobacteriaceae: review and bench guide. Clin. Microbiol. Infect.
2008, 14 (supl. 1), 90-103.
4. Franklin C., Liolios L., Peleg Y.A. Phenotypic detection of carbapenem-susceptible metallo_-lactamase-producing gram-negative bacilli in the clinical laboratory. J. Clin. Microbiol. 2006.
44,3139–3144.
5. Gniadkowski M., Żabicka D., Hryniewicz W.: Rekomendacje doboru testów do oznaczania
wrażliwosci bakterii na antybiotyki i chemioterapeutyki; Oznaczanie wrażliwosci pałeczek
Gram-ujemnych. KORLD. 2009
6. Lee K., Lim Y. S., Yong D., Yum J. H., Chong Y.: Evaluation of the Hodge test and
the imipenem-EDTA double-disk synergy test for differentiating metallo--lactamase
producing isolates of Pseudomonas spp. and Acinetobacter spp. J. Clin. Microbiol. 2003, 41,
4623-4629.
7. Markiewicz Z, Kwiatkowski A.: Bakterie, antybiotyki, lekooporność. PWN 2001
8. Tsakris A., Kristo I., Poulou A., Themeli-Digalaki K., Ikonomidis A., Petropoulou D.,
Pournaras S., Sofianou D.: Evaluation of boronic acid disk tests for differentiating KPCpossessing Klebsiella pneumoniae isolates in the clinical laboratory. J. Clin. Microbiol.2009,
47, 362-367.
6