2016-10-20
3. Cząsteczki i wiązania
Elektrony walencyjne
Wiązania jonowe i kowalencyjne
Wiązanie typu σ i π
Hybrydyzacja
Przewidywanie kształtu cząsteczek AXn
Orbitale zdelokalizowane
Cząsteczki związków organicznych
3. Cząsteczki i wiązania
1
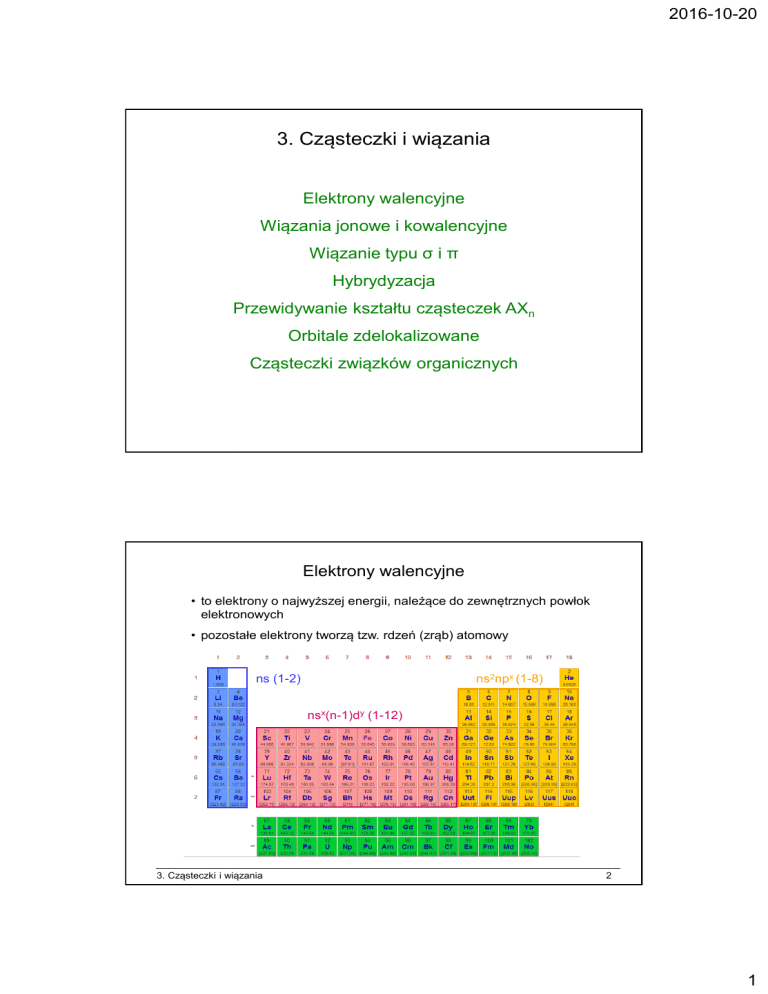
Elektrony walencyjne
• to elektrony o najwyższej energii, należące do zewnętrznych powłok
elektronowych
• pozostałe elektrony tworzą tzw. rdzeń (zrąb) atomowy
ns2npx (1-8)
ns (1-2)
nsx(n-1)dy (1-12)
3. Cząsteczki i wiązania
2
1
2016-10-20
Wiązania jonowe
Teoria Kossela: Konfiguracja elektronowa gazów szlachetnych (oktet ns 2np6
na powłoce walencyjnej) jest szczególnie trwała.
Atomy tworzące związki jonowe oddają lub przyjmują elektrony, tworząc
jony mające konfiguracje gazów szlachetnych. Jony te oddziałują ze sobą
siłami elektrostatycznymi.
Na + Cl = NaCl
[Na+][Cl-]
[11Na]: 1s22s22p63s1
[17Cl]: 1s22s22p63s23p5
Ca + O = CaO
[Ca2+][O2-]
1s22s22p63s23p64s2
[20Ca]:
[8O]: 1s22s22p4
[Na+]: 1s22s22p6 = [Ne]
[Cl-]: 1s22s22p63s23p6 = [Ar]
[Ca2+]: 1s22s22p63s23p6 = [Ar]
[O2-]: 1s22s22p6 = [Ne]
• duża różnica elektroujemności (>1,7)
• związki jonowe nie tworzą cząsteczek, tylko kryształy
3. Cząsteczki i wiązania
3
Wiązania kowalencyjne
Teoria Lewisa: Atomy, wykazujące podobną tendencję do przyjmowania
i oddawania elektronów, tworzą wiązania w wyniku uwspólnienia elektronów.
Wiązanie stanowi para elektronów, a uwspólnione elektrony są zaliczane
do powłok walencyjnych obu połączonych atomów, które dążą do
osiągnięcia oktetu s2p6 (atomy H – dubletu 1s2)
• różnica elektroujemności < 0,4 – wiązania kowalencyjne
• różnica elektroujemności > 0,4 – wiązania kowalencyjne spolaryzowane
3. Cząsteczki i wiązania
4
2
2016-10-20
Orbitale cząsteczkowe
Elektrony tworzące wiązania kowalencyjne opisujemy za pomocą orbitali
cząsteczkowych (molekularnych), które mają analogiczne właściwości jak
orbitale atomowe:
•
są określone dla współrzędnych elektronu
•
umożliwiają obliczenie gęstości prawdopodobieństwa znalezienia
elektronu
•
•
umożliwiają obliczenie energii elektronu
stosuje się do nich reguła Hunda i zakaz Pauliego
Orbitale cząsteczkowe można przedstawić jako wynik nakładania orbitali
atomowych, opisujących elektrony walencyjne, które utworzyły wiązanie.
3. Cząsteczki i wiązania
5
Wiązania σ i π – opis uproszczony
Cząsteczka H2
konfiguracja atomowa [H]: 1s1
H H
nakładanie orbitali 1s:
pojedyncze wiązanie
typu σ
orbital
cząsteczkowy
typu σ
Cząsteczka N2
konfiguracja atomowa [N]: 1s22s2 2p3
:N
nakładanie orbitali 2p:
N:
wiązanie
potrójne:
1 typu σ
2 typu π
2px
orbital
cząsteczkowy
typu σ
orbital
cząsteczkowy
typu π
2px,
2pz
3. Cząsteczki i wiązania
6
3
2016-10-20
Wiązania σ i π – opis zaawansowany
Cząsteczka O2
konfiguracja atomowa [O]: 1s22s2 2p4
: :
: :
nakładanie orbitali – dodawanie lub
odejmowanie atomowych funkcji falowych
O O
-
+
-
+
+
-
+
-
-
+
+
+
+
-
-
orbital
wiążący σ
+
orbital
antywiążący σ*
-
2px
+
-
orbital
wiążący π
-
-
2px,
2pz
+
-
-
+
orbital
antywiążący π*
3. Cząsteczki i wiązania
7
N2
σ*2px
π*2py
π*2pz
σ2px
2p
O2
2p
2p
π*2py
π2pz
π2py
π2py
π2pz
3. Cząsteczki i wiązania
2p
σ*2s
2s
σ2s
O O?
σ2px
σ*2s
2s
[N]: 1s22s22p3
π*2pz
: :
σ*2px
: :
√ :N N:
energia
Diagramy energii orbitali cząsteczkowych
2s
2s
σ2s
[O]: 1s22s22p4
8
4
2016-10-20
Cząsteczki N2 i O2 – konfiguracja elektronowa i rząd wiązania
Konfiguracja
elektronowa N2:
Konfiguracja
elektronowa O2:
KK (σ2s)2(σ*2s)2
(π2py)2(π2pz)2(σ2px)2
KK (σ2s)2(σ*2s)2
(π2py)2(π2pz)2(σ2px)2
(π*2py)1(π*2pz)1
Rząd wiązania =
½ (liczba elektronów wiążących
– liczba elektronów antywiążących)
RW = ½ (LEW-LEA)
RW (N2) = ½(8 – 2) = 3
RW (O2) = ½(8 – 4) = 2
3. Cząsteczki i wiązania
9
Struktura przestrzenna cząsteczki CH4
• wszystkie wiązania identyczne
• kształt czworościanu foremnego
Symetria CH4 nie jest zgodna
z symetrią orbitali opisujących
elektrony walencyjne atomu C
[C]: [He]2s22p2
3. Cząsteczki i wiązania
10
5
2016-10-20
Hybrydyzacja sp3
Hybrydyzacja to utworzenie nowego zespołu orbitali atomowych
poprzez wymieszanie orbitali z powłoki walencyjnej
sp3: 1 orbital 2s + 3 orbitale 2p
symetria
tetraedru
hybrydyzacja
3. Cząsteczki i wiązania
11
Porównanie cząsteczek CH4, NH3 i H2O
hybrydyzacja sp3
δ-
wypadkowy moment
dipolowy
δ-
silniejsze odpychanie
wolnych par
elektronowych
3. Cząsteczki i wiązania
12
6
2016-10-20
Hybrydyzacja sp2 i sp
sp2: 1 orbital 2s + 2 orbitale 2p
symetria
trygonalna
hybrydyzacja
sp: 1 orbital 2s + 1 orbital 2p
symetria
liniowa
hybrydyzacja
3. Cząsteczki i wiązania
13
Cząsteczka C2H4
cząsteczka płaska – hybrydyzacja sp2
czołowe nakładanie orbitali sp2 i 1sH
boczne nakładanie orbitali 2pC
12 elektronów walencyjnych:
2 opisane orbitalem wiążącym σt,t
8 opisane orbitalami wiążącymi σt,1s
2 opisane orbitalem wiążącymi π2p
3. Cząsteczki i wiązania
14
7
2016-10-20
Cząsteczka C2H2
liniowa – hybrydyzacja sp
czołowe nakładanie orbitali sp i 1sH
boczne nakładanie
orbitali 2pC
10 elektronów walencyjnych:
2 opisane orbitalem wiążącym σt,t
4 opisane orbitalami wiążącymi σt,1s
4 opisane orbitalami wiążącymi π2p
3. Cząsteczki i wiązania
15
Symetria innych orbitali zhybrydyzowanych
sp2d
sp3d
sp3d2
(kontury orbitali odsunięte od początku układu)
3. Cząsteczki i wiązania
16
8










