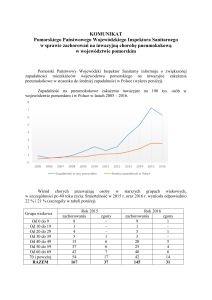
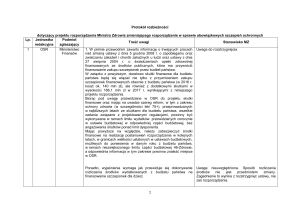
MED. DOŚW. MIKROBIOL., 2011, 63: 333 - 339
Agnieszka Kiryszewska1, Adam Antczak2
Patogeny dolnych dróg oddechowych w zakażeniach pozaszpitalnych
Zakład Mikrobiologii Lekarskiej Katedry Immunologii Klinicznej i Mikrobiologii
Uniwersytetu Medycznego w Łodzi1
Kierownik: prof. dr hab. n. med. Z.Krzemiński
Klinika Pneumonologii i Alergologii Katedry Pulmonologii i Alergologii Uniwersytetu
Medycznego w Łodzi2
Kierownik: prof. dr hab. n. med. P.Górski
Badano częstość występowania i lekowrażliwość patogenów izolowanych
z dolnych dróg oddechowych pacjentów hospitalizowanych na Oddziale
Pulmonologii i Alergologii USK nr 1 w Łodzi w latach 2006 – 2008 z powodu
ciężkiego przebiegu zakażeń dolnych dróg oddechowych. Drobnoustroje izolowane były z plwociny, bronchoaspiratu i BAL-u. Badania wykazały dużą
częstość występowania pałeczek Gram-ujemnych (28%) wśród pacjentów
chorujących na pozaszpitalne zakażenia dolnych dróg oddechowych wymagających hospitalizacji.
Zakażenia układu oddechowego są bardzo istotnym problemem w medycynie i stanowią
najczęstszą przyczynę zgonów z powodu zakażeń. Do bakterii najczęściej powodujących
pozaszpitalne infekcje dolnych dróg oddechowych zalicza się przede wszystkim Streptococcus pneumoniae, nastepnie Haemophilus influenzae, Staphylococcus aureus, Moraxella
catarhalis, Staphylococcus aureus oraz pałeczki Gram-ujemne, a także bakterie atypowe
takie jak Chlamydia pneumoniae, Mycoplasma pneumoniae, Legionella pneumophila (2,
4). W leczeniu infekcji dolnych dróg oddechowych bardzo ważną rolę odgrywa szybkie
zastosowanie skutecznego antybiotyku. Na początku stosowana jest terapia empiryczna, która
polega na wyborze antybiotyku na podstawie objawów klinicznych, lokalnych danych epidemiologicznych i analizie wyników badań kliniczznych (4). Dlatego też bardzo ważna jest
wiedza na temat drobnoustrojów najczęściej powodujących zakażenia i ich lekowrażliwości
w danej populacji, gdyż ma to kluczowe znaczenie przy wyborze właściwej terapii, a tym
samym wpływa na skuteczność leczenia. Celem pracy była analiza częstości występowania
patogenów dolnych dróg oddechowych wśród pacjentów chorujących na pozaszpitalne zakażenia dolnych dróg oddechowych i ocena lekowrażliwości wyhodowanych drobnoustrojów.
MATERIAŁ I METODY
Próbki materiału stanowiące przedmiot badań pobrano od 130 pacjentów hospitalizowanych na Oddziale Pulmonologii i Alergologii USK nr 1 w Łodzi w latach 2006 – 2008
334
A. Kiryszewska, A. Antczak
Nr 4
z powodu ciężkiego przebiegu zakażenia dolnych dróg oddechowych. Średni wiek pacjentów
to 60 lat. U 62 pacjentów zdiagnozowano zapalenie płuc, 37 pacjentów, u których zdiagnozowano POChP, przyjęto na Oddział w fazie zaostrzenia infekcyjnego, 31 pacjentów
hospitalizowanych było z powodu zaostrzenia innych przewlekłych chorób dolnych dróg
oddechowych. Od pacjentów pobrano plwocinę, bronchoaspirat i popłuczyny pęcherzykowo-oskrzelowe (BAL), a następnie wykonano badania mikrobiologiczne. Materiały te pobrane
zostały przed rozpoczęciem antybiotykoterapii. Materiały pobierane i posiewane były według
wytycznych Krajowego Konsultanta ds. mikrobiologii (13).
Plwocina odksztuszana była rano (na czczo po uprzednim wykonaniu toalety jamy ustnej
i po dokładnym wypłukaniu jej przegotowaną wodą) do jałowego pojemnika z szerokim
wlotem. Pobrana plwocina przesyłana była niezwłocznie do Pracowni Mikrobiologii, nie
dłużej niż w 3 godziny po pobraniu materiału, w celu wykonania badania mikrobiologicznego. Z pobranego materiału wykonywano rozmaz ropnej części próbki plwociny i barwiono
metodą Grama, następnie oglądano preparat pod mikroskopem i oceniano liczbę leukocytów
i komórek nabłonkowych oraz typ barwienia i morfologię komórek bakteryjnych. Plwocinę
uznawano za odpowiednią do posiewu, jeżeli spełniała następujące kryteria: leukocyty
≥ 25 i komórki nabłonkowe ≤ 10 w polu widzenia. Z pobranych plwocin, spełniających
powyższe kryteria, wykonywano posiew i prowadzono hodowlę na podłożach: Columbia
agar BioMerieux, inkubacja w temp. 37 °C w atmosferze 5% CO2 przez 48 godz. i HAEM
BioMerieux, inkubacja w temp. 37 °C w atmosferze 5% CO2 przez 48 godz.
Bronchoaspirat pobierany był podczas bronchoskopii przeprowadzanej za pomocą
bronchofiberoskopu. Aby uniknąć zanieczyszczenia drobnoustrojami flory fizjologicznej
górnych dróg oddechowych bronchoaspirat pobierano za pomocą specjalnie osłoniętej
szczoteczki. Bronchoaspirat niezwłocznie przesyłany był do Pracowni Mikrobiologii, nie
dłużej niż 3 godziny po pobraniu. Z pobranego materiału wykonywano posiew ilościowy
za pomocą jednorazowej ezy kalibrowanej o objętości 10−3 ml. Hodowla prowadzona była
na tych samych podłożach i w tych samych warunkach jak w przypadku posiewu plwociny.
BAL uzyskiwano w trakcie wykonywania bronchoskopii, podczas której dokonywano
płukania oskrzelowego za pomocą jałowego płynu Ringera. W tym celu do aparatu ssącego wprowadzano 20 ml płynu, a następnie odsysano przez podciśnienie. Postępowanie to
powtarzano pięciokrotnie i w sumie wprowadzano 100 ml płynu, a uzyskiwano 40-70 ml
popłuczyn. Tak uzyskany materiał przesyłano niezwłocznie do Pracowni Mikrobiologii (nie
dłużej niż w ciągu 3 godzin) i wykonywano posiew ilościowy (jednorazową ezą kalibrowaną
o objętości 10−3 ml) na podłoża takie jak w przypadku posiewu plwociny.
Do identyfikacji bakterii stosowano aparat Vitek firmy BioMerieux lub PHOENIX firmy Becton-Dickinson (BD). Stosowano także podłoża diagnostyczne: podłoże Chapmana
BioMerieux, podłoże CET BioMerieux, podłoże MacConkeya BioMerieux oraz testy API
oraz testy lateksowe, takie jak: test API Strept BioMerieux, test API Staph BioMerieux, test
API NH BioMerieux, test API 20E BioMerieux, test API NE BioMerieux , test lateksowy
PneumoKit Biomerieux, test lateksowy StreptoKit Biomerieux, test lateksoweg StaphKit
BioMerieux,
Lekowrażliwość wyhodowanych drobnoustrojów oznaczono zgodnie z wytycznymi
KORLD za pomocą (5): metody dyfuzyjno-krążkowej (zastosowano krążki firmy HAND
PROD, BioMerieux oraz Oxoid), metod automatycznych aparatem Vitek BioMerieux lub
PHOENIX BD i metodą E-testów firmy HAND PROD, przy pomocy których oznaczany był
Nr 4
Patogeny dróg oddechowych
335
MIC (Minimal Inhibitory Concentration). Do metody dyfuzyjno-krążkowej oraz E-testów
używano podłoża MHA i MH firmy HAND PROD.
WYNIKI
Wśród badanych pacjentów z zakażeniami dolnych dróg oddechowych patogenami
izolowanymi najczęściej były pałeczki Gram-ujemne. Izolowane są one częściej u osób
starszych i o ciężkim przebiegu infekcji. Rzadziej izolowano Streptococcus pneumoniae
uznawany z najczęstszą przyczynę pozaszpitalnych infekcji dolnych dróg oddechowych,
a następnie inne patogeny (Tabela I).
Wśród pacjentów chorych na zapalenie płuc najczęściej izolowano pałeczki Gram-ujemne, następnie paciorkowce zieleniące, trzecim w kolejności częstości izolowania
patogenem był Streptococcus pneumoniae, uznawany za główny etiologiczny czynnik
zapalenia płuc (Tabela I).
Tabela I. Liczba drobnoustrojów wyhodowanych od pacjentów chorujących na zakażenia dolnych
dróg oddechowych.
Pacjenci
Pacjenci
Pacjenci
Pacjenci
z POChP
z przewlekłą
z infekcją
z zapaleniem
w stadium
chorobą
dolnych dróg
Drobnoustrój
płuc
zaostrzenia
w stadium
oddechowych
choroby
zaostrzenia
Liczba (%)
Liczba (%)
Liczba (%)
Liczba (%)
Gram-ujemne pałeczki ogółem:
36 (28)
18 (29)
10 (27)
8 (26)
3 (8)
3 (10)
10 (8)
4 (6)
Pseudomonas aeruginosa
3 (8)
3 (10)
9 (7)
3 (5)
Acinetobacter baumanii
Inne Gram-ujemne pałeczki
9 (7)
7 (11)
1 (3)
1 (3)
2 (5)
0 (0)
6 (5)
4 (6)
Escherichia coli
1 (3)
2 (1)
0 (0)
1 (3)
Klebsiella pneumoniae
9 (24)
8 (26)
29 (22)
12 (19)
Streptococcus pneumoniae
Paciorkowce zieleniące
27 (21)
14 (22)
9 (24)
4 (13)
3 (8)
4 (13)
16 (12)
9 (15)
Moraxella catarhalis
4 (11)
6 (19)
15 (11)
5 (8)
Staphylococcus aureus
CNS
5 (4)
4 (6)
0 (0)
1 (3)
Z próbek materiału pobranego od pacjentów chorych na POChP hospitalizowanych
z powodu zaostrzenia infekcji najczęściej hodowano pałeczki Gram-ujemne, które (szczególnie Pseudomonas aeruginosa i Acinetobacter baumanii) są główną przyczyną zaostrzeń
w przebiegu POChP. Rzadziej izolowano Streptococcus pneumoniae, i paciorkowce zieleniące, a następnie pozostałe bakterie (Tab. I).
Wśród pacjentów ze zdiagnozowaną przewlekłą chorobą, będących w fazie zaostrzenia
infekcyjnego, najczęściej hodowanym patogenem były pałeczki Gram-ujemne i Streptococcus pneumoniae, które bywają częstą przyczyną zaostrzeń infekcyjnych takich chorób
jak mukowiscydoza - głównie Pseudomonas aeruginosa i Acinetobacter baumanii, a także
przewlekłego zapalenia oskrzeli i innych. Wyhodowano także inne patogeny (Tab. I).
69
38
13
15
30
36
45
33
22
31
74
65
D
(%)
32
36
10
100
63
31
61
52
CIP
(%)
-
50
10
8
61
61
23
31
E
(%)
19
7
CC
(%)
23
Inne Gram-ujemne pałeczki
18
63
66
30
61
91
96
CRO
(%)
100
63
10
63
66
22
61
87
83
CXM
(%)
89
Pseudomonas aeruginosa
9
54
Acinetobacter baumanii
Escherichia coli
18
38
69
100
Amc
(%)
91
33
2
45
Amx
(%)
91
17
P
(%)
89
Klebsiella pneumoniae
Gram-ujemne pałeczki ogółem:
Moraxella catarhalis
Staphylococcus aureus
MRSA 9%
CNS
Streptococcus pneumoniae
Drobnoustrój
100
100
Va
(%)
100
80
90
54
63
67
61
52
10
AN
(%)
Tabela II. Odsetek izolatów wrażliwych na antybiotyki, wyhodowanych od chorych z zakażeniami dolnych dróg oddechowych.
50
100
54
81
66
71
CAZ
(%)
89
81
100
100
67
91
IPM
(%)
336
A. Kiryszewska, A. Antczak
Nr 4
Nr 4
Patogeny dróg oddechowych
337
Tylko 2 spośród 15 wyhodowanych szczepów gronkowców złocistych były to szczepy
MRSA (methycillin-resistant Staphylococcus aureus) (Tab. II). Szczepy te wyhodowano
od pacjentów chorych na zapalenie płuc. Nie wyhodowano pałeczek Gram-ujemnych wytwarzających ESBL ani MBL. Szczepy MRSA, ESBL (+) i MBL(+) to szczepy szpitalne
należące do patogenów alertowych. Wśród pacjentów przyjmowanych na oddział pulmonologiczny patogeny alertowe nie stanowią istotnego problemu, ponieważ są to głównie
pacjenci z zakażeniami pozaszpitalnymi. Najczęściej izolowanymi drobnoustrojami od
badanych pacjentów były pałeczki Gram-ujemne, które najbardziej były wrażliwe na
imipenem, natępnie ceftazydym, amikacynę, ciprofloksacynę, najmniej na amoksycylinę
z kwasem kalwulanowym. Streptococcus pneumoniae, uznawany za najczęstszą przyczynę
zakażeń dolnych dróg oddechowych, najbardziej wrażliwy był na ceftriakson, następnie
na amoksycylinę, penicylinę i cefuroksym, na erytromycynę oraz doksycyklinę (Tab. II).
DYSKUSJA
W przedstawianej pracy analizowana była częstość występowania drobnoustrojów w badanych próbkach materiałów. Za najczęstszą przyczynę zakażeń dolnych dróg oddechowych
uważa się Streptococcus pneumoniae, który odpowiedzialny jest za 8-50% zakażeń (1, 2, 3, 5,
7, 12). W grupie pacjentów objętych tym badaniem najczęstszym czynnikiem etiologicznym
infekcji dolnych dróg oddechowych okazały się pałeczki Gram-ujemne (28%). W grupie
osób chorych na zapalenie płuc stanowiły 29% izolatów, wśród chorych na zaostrzenie infekcyjne POChP 27% oraz w grupie osób chorych na inne przewlekłe schorzenia w okresie
zaostrzenia stanowiły 26%. Drobnoustroje te są rzadszą przyczyną zapaleń płuc jednak
wśród osób starszych mogą stać się częstszym czynnikiem etiologicznym. Bakterie te są
przyczyną ok. 2% pozaszpitalnych zapaleń płuc (2, 6, 12, 14). W badaniach prowadzonych
przez Zalacain’a i wsp. zakażenia z udziałem pałeczek Gram-ujemnych wśród osób starszych chorujących na pozaszpitalne zapalenie płuc wynosiły 12% (15). W prezentowanej
pracy pacjenci hospitalizowani byli z powodu ciężkiego przebiegu zapalenia płuc i byli to
głównie pacjenci starsi, niemniej jednak odsetek występowania tych patogenów jest i tak
dość wysoki.
Wśród pacjentów chorych na zaostrzenie POChP izolowane są takie drobnoustroje jak
Haemophilus influenzae (50%), Streptococcus pneumoniae (30%), Moraxella catarrhalis
(12%) oraz Staphylococcus aureus (6%). W miarę postępu choroby i po wielu hospitalizacjach osób w starszym wieku częściej izolowane są Gram-ujemne pałeczki (4, 9, 11).
Noweta i wsp. (9) wykazują udział pałeczek Gram-ujemnych w 70% zaostrzeń POChP.
W prezentowanym badaniu pałeczki Gram-ujemne stanowią mniejszy odsetek niż w badaniu
Noweta i wsp., są jednak najczęściej izolowanymi patogenami z próbek materiałów badanej
grupy pacjentów. Mniejszy odsetek może wynikać z faktu, że w pracy Noweta i wsp. badaniami objęto tylko osoby z zaawansowaną chorobą, natomiast w tej pracy badano chorych
o różnym stopniu ciężkości choroby i w tym przypadku odsetek tych patogenów był wysoki.
U pacjentów chorych na inne przewlekłe choroby takie jak np. mukowiscydoza czy
rozstrzenie oskrzeli w trakcie zaostrzenia procesu chorobowego często izolowane są takie
drobnoustroje jak Haemophilus influenzae, Streptococcus pneumoniae, Staphylococcus
aureus, pałeczki Gram-ujemne (4, 8, 10). Wśród pacjentów chorych na mukowiscydozę
338
A. Kiryszewska, A. Antczak
Nr 4
dominują pałeczki Gram-ujemne, głównie Pseudomonas aeruginosa. W badaniach prowadzonych przez Moore’a i wsp. Pseudomonas aeruginosa wyhodowano od 47% chorych
na mukowiscydozę (8). Pomimo iż w przedstawianym badaniu pałeczki Gram-ujemne
izolowane były rzadziej niż w badaniach Moore’a i wsp., to jednak w prezentowanym
badaniu izolowane były jako najczęstszy patogen, co pozostaje w zgodzie z wcześniej
przeprowadzanymi badaniami.
W przedstawianej pracy najczęściej izolowane patogeny (pałeczki Gram-ujemne) najbardziej wrażliwe były na imipenem, następnie ceftazydym, amikacynę, ciproflokascynę,
natomiast na amoksycylinę z kwasem klawulanowym, która jest zalecana jako lek I rzutu
u pacjentów chorujących na pozaszpitalne zapalenie płuc wymagających hospitalizacji
oraz jako terapia skojarzona u pacjentów z mukowiscydozą i POChP w stadium zaostrzenia
infekcyjnego, wrażliwych było tylko 18% izolatów Streptococcus pneumoniae wrażliwy
był na ceftriakson, amoksycylinę, penicylinę i erytromycynę w 19%. Prezentowane badania
pokazują jak ważna jest ciągła obserwacja drobnoustrojów na poziomie lokalnym. Na podstawie tych badań można zastosować właściwy lek na początku leczenia, co jest tak istotne dla
powodzenia terapii. Bardzo ważna jest stała kontrola i obserwacja patogenów występujących
w danej populacji, gdyż ma to wpływ na odpowiednie dostosowanie początkowej terapii.
A. K ir y s z e w s k a , A. Ant c z a k
Pathogens isolated from patients with community-acquired lower respiratory tract
infections
SUMMARY
The aim of the study was to assess the prevalence and antimicrobial susceptibility of pathogens
in patients hospitalized in Clinic of Pneumology and Alergology University Clinical Hospital No 1 in
Łódź in 2006-2008 period, due to community-acquired lower respiratory tract infections. In this samples
of sputum, bronchoaspirate and BAL’s were evaluated. The most frequent pathogens isolated from
all examinated patients were Gram-negative rods. This bacteria were susceptible in most to imipenem
(91%), ceftazydym (71%), amikacin (67%), ciprofloxacin (63%) and to amoxicillin with clavulanic
acid only in 18%. This study show high prevalence of Gram-negative rods in patients hospitalized
due to community-acquired lower respiratory tract infections.
PIŚMIENNICTWO
1.Almirall J, Bolibar I, Vidal J. Epidemiology of community-acquired pneumonia in adults: a population based study. Eur Respi J 2000; 15: 757-63.
2.Guthrie R. Community-Acquired Lower Respiratory Tract Infections, Etiology and Treatment. Chest
2001; 120: 2021-34.
3.Howard LS, Sillis M, Pasteur MC, Kamath Av, Harrison BD. Microbiological profile of community-acquired pneumoniae in adults over the last 20 years. J Infeect 2005; 50: 107-13.
Nr 4
Patogeny dróg oddechowych
339
4.Hryniewicz W i wsp. Rekomendacje postępowania w pozaszpitalnych zakażeniach układu oddechowego. EBM, 2008
5.Hryniewicz W, Sulikowska A, Szczypa K, i inni. Rekomendacje doboru testów do oznaczania wrażliwości bakterii na antybiotyki i chemoterapeutyki 2006. Narodowy Instytut Zdrowia Publicznego,
2006.
6.Korzeniewska-Koseła A. Pozaszpitalne zapalenie płuc. Zakażenia dolnych dróg oddechowych.
Zakażenia 2003; 1: 40-9.
7.Meyer KC. Pneumonia: predisponding factors, prevention and treatment. Geriatic Times 2004, 5.
8.Moore JE, Shaw A, Howard JL i inni. Infection control and significence of sputum and other respiratory secretions from adult patients with cystic fibrosis. Ann Clin Microbiol Antimicrob, 3, 8.
9.Noweta K, Frankowska M, Grzelewska-Rzymnkowska I. Zaostrzenie przewlekłej obturacyjnej choroby płuc z uwzględnieniem bakteriologicznego badania plwociny. Pneum Alerg Pol 2006; 74:
396-402.
10. Overweg K, Hryniewicz W. „Multidrug-Resistant Streptococus pneumoniae in Poland: Identyfication of Emerging clones”, J Clin Microbiol 1999; 37: 1739-45.
11. Pifarre R, Falaquera M, Vincente-de-Vera C, Noques A. Characteristics community-acquired
pneumonia in patients with chronic obstructive of pulmonary disease. Resp Med 2007; 101:
2139-44.
12. Pirożyński M. Zakażenia układu oddechowego. Warszawa, 2007.
13. Przondo-Mordarska A. Procedury diagnostyki mikrobiologicznej w wybranych zakażeniach
układowych. Continuo, Wrocław, 2004.
14.Roson B, Carratala J, Dorca J i inni. Etiology, reasons for hospitalization, risk classes, and outcomes of community-acquired pneumonia in patients hospitalized on the basis of conventional
admission criteria. Clin Infect Dis 2001; 33: 158-65.
15. Zalacin R, Torres A, Celis R, i inni. Community-acquired pneumonia in the elderly: Spanish
multicenter study. Eur Respir J 2003; 21: 294-30.
Otrzymano: 1 IX 2011 r
Adres Autora: 92-213 Łódź, ul. Pomorska 251, Zakład Mikrobiologii Lekarskiej
Katedry Immunologii Klinicznej i Mikrobiologii
Uniwersytetu Medycznego w Łodzi