NOWOTWORY U BIORCÓW
PRZESZCZEPÓW
Joanna Pazik
Klinika Medycyny Transplantacyjnej
NOWOTWORY U BIORCÓW
PRZESZCZEPÓW
• Nowotwory są drugą najczęstszą przyczyną zgonów u
biorców przeszczepu
• Częstość występowania 20 - 60%
• Wraz ze starszym wiekiem biorców częstość
występowania nowotworów w obecnej dekadzie
będzie wzrastała
NOWOTWORY U BIORCÓW
PRZESZCZEPU NERKOWEGO
Częstość występowania - 3-5 razy większa niż w populacji ogólnej
Dane zróżnicowane - zależnie od ośrodka, szerokości geograficznej,
czasu obserwacji
W porównaniu z populacją ogólną
• występują w młodszym wieku
• przebieg bardziej agresywny
• częściej mnogie nowotwory (44%)
• U dzieci występują nowotwory charakterystyczne dla wieku
• dużą zgodność antygenowa, po przeszczepieniu od dawcy rodzinnego rzadziej
rozwijają nowotwory
PATOGENEZA
Nowotwory de novo
Nawrót nowotworu przebytego przed Tx
Nie zamierzone przeniesienie nowotworu z narządem
dawcy
ETIOLOGIA NOWOTWORÓW
• Konwencjonalne czynniki ryzyka
• Immunosupresja
• Przewlekłe zakażenia wirusowe
• Czas trwania niewydolności narządów
• Predyspozycje genetyczne- kolejny de novo nowotwór po KTx - RR
2.38, nowotwory po KTX w zespołach Hippel-Lindau, Wiskott-
Aldrich, Drash
• Czynniki środowiskowe - zróżnicowanie geograficzne
CZYNNIKI ETIOLOGICZNE ROZWOJU
NOWOTWORÓW DE NOVO
Młody wiek biorcy
Interakcje przeszczep-gospodarz związane z
Układem HLA i ABO
Zmarły lub żywy dawca
Różnice płci i wieku
Czas ekspozycji
Ingerencja w układ immunologiczny biorcy
Przewlekła stymulacja antygenowa przez przeszczep
Utrata funkcji NK
Proliferacja T lub B limfocytów
Mikrochimeryzm
Retransplantacja
Immunosupresja
Działanie leku per se
Zaburzenia immunoregulacji
Infekcje
Zaburzona apoptoza
UDZIAŁ WIRUSÓW W ONKOGENEZIE
• EBV - PTLD, chłoniaki
• HBV, HCV - rak wątrobowokomórkowy (HCC)
• HTLV 1 - białaczka z komórek T
• HPV - rak szyjki macicy, raki anogenitalne
• HPV 58 - rak Bowena
• HPV 8, 9 - rak skóry
• HPV 16, 20 - rak skóry i migdałków
• HHV 8 - mięsak Kaposiego
UDZIAŁ WIRUSÓW W ONKOGENEZIE
• Zaburzanie mechanizmów kontrolujących cykl komórkowy i
podziały komórek
• Hamowanie apoptozy komórek gospodarza
• wirusy kodujące białka FLIPs hamujące apoptozę
• interferencja z genem p53 indukującym apoptozę
w odpowiedzi na uszkodzenie DNA
• Komórki wykazujące ekspresję antygenów wirusowych na
swojej powierzchni są nie zauważane przez układ
immunologiczny gospodarza
EPIDEMIOLOGIA
• Częstość nowotworów wzrasta z czasem po KTx - po 20
latach 70% ma co najmniej 1 nowotwór
• Rak skóry 1rok - 7%, 11 lat - 45%, 20 lat - 70%
• Po 10 latach ryzyko nowotworu RR = 13.8
• Po KTx ryzyko 10 razy większe niż HD
• W Japonii 1970 - 95 - nowotwór u 2.6% biorców
Morath et al., J Am Soc Nephrol, 2004
EPIDEMIOLOGIA
Dane USRDS 1995-2001 (n=35 765)
Obserwacja 36 miesięcy po KTx !
Częstość- 7.5% (nsc i sc)
Ryzyko (nsc): starszy wiek, płeć męska, rasa biała, cukrzyca
Rodzaj immunosupresji nie wpłynął ryzyko nsc
ryzyko sc: większe- Aza, mniejsze -Tac, indukcja przeciwciałami
W porównaniu z populacją ogólną
2x rak jelita grubego, płuca, prostaty, żołądka, przełyku, trzustki, jajnika,
sutka
3x rak jądra, pęcherza moczowego
5x czerniak, białaczka, rak wątroby i dróg żółciowych, szyjki macicy
15x rak nerki
20x mięsak Kaposi’s, sc, chłoniaki nieziarnicze
Kasiske et al., Am J Transplant, 2004
EPIDEMIOLOGIA
Dane USRDS 1995-2001 (n=35 765)
Częstość nowotworów porównywalna 1995-1998 i 1999-2001
Ryzyko nowotworu po KTx w porównaniu z oczekującymi na KTx
RR = 2.6 sc
RR = 2.2 melanoma
RR = 9 KS
RR = 3.3 chłoniak nieziarniczy
RR = 1.39 rak nerki
RR = 0.34 rak jajnika
RR = 0.79 rak prostaty
Kasiske et al., Am J Transplant, 2004
DAWCA NERKI
Dawcy z wywiadem choroby nowotworowej
dyskwalifikowani
Akceptowani dawcy z nie dającymi przerzutów guzami
mózgu
• bez zastawek
• różnicować pierwotne guzy mózgu z przerzutami
czerniaka lub chłoniaka
PRZENIESIENIE NOWOTWORU
OD DAWCY
Nowotwór przeniesiony od dawcy
- obecny w momencie pobrania narządów
Nowotwór wywodzący się od dawcy
– de novo guz rozwijający się z przeszczepionych komórek
dawcy (hematopoetycznych, limfatycznych)
Odstawienie immunosupresji, usunięcie przeszczepionej nerki regresja
• CTTR (I. Penn) 1960-97 - nowotwór u 117 biorców (43%)
z 270, którzy otrzymali narząd od dawcy z nowotworem
• UNOS 1994-2001 - 21 nowotworów wśród 108 062 biorców
(0.017%) , zmarło 38%
Kauffman et al., Transplantation, 2002
NAWRÓT NOWOTWORU - EPIDEMILOGIA
Biorca
nawrót
de novo
nerka
wątroba
serce
1.1%
6.5%
2%
8%
5%
14%
Ryzyko nawrotu jest mniejsze niż de novo
(dane UNOS)
NAWRÓT NOWOTWORU
Częstość 0 - 10%
– Bezobjawowy rak nerki
– Chłoniaki
– Rak jądra, szyjki macicy, tarczycy
Częstość 11 - 25%
– Rak macicy, jelita grubego, prostaty, sutka,
– Guz Wilmsa
Częstość > 25%
– Rak pęcherza, raki skóry
– Mięsaki
– Szpiczak
– Objawowy rak nerki
NDT 2000, 15 supplement 7
KWALIFIKACJA DO KTx
Przebyta, wyleczona choroba nowotworowa nie jest
przeciwwskazaniem do transplantacji.
Pacjent wymaga monitorowania badaniem przedmiotowym,
badaniami obrazowymi i dodatkowymi oraz markerami
biochemicznymi
KWALIFIKACJA DO KTx
Poniżej 2 lat
–Incydentalny rak nerki
–Raki in situ
–Małe pojedyncze ogniskowe nowotwory
–Rak pęcherza niski stopień
–Rak skóry podstawnokomórkowy
2 lata
–Większość raków poza A i C
Powyżej 2 lat
–Czerniak
–Rak sutka
–Rak jelita grubego
–Rak macicy nie in situ
NDT 2000, 15 supplement 7
NOWOTWORY de novo
Występują ze zwiększoną częstością po transplantacji
CTTR (na podstawie 9688 nowotworów u 9032 biorców)
Rak skóry i warg
- 40% nowotworów u biorców przeszczepu
- płaskonabłonkowy, podstawnokomórkowy
- ryzyko 4-21 razy większe niż w populacji ogólnej
Chłoniaki
- 12-16% nowotworów u biorców
- ryzyko 28-49 razy większe niż w populacji ogólnej
- chłoniaki nieziarnicze, lokalizacja narządowa
NOWOTWORY de novo
Mięsak Kaposiego
- 0.4-5% nowotworów u biorców, ryzyko 400-500 x
- najczęściej zmiany skórne
Rak szyjki macicy in situ
- 9% nowotworów, ryzyko 14-16 x
Rak odbytu, sromu 2.5-2.8%, ryzyko 100 x
Rak wątroby 0.1-3%, ryzyko 20-38 x
Rak nerki 0.5-3.9%, ryzyko 10-100 x
NOWOTWORY
Rak sutka częstość 0.3 - 0.6 %, nie jest zwiększona
Rak prostaty 0.3 - 1.9%, rośnie liczba starszych biorców, wzrośnie
zapadalność
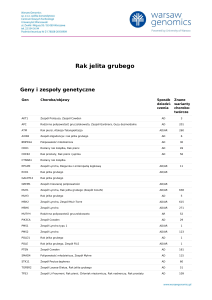
Rak jelita grubego
- częstość 0.7%, ryzyko wzrasta po 10 latach od Tx
Rak płuca <1%
- wskazane zaprzestanie palenia papierosów
- nie polecane badania przesiewowe
UDZIAŁ LEKÓW IMMUNOSUPRESYJNYCH
W PATOGENEZIE NOWOTWORÓW
• Nie udowodniono bezpośredniego wpływu poszczególnych
leków
immunosupresyjnych na rozwój swoistego rodzaju nowotworu
• Zaburzona immunoregulacja spowodowana immunosupresją
• Pośrednio immunosupresja sprzyja przewlekłym zakażeniom wirusowym
EBV, HBV, HCV, HHV 8, HPV - 15% nowotworów
• Znaczenie ogólnej wielkości immunosupresji
• Stosowanie ATG lub OKT3 zwiększa ryzyko PTLD
• Limfocytopenia CD4 zwiększa ryzyko rozwoju raka skóry
• Na modelach zwierzęcych stwierdzono, że CsA może przyspieszać progresję
raka poprzez produkcję TGF-b
NOWOTWORY A LEKI IMMUNOSUPRESYJNE
• Nie stwierdzono różnicy w częstości występowania nowotworów u
biorców leczonych CsA w porównaniu z Aza w ciągu 10 lat po
przeszczepieniu
Penn 1990, Montagino 1995
• Nowotwory u biorców otrzymujących CsA powstają wcześniej po
przeszczepieniu (60 - 67 miesięcy) w porównaniu z leczonymi Aza.
• Indukcja przeciwciałami antylimfocytarnymi
zwiększa ryzyko
rozwoju nowotworów po KTx- 1995-2002, 41 000 biorcówBustami et al., Am J Transplant, 2004
NOWE LEKI IMMUNOSUPRESYJNE
• W
krótkotrwałych
obserwacjach
częstość
występowania nowotworów przy IS takrolimus +
MMF porównywalna z CsA
• działanie antyproliferacyjne i przeciwnowotworowe
Rapa W badaniach eksperymentalnych na myszach
Rapa hamuje wzrost guza i powstawanie przerzutów
• Rapa hamuje angiogenezę poprzez hamowanie
śródbłonkowego czynnika wzrostu (VEGF) i
ograniczanie odpowiedzi komórek śródbłonka na
stymulację przez VEGF
RAPAMYCYNA
Pacjenci leczeni Rapa w dwuletniej
obserwacji mieli mniejszą częstość
nowotworów w porównaniu ze
schematami bez Rapa
Kreis et al., Clin Transplant 2004
MMF A RYZYKO ROZWOJU PTLD
UNOS: 4123 biorców leczonych MMF
CTS: 2628 biorców leczonych MMF
Grupa kontrolna: nie leczeni MMF
Czas obserwacji 3 lata
PTLD < 1%
• Leczenie MMF zmniejsza ryzyko rozwoju PTLD lub chłoniaka u
biorców nerki
• Czas leczenia MMF nie miał wpływu na rozwój PTLD
• MMF zmniejsza ryzyko rozwoju innych nowotworów
CZAS ROZWOJU NOWOTWORU
PO TRANSPLANTACJI
• Mięsak Kaposiego - średnio 21 miesięcy
• Chłoniaki - 33 miesiące
• Raki wątroby - 82 miesiące
• Raki anogenitalne - 112 miesięcy
NOWOTWORY SKÓRY
•
•
•
•
u 20-40% chorych po 20 latach od TX
największa w krajach o dużej ekspozycji na promieniowanie
słoneczne
Najczęstszy rak płaskonabłonkowy - czynniki ryzyka promieniowanie UV i brodawki wirusowe (HPV), przebieg
agresywny, w 6% przerzuty do węzłów chłonnych,
śmiertelność wynosi 5%
Rak
podstawnokomórkowy
występuje
10
x
niż w populacji ogólnej
Czerniak stanowi około 5% nowotworów skóry u biorców
przeszczepów (1.7-5 razy częściej niż w populacji ogólnej)
NOWOTWORY SKÓRY
• Całkowite wycięcie
• 12 - 48% nawrót
• Odstawić antymetabolity, zmniejszyć CNI
• Rapamycyna
• Retinoidy (isotretinoin, etretinate, acetretin)
Dreno, Nephrol Dial Transplant 2003
NOWOTWORY OKOLICY SROMU
I ODBYTU
• Nowotwory anogenitalne (odbyt, penis, moszna,
srom) występują 100-krotnie częściej u biorców
przeszczepów w porównaniu z populacją ogólną
• Jedna trzecia pacjentów ma kłykciny kończyste
(HPV)
NOWOTWORY NEREK
• Nowotwory nerek własnych występują 10-100
razy częściej w porównaniu z populacją ogólną
• Predysponują: nefropatia analgetyczna, nabyta
torbielowatość nerek
MIĘSAK KAPOSIEGO
• Czynnik etiologiczny - HHV 8 - częstość w populacji 1%
• Możliwa transmisja z przeszczepionym narządem 1 - 2%
• Po transplantacji reaktywacja zakażenia utajonego
• Około 28% seropozytywnych biorców nerki rozwija KS
• Diagnostyka wirusologiczna HHV 8: serologia (ELISA, IF)
antygeny ps VCA oraz DNA HHV 8 w tkance guza
metodami biologii molekularnej (PCR)
• Gancyklowir, cidifowir hamują replikację HHV 8
MIĘSAK KAPOSIEGO
• Rozpoznanie KS - na podstawie obrazu hist-pat
• Objawy zależne od rozległości nowotworu
– Ograniczone zmiany skórne obejmujące jedną wargę
– Rozlane zmiany skórne obejmujące wargi
– Zmiany w narządach wewnętrznych (przewód
pokarmowy, płuca, pęcherz) i/lub węzłach chłonnych
• U biorców przeszczepu częściej występuje postać KS ograniczona
do zmian skórnych. Śmiertelność w postaci skórnej wynosi 11-23%,
w narządowej 57-78%. Leczenie polega na odstawieniu lub redukcji
immunosupresji.
• W postaci skórnej rokowanie jest dobre
• Retransplantacja nie zalecana
POTRANSPLANTACYJNA CHOROBA
LIMFOPROLIFERACYJNA (PTLD)
• Czynnikiem etiologicznym PTLD jest wirus EBV
• Do zakażenia dochodzi w dzieciństwie, w większości przypadków
jest ono bezobjawowe, u części przebiega jako mononukleoza
zakaźna, 90% osób dorosłych posiada przeciwciała anty–EBV
• Wirus mnoży się w komórkach nabłonkowych nosogardła, a w
formie latentnej pozostaje w limfocytach B, receptorem jest CD21
• U osób leczonych immunosupresyjnie dochodzi do reaktywacji
EBV i nasilonej replikacji. Źródłem EBV są limfocyty B biorcy u
biorców przeszczepów narządowych, u biorców szpiku limfocyty B
dawcy
• Wirus ulega transmisji z przeszczepionym narządem, w
przypadku seronegatywnego biorcy rozwija się pierwotna infekcja
EBV
PTLD
Czynnikami ryzyka PTLD są
– pierwotne zakażenie EBV
– immunosupresja zawierająca przeciwciała
poliklonalne antylimfocytarne lub takrolimus
– przebyta choroba CMV
– wysoki poziom replikacji EBV
– Zakażenie EBV opisywane jest u 20-30% biorców
przeszczepów
PTLD
Częstość występowania PTLD wynosi
– u biorców nerki 1%
– wątroby 2.2%
– serca 1.8%- 4.5%
– płuca i serca 4.5%- 9.4%
– nerki i trzustki 11%
– jelita cienkiego 14%
PTLD
W PTLD
zmiany są heterogenne i nie spełniają kryteriów
rozpoznania chłoniaka
PTLD częściej występuje w pierwszym roku po Tx oraz
u dzieci w porównaniu z dorosłymi
Proliferacja limfocytów B zakażonych EBV może mieć charakter
poliklonalny, oligoklonalny lub monoklonalny
MORFOLOGICZNA KLASYFIKACJA PTLD
Okres 1: Łagodna polimorficzna rozlana hiperplazja B komórkowa
(zróżnicowane plazmocyty bez martwicy i atypii)
Okres 2: Poliklonalna polimorficzna limfoproliferacja B z atypią
komórkową i nasiloną martwicą. Lokalizacja w 70%
pozawęzłowa, lite guzy w przeszczepionym narządzie, CUN,
przewodzie pokarmowym, wątrobie, tkankach miękkich,
płucach. U 50% chorych zmiany są wielonarządowe.
Najczęstsze objawy kliniczne to gorączka, utrata masy ciała,
limfadenopatia, zapalenie migdałków, perforacja jelita.
Okres 3: Monoklonalna proliferacja poli- i monomorficzna. Postać
monomorficzna
jest
zawsze
monoklonalna
i obejmuje chłoniaki nieziarnicze (non Hodkin)
B komórkowe lub rzadko T komórkowe.
POSTĘPOWANIE W PTLD
•
•
•
•
•
•
•
Redukcja lub odstawienie immunosupresji
Anty-CD 20- RITUXIMAB
Leczenie przeciwwirusowe
Immunoglobuliny
Interferon-alfa
Chemioterapia
Terapia komórkowa- anty EBV cytotoksyczne
limfocyty T
CHŁONIAKI
Objawy kliniczne
Gorączka
Limfadenopatia
Tonsillitis
Perforacja jelita
Chudnięcie
Lokalizacja
Wielonarządowa
Jelito cienkie
Jelito grube
Mózg
Tylko CNS
Inne narządy
Płuca
Nerki
52%
28%
28%
16%
8%
51%
47%
6%
22 - 27%
12%
10%
15 - 38%
12 - 23%
PRZESZCZEPIENIE JAKO METODA
LECZENIA NOWOTWORÓW
•
BMT - białaczka, szpiczak
•
!!! OLT - HCC
najlepsze wyniki, gdy pojedyncze ognisko
<5cm,
bez nowotworzenia naczyniowego
przerzuty do wątroby raka jelita grubego, sutka
NAWRÓT NOWOTWORU WĄTROBY
Typ guza
n
nawrót(%)
przeżycie(%)
2..... 5 lat
HCC
365
39
30..... 17
HCC incydentalny
31
13
57....... 57
cholangiocarcinoma
109
44
30........17
hepatoblastoma
18
33
50....... 50
przerzuty do wątroby
41
59
38.......21
ZAPOBIEGANIE NOWOTWOROM
• Badania przesiewowe
• Należy
unikać
powtarzania
i nadmiernej immunosupresji
kursów
ATG/OKT3
• Niektóre nowotwory ulegają regresji po zmniejszeniu lub
odstawieniu immunosupresji (zwłaszcza Cyklosporyny):
PTLD, mięsak Kaposiego, nowotwory przeniesione od
dawcy
• Pacjenci z przebytą choroba nowotworową przed
transplantacją jak i de novo po przeszczepieniu powinni jako
podstawowy lek immunosupresyjny otrzymywać
rapamycynę
PROFILAKTYKA
• Oglądanie skóry, śluzówek co 6m-cy u chorych wysokiego ryzyka, co
roku u pozostałych
• Badanie ginekologiczne z cytologią co roku
• Mammografia > 40 roku życia, co 2 lata
• USG narządów jamy brzusznej i miednicy małej co roku
• RTG klatki piersiowej co roku
• Krew utajona w stolcu i badanie per rectum co roku > 50 roku życia
• Sigmoidoskopia > 50 roku życia, co 3 - 5 lat
• U nosicieli HBV, HCV -> AFP, usg
• Cystoskopia- de novo hematuria (leczenie cyklofosfamidem)
• Markery? Mała czułość. Upośledzona czynność wątroby AFP, CA 19-9,
CA 125, CA 15-3.