Zakład Biotechnologii i Inżynierii Genetycznej SUM, 2016/17
Produkcja kwasów organicznych
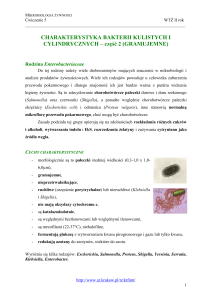
Bakterie octowe
Bakterie należące do rodziny Acetobacteraceae (obejmującej 18 rodzajów wg klucza Bergey’a)
nazywane są bakteriami octowymi. Głównymi przedstawicielami tej rodziny są dwa rodzaje
Acetobacter sp. (15 gatunków) i Gluconobacter sp (4 gatunki) oraz niedawno wyodrębniony
Gluconacetobacter sp (15 gatunków). Są to bakterie Gram-ujemne lub Gram-zmienne, bezwzględnie
tlenowe, kształtu pałeczkowatego. Nie wytwarzają zarodników, często natomiast wydzielają
substancje śluzowe (jest to charakterystyczny objaw psucia się piwa i wina zakażonego tymi
bakteriami). Naturalnie występują w roślinach, najczęściej współbytują z dzikimi drożdżami
wszędzie tam, gdzie obecne są wydzieliny lub soki zawierające cukry. Występują pojedynczo lub
po dwie, a rzadziej w postaci krótkich łańcuszków. Mogą być urzęsione lub nieurzęsione. Bakterie
z rodzaju Acetobacter wykazują urzęsienie peritrichalne (wkołorzęse) i są mało ruchliwe, natomiast
Gluconobacter są urzęsione biegunowo. Charakterystyczną cechą w hodowli jest występowanie form
inwolucyjnych o pogrubionych lub wydłużonych kształtach. Rodzaj Acetobacter wykazuje zdolność
wzrostu na podłożach zawierających azot w postaci mineralnej (sole amonowe), w przeciwieństwie
do Gluconobacter, który wymaga dodatku organicznego źródła azotu (najczęściej wyciągu
drożdżowego). Wszystkie bakterie octowe mają zdolność do utleniania etanolu do kwasu octowego,
jednak tylko Acetobacter i Gluconacetobacter mogą dalej utleniać kwas octowy do dwutlenku węgla i
wody, ponieważ posiadają komplet enzymów cyklu Krebsa (podobnie może przekształcać kwas
mlekowy) – tzw. grupa peroxidans. Bakterie Gluconobacter sp. nie potrafią natomiast utleniać kwasu
octowego i mlekowego do CO2 i H2O z uwagi na brak enzymów cyklu Krebsa (tzw. grupa
suboxidans). Charakteryzują się za to wysoką aktywnością ketogenną – utleniają glukozę do kwasu
glukonowego i dalszych ketopochodnych. Posiadają także zdolność utleniania alkoholi
polihydroksylowych (np. glicerolu do dihydroksyacetonu lub sorbitolu do sorbozy).
Bakterie octowe pełnią ważną rolę w przemyśle farmaceutycznym oraz chemicznym. Są
wykorzystywane do produkcji kwasu octowego metodą biotechnologiczną (rodzaj Acetobacter sp.).
produkcja octów jest podstawowym zastosowaniem tych bakterii już od stuleci. Bakterie octowe
bardzo często rozwijają się w nieprawidłowo zabezpieczonych napojach alkoholowych typu piwa i
wina stanowiąc jedną z najczęstszych przyczyn strat w browarnictwie i produkcji wina (kwaśnienie
alkoholu). Wynika to z naturalnej sukcesji ekologicznej: produkt metabolizmu drożdży – etanol –
jest wykorzystywany przez rozwijające się bakterie octowe (tworzą śluzowate kolonie i kożuchy).
podobne straty mogą powstawać w przypadku przetworów owocowych i warzywnych
konserwowanych zalewami octowo-cukrowymi. W tym przypadku może też dochodzić do
odkwaszania
zalewy
w
wyniku
działalności
1
bakterii
z
rodzaju
Acetobacter
Zakład Biotechnologii i Inżynierii Genetycznej SUM, 2016/17
(gł. A. xylinus, A. pasteurianus, A. aceti). Bakterie octowe są także przyczyną psucia jabłek i gruszek.
Z drugiej strony, od stuleci produkowane napoje alkoholowe typu cydrów (w polskiej tradycji
jabłeczniki i gruszeczniki) powstają w wyniku spontanicznej fermentacji moszczu jabłkowego
(rzadziej gruszkowego) przez drożdże, a następnie częściowej „fermentacji octowej” prowadzonej
przez naturalną mikroflorę owoców, w tym głównie bakterie octowe, w warunkach bardzo
delikatnego dostępu tlenu. Stąd też gotowy napój typu cydr ma unikalne walory organoleptyczne –
pośrednie pomiędzy piwem, a winem. Cydr może być także wykorzystany do produkcji napojów
destylowanych typu calvados lub applejack.
Bakterie octowe wykorzystywane są także do utleniania cukrów prostych do kwasów
jednokarboksylowych (-onowych) oraz do otrzymywania produktów dalszego utleniania, czyli
ketokwasów (kwas 5-ketoglukonowy, kwas 2-ketoglukonowy, kwas 2,5-diketoglukonowy).
Praktyczne znaczenie ma otrzymywanie kwasu glukonowego z wykorzystaniem bakterii
Gluconobacter sp. oraz δ-laktonu kwasu glukonowego (zastosowanie w piekarnictwie). Kwas
glukonowy jest wykorzystywany w przemyśle spożywczym, a glukoniany stosowane są w
przemyśle farmaceutycznym do otrzymywania preparatów zawierających łatwo przyswajalne
źródło jonów wapnia lub żelaza. Glukonian sodu stosowany jest ponadto w produkcji płynów
myjących i proszków do prania oraz w budownictwie jako dodatek do zapraw betonowych. Roczna
produkcja kwasu glukonowego wynosi ok. 40 tys. ton. Gluconobacter suboxydans (dawny syn.
Acetobacter oxidans) jest wykorzystywany do otrzymywania witaminy C mieszaną metodą
chemiczno-mikrobiologiczną. Bakterie te przeprowadzają biokonwersję sorbitolu do sorbozy, która
jest dalej przekształcana na drodze chemicznej do witaminy C (kwasu askorbowego).
„Fermentacja octowa” i produkcja octu
Ocet stosowano już w starożytności jako przyprawę oraz przede wszystkim do
konserwowania żywności. Dodatkową zaletą octu (wykorzystywaną zwłaszcza współcześnie) jest
pobudzanie przemiany materii – stąd zastosowanie jako środka na odchudzanie. Ocet stosowano
również do kąpieli leczniczych i nacierań. Współcześnie do celów chemicznych kwas octowy
otrzymywany jest w procesie suchej destylacji drewna lub w wyniku pełnej syntezy chemicznej.
Ocet konsumpcyjny nie może natomiast zawierać syntetycznego kwasu octowego, lecz kwas
uzyskany na drodze biotransformacji z surowców pochodzenia naturalnego. Surowcem
wyjściowym jest etanol zawarty w surówkach gorzelniczych lub rektyfikacie (ocet spirytusowy)
oraz etanol występujący w winach białych lub czerwonych (tzw. ocet winny). Jako gotowy produkt
(„ocet spożywczy”) wykorzystuje się podłoże pofermentacyjne, a nie oczyszczony kwas octowy.
Ocet spożywczy jest więc 3,5%-10% roztworem kwasu octowego z towarzyszącymi mu
2
Zakład Biotechnologii i Inżynierii Genetycznej SUM, 2016/17
pozostałościami składników zacieru octowniczego. Wyróżnia się następujące główne rodzaje octów
spożywczych:
ocet spirytusowy (otrzymywany fermentacyjnie na bazie rozcieńczonego spirytusu)
ocet balsamiczny (otrzymywany poprzez fermentację z moszczu winogron)
ocet jabłkowy (otrzymywany z fermentacji wina owocowego – jabłkowego – lub moszczu
jabłkowego)
ocet ryżowy (produkowany głównie na Dalekim Wschodzie z ryżu lub sake).
Bakterie z rodzaju Acetobacter oraz Gluconobacter posiadają zdolność do częściowego
utleniania cukrów (glukoza, fruktoza) lub alkoholi (etanol, propanol, butanol, mannitol, glicerol).
Zwyczajowo proces ten określany jest jako „fermentacja octowa” (lub octanowa), jednak jest to
proces ściśle tlenowy. Niewykorzystany produkt końcowy- kwas octowy jest wydzielany do
podłoża:CH3CH2OH + O2 → CH3COOH + H2O
Utlenianie zachodzi w dwóch etapach: najpierw do aldehydu octowego, a następnie do kwasu
octowego, towarzyszy temu znaczna ilość wydzielanego ciepła.CH3CH2OH → CH3CHOH →
CH3COOH
W zależności od gatunku (różna tolerancja na kwasowość środowiska) ilość wytworzonego kwasu
wynosi 2-13%. Po wyczerpaniu się substratu bakterie z rodzaju Acetobacter mogą dalej utleniać kwas
octowy do CO2 i H2O (powodując stratę w produkcji octu).
3
Zakład Biotechnologii i Inżynierii Genetycznej SUM, 2016/17
Podstawowym parametrem niezbędnym do prawidłowego przebiegu fermentacji octowej
jest dostęp do odpowiednio dużej ilości powietrza. Zarówno tradycyjne, jak i współczesne
technologie produkcji octu muszą zapewniać ścisły kontakt bakterii i pożywki z tlenem
atmosferycznym.
Zacier
octowniczy,
czyli
brzeczka
fermentacyjna,
jest
odpowiednio
rozcieńczonym roztworem etanolu (6-12%) z niewielkim dodatkiem kwasu octowego (ok. 2%).
Niezbędny jest także dodatek soli mineralnych (amonowych i fosforanów). Surowcami na bazie
których przygotowuje się zacier octowniczy są spirytusy (ziemniaczany, zbożowy, owocowy),
piwo, wino lub moszcze, a także słód jęczmienny, soki owocowe, zboża, ziemniaki, buraki cukrowe,
melasa – po ich uprzednim sfermentowaniu.
Wyróżnia się trzy główne metody produkcji octu spożywczego, wśród których najstarszą i
najprostszą jest metoda powierzchniowa (metoda orleańska). W metodzie tej wino pozostawiano
w kadzi fermentacyjnej lub płaskim naczyniu. Bakterie fermentacji octowej dostawały się do
naczynia za pośrednictwem muszki owocowej (Drosophila aceti) – fermentacja spontaniczna. Proces
przebiegał bardzo powoli a drobnoustroje nie były połączone z żadnym nośnikiem. Z czasem
wprowadzono nośniki, np. wytłoki winogron, łodygi winorośli, na których bytowały drobnoustroje.
Naczynie okresowo wstrząsano, aby zwiększyć natlenienie pożywki. Maksymalne stężenie octu w
tej metodzie nie przekraczało zazwyczaj 8%. W metodzie klasycznej (ociekowej) wysokie kadzie
drewniane (~ 3 m) lub kamionkowe (~ 5 m) o podwójnym dnie wypełniano wiórami z drewna
bukowego lub rzadziej innym materiałem (pumeks, koks, węgiel drzewny, kolby kukurydziane).
Na ich powierzchni bytują namnożone bakterie fermentacji octowej. Substrat (wino lub roztwór
etanolu) podawano od góry kadzi - spływał on grawitacyjnie w dół. Dzięki dużej powierzchni
wiórów i obfitemu dostępowi powietrza, zasysanego przez dolne otwory kadzi (przepływ
powietrza w przeciwprądzie), zacier stopniowo zmieniał się w ocet w toku powolnego ściekania.
Procedurę powtarzano kilkakrotnie, aż do uzyskania odpowiedniego stężenia octu. Cały proces
trwał kilka do kilkunastu dni, a stężenie uzyskanego octu mieściło się w granicach 9-15%. Raz
namnożone drobnoustroje wykorzystywano przez wiele lat. Najnowsza i najbardziej wydajna
metoda współczesna (wgłębna) prowadzona jest w bioreaktorach (acetatorach). Utlenianie
alkoholu przebiega w ściśle kontrolowanych warunkach. Do fermentacji stosowane są czyste,
wyselekcjonowane kultury. Proces prowadzi się w sposób półciągły - przebiega on do momentu
spadku stężenia alkoholu do 0,3%, wówczas część octu zostaje odprowadzona a dostarczana jest
nowa porcja pożywki. Cykl produkcyjny trwa 40-48 godzin, a wydajność bioprocesu sięga 98%.
Stężenie kwasu octowego w produkcie końcowym wynosi do 15%. Istnieją technologie pozwalające
uzyskać ocet o stężeniu 18-20% przy użyciu odpornych szczepów bakterii octowych. Ocet surowy
jest filtrowany w celu usunięcia zanieczyszczeń, szczególnie białek powodujących mętnienie octu.
4
Zakład Biotechnologii i Inżynierii Genetycznej SUM, 2016/17
„Fermentacja” cytrynianowa
Do drobnoustrojów przeprowadzających fermentację cytrynianową z dość dużą wydajności
zaliczamy liczne gatunki pleśni, drożdże (Candida, Rhodotorula, Torulopsis), bakterie (Bacillus
licheniformis). Jednak największe znaczenie mają grzyby z gatunku Aspergillus niger. Fermentacja
prowadzona przy udziale drożdży jest łatwiejsza do prowadzenia w systemie ciągłym, jest też
bardziej wydajna. Wadą jest duży udział kwasu izocytrynowego (do 20%). W przeciwieństwie do
bakterii, grzyby strzępkowe są dużo bardziej podatne na separację przez filtrowanie, co usprawnia
technologię procesu i nie wymaga dużych nakładów energii. Grzyby syntetyzują kwasy organiczne
w warunkach tlenowych. Zjawisko nadmiernego wydzielania pośrednich produktów metabolizmu
podstawowego (w tym kwasu cytrynowego) wynika z braku pewnych pierwiastków śladowych w
podłożu hodowlanym. Powstaje możliwość celowej regulacji metabolizmu grzybów w kierunku
nadprodukcji i wydzielania określonego produktu. Jest to wykorzystane w skali przemysłowej.
Substraty wykorzystywane do otrzymywania kwasu cytrynowego to: melasa buraczana lub
trzcinowa (w mniejszym stopniu melasa kukurydziana, sojowa lub pomarańczowa), hydrolizaty
skrobi ziemniaczanej i kukurydzianej, glukoza (techniczna lub czysta), cukier (biały i surowy),
koncentraty soków z buraków i trzciny cukrowej. Pożywka może być uzupełniana źródłami azotu
organicznego i fosforu nieorganicznego oraz dodatkiem soli mineralnych (magnez, siarka, cynk,
żelazo, miedź, mangan).W syntezie kwasu cytrynowego (oraz innych kwasów organicznych) przez
grzyby kluczową rolę odgrywają enzymy cyklu kwasów trójkarboksylowych (cyklu Krebsa).
Substratem bezpośrednim jest glukoza. Fumaran, jabłczan, bursztynian i cytrynian są wydzielane
do podłoża jako produkty pośrednie cyklu Krebsa. Wydajność „fermentacji” zależy w dużym
stopniu od składu pożywki. Tworzeniu się kwasu sprzyja mała ilość związków azotu (limitacja
procesów wzrostu grzybni) i jednocześnie duża zawartość cukru w podłożu (10% na podłożu
sacharozowym i 16% na podłożu melasowym). Wytwarzanie kwasu cytrynowego jest związane z
okresem głodowania grzyba. Wysoką wydajność produkcji kwasu cytrynowego warunkują Fe2+,
Mn2+ i Zn2+ (jeżeli są w stężeniach limitujących aktywność hydratazy akonitanowej – poniżej 0,1
mg/100 ml pożywki).
5
Zakład Biotechnologii i Inżynierii Genetycznej SUM, 2016/17
Biochemiczne warunki nadprodukcji kwasu cytrynowego przez A. niger
Zarówno dzikie szczepy A. niger, jak i przede wszystkim mutagenizowane szczepy
przemysłowe mają zdolność do nadprodukcji kwasu cytrynowego. Wynika to z naturalnej bądź
indukowanej sztucznie niskiej aktywności określonych enzymów cyklu Krebsa, cyklu
glioksalowego oraz tzw. alternatywnego szlaku oddechowego. Łącznie nadprodukcja kwasu
cytrynowego u A. niger jest więc uwarunkowana trzema mechanizmami biochemicznymi.
Głównym substratem w nadprodukcji cytrynianu jest sacharoza, stąd pierwszym etapem
biosyntezy jest jej hydroliza warunkowana wysoką aktywnością inwertazy. Enzym ten jest w
większości wydzielany do podłoża produkcyjnego (ponad 60%). Produkty hydrolizy sacharozy –
glukoza i fruktoza – są włączane następnie w szlak glikolityczny będący podstawowym źródłem
prekursorów biosyntezy kwasu cytrynowego. Powstający pirogronian jest włączany do cyklu
Krebsa. Kwas cytrynowy powstaje w wyniku kondensacji acetylo-CoA ze szczawiooctanem, jednak
dalsze jego przekształcenia w cyklu Krebsa są hamowane w wyniku bardzo niskiej aktywności
hydratazy akonitanowej (głównie poprzez regulację składu pożywki – odpowiednio niskie stężenie
jonów Fe2+, Zn2+, Mn2+) katalizującej przekształcenie cytrynianu w izocytrynian. Powstający w tych
warunkach nadmiar cytrynianu jest usuwany poza komórki do środowiska hodowlanego, dzięki
czemu nie występuje sprzężenie zwrotne hamujące tempo glikolizy. Kolejne dwa enzymy cyklu
Krebsa również mają obniżoną aktywność. Są to dehydrogenaza izocytrynianowa (hamowana przez
niskie pH środowiska oraz gromadzący się w mitochondriach cytrynian) i dehydrogenaza αketoglutaranu. Drugim mechanizmem warunkującym nadprodukcję jest współwystępujący cykl
glioksalowy, w którym izocytrynian jest przekształcany w szczawiooctan wzbogacający pulę tego
związku w pierwszej, kluczowej reakcji cyklu Krebsa i jednocześnie biosyntezy kwasu
cytrynowego. Kluczowym enzymem szlaku glioksalowego, o wysokiej aktywności u A. niger, jest
liaza izocytrynianowa. Ostatnim mechanizmem warunkującym nadprodukcję kwasu cytrynowego
6
Zakład Biotechnologii i Inżynierii Genetycznej SUM, 2016/17
u A. niger jest występowanie alternatywnego łańcucha oddechowego w mitochondrium.
Kluczowym jego elementem jest tzw. alternatywna oksydaza AOX (alternative oxidase). Jej działanie
umożliwia transport elektronów na tlen w sposób bezpośredni, czyli bez udziału układu
cytochromów w błonie mitochondrialnej. Znaczenie alternatywnej oksydacji polega na zużywaniu
gromadzącego się NADH z glikolizy (restytucja NAD+), dzięki czemu nie dochodzi do hamowania
zwrotnego tego szlaku – jest to główny czynnik aktywujący AOX. Alternatywna oksydacja jest
szlakiem mniej wydajnym energetycznie (mniejsza produkcja ATP o około 60%); znaczna część
energii jest uwalniana w postaci ciepła. Podobny mechanizm alternatywnego oddychania opisano
u innych grzybów (np. u Neurospora crassa) – występuje on zwykle w czasie przechodzenia hodowli
w etap stacjonarny po fazie logarytmicznego wzrostu. Warunkiem aktywacji AOX jest intensywne
natlenianie środowiska. Nawet krótkotrwały niedobór tlenu w środowisku może zahamować
aktywność AOX i pobudzić procesy proliferacji grzybni przy jednoczesnym zahamowaniu
biosyntezy kwasu cytrynowego. Dodatkowym czynnikiem aktywującym AOX jest niedobór jonów
Cu2+ niezbędnych do prawidłowej aktywności oksydazy cytochromowej – spadek jej aktywności
prowadzi do aktywacji AOX.
7
Zakład Biotechnologii i Inżynierii Genetycznej SUM, 2016/17
Technologia produkcji kwasu cytrynowego
Produkcję kwasu cytrynowego w skali przemysłowej prowadzi się dwiema alternatywnymi
metodami:
- metoda powierzchniowa – jest przeprowadzana w ciekłej pożywce (najczęściej melasie) w
komorach fermentacyjnych z tacami (LSF - liquid surface fermentation) lub w pożywce stałej (SSF –
solid state fermentation) w fermentorach tacowych, bębnowych, komorowych lub wieżowych.
- metoda wgłębna (SmF – submerged fermentation) - przeprowadzana w ciekłej pożywce, w
klasycznych fermentorach o poj. 50-500m3 z mieszaniem i napowietrzaniem lub w fermentorach
typu air-lift. Tą metodą uzyskuje się 80% światowej produkcji kwasu cytrynowego. Najkorzystniej
jest prowadzić hodowle Aspergillus niger przy zachowaniu niskiego pH na początku procesu
(pH=2,5-3,5), co warunkuje powstawanie czystego kwasu cytrynowego (bez syntezy innych
produktów), a jednocześnie chroni hodowlę przed zakażeniami bakteryjnymi. Akumulacja i
wydzielanie do pożywki produktów pośrednich cyklu kwasów trójkarboksylowych (w tym kwasu
cytrynowego) przez kultury grzybów jest wynikiem niezrównoważonego metabolizmu tych
organizmów. W normalnych warunkach dzikie szczepy grzyba przeprowadzają całkowite
utlenienie i asymilację substratów.
8
Zakład Biotechnologii i Inżynierii Genetycznej SUM, 2016/17
Problemy technologiczne związane z produkcją kwasu cytrynowego związane są przede
wszystkim z utrzymywaniem aktywnej i nieskażonej innymi gatunkami grzybów kultury pleśni.
Hodowle Aspergillus niger z czasem ulegają degeneracji i tracą zdolność wytwarzania kwasu
cytrynowego. Ponadto zdarzają się zakażenia bakteriami mlekowymi (Streptococcus i Leuconostoc),
tlenową laseczką sienną (Bacillus subtilis), laseczką ziemniaczaną (Bacillus mesentericus), a nawet
beztlenowym bakteriami gnilnymi np. Clostridium sporogenes.
Kwas cytrynowy znajduje szerokie zastosowanie w przemyśle spożywczym (E330), głównie
jako regulator kwasowości (napoje, dżemy, galaretki, słodycze). Kwas cytrynowy ma również
działanie konserwujące, wybielające i przeciwutleniające, co wykorzystuje się w przemyśle
spożywczym, farmaceutycznym i kosmetycznym a także w produkcji środków piorących. Roczna
światowa produkcja kwasu cytrynowego wynosiła w 2007 roku ponad 1,6 mln ton.
9