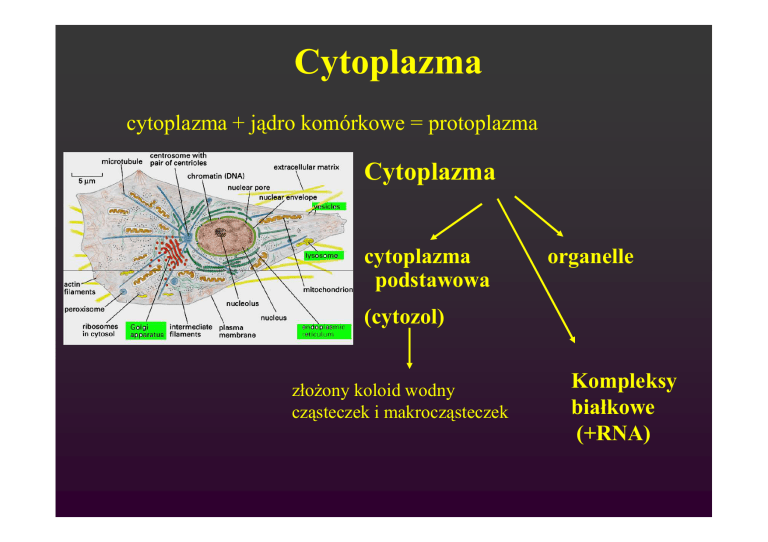
Cytoplazma
cytoplazma + jądro komórkowe = protoplazma
Cytoplazma
cytoplazma
podstawowa
organelle
(cytozol)
złoŜony koloid wodny
cząsteczek i makrocząsteczek
Kompleksy
białkowe
(+RNA)
Cytoplazma podstawowa
(macierz cytoplazmatyczna)
• ok. 55% objętości komórki
• złoŜony koloid wodny białek (20%)
i wszystkich rozpuszczalnych związków chem.,
biorących udział w przemianie materii komórki (zol/Ŝel)
rybosomy
proteasomy
cytoszkielet
krople tłuszczu, ziarna glikogenu
Procesy zachodzące w cytoplazmie podstawowej
- wszelkie procesy związane z metabolizmem pośrednim
biosynteza białek (translacja)
początkowy etap oddychania (glikoliza lub oksydacyjny
szlak pentozofosforanowy)
Rybosomy
u Eukariotów rybosomy 80S; (70S w mitochondriach i chloroplastach)
Białka:
strukturalne
enzymatyczne
białek
białek
duŜa podjednostka
mała podjednostka
Aktywność
katalityczna:
RNA
Podjednostki rybosomu
duŜa
RNA -2/3masy
białka - 1/3
mała
kompletny rybosom
Film-translacja 1
Rybosomy-biosynteza białka
miejsce wiązania mRNA
Miejsca wiązania t-RNA
A-site: akceptorowe (aminoacylo-tRNA)
P-site peptydylowe (peptydylo tRNA)
E-site: wyjścia (ang. exit)
Film-translacja 2
Rybosom
• rRNA – rdzeń rybosomu (struktura)
• jest rybozymem - aktywność katalityczna
(rRNA 23S duŜej podjednostki –miejsce katalityczne peptydylotransferazy)
• miejsce spotkania się wszystkich rodzajów RNA
Polirybosomy (polisomy)
Film
Film-polirybosomy
Synteza białek: 20sek –kilka min
wielokrotna inicjacja translacji
Proteasomy (proteosomy)
Kompleks: białka – RNA
aparat importujący białka
do proteolizy (19S)regulatorowy
(aktywator proteasomu, 6 ATP-az)
aparat dokonujący
proteolizy białek (20S)
katalityczny
(4 pierścienie z 7 podjednostek,
proteasom 26S
beczułka)
• we wszystkich komórkach eukariotycznych
• w cytoplazmie i jądrze
Proteasomy
• białko -sekwencja
rozpoznawcza „pudełko
destrukcyjne”
proteoliza proteasomowa
(N-końcu 8-10 reszt)
76 aa
• związanie ubikwityny (3
enzymy, ligaza; wiązanie
izopeptydowe: białko-Lys_–
Gly76_Ub)
proteaza
proteasomowa
• wnikanie do proteasomu
• degradacja białek do
peptydów ( 8-15 aa),
odłączenie ubikwityny
Proteosomy
proteoliza proteasomowa
tylko u eukariotów
związana z ubikwityną
selektywna
białka „krótkoŜyjące” (SS blisko N-końca)
białka uszkodzone, źle sfałdowane
Proteoliza
proteoliza lizosomowa
nieselektywna;
białka pobierane przez komórki
strukturalne „długowieczne”
proteoliza proteasomowa (80-90%)
białka uszkodzone, nieprawidłowo sfałdowane
„krótkoŜyjące” (regulacyjne)
selektywna
ubikwitynacja białka
(wiązanie ubikwityny przez wiązanie izopeptydowe)
CYTOSZKIELET
Sieć włókienek białkowych;
struktura wysoce dynamiczna
• Filamenty aktynowe
• Filamenty pośrednie
• Mikrotubule
Fibroblast
Fibroblast
CYTOSZKIELET
CYTOSZKIELET
7nm
10nm
25nm
Filamenty pośrednie
• ich średnica 9-12 nm
• zbudowane z białek
specyficznych tkankowo
• stanowią ochronę
mechaniczną komórki
• odpowiedzialne za
spręŜystość cytoplazmy
Budowa filamentu pośredniego
animacja
Filamenty pośrednie
Klasyfikacja FP w oparciu o sekwencje domeny trzonowej (α
α- helisy)
I i II
homo- i heteropolimery
12 izoform w ludzkim naskórku
III
IV
V
• zwykle 1 klasa cytoplazmatycznych FP w danym typie komórek
• komórki nowotworowe – ekspresja FP jak w komórkach „wyjściowych”
Białka wiąŜące filamenty pośrednie
Plakiny
plektyna
desmoplakina
Białka epidermalne
filagryna
Związane z laminami
LAP1, LAP2, LBR…
FILAMENTY POŚREDNIE
Mikrografia fluorescencyjna komórek
epitelialnych w hodowli –
wybarwione wiązki filamentów
keratynowych
Mikrografia elektronowa cienkich skrawków
komórek nerki chomika w hodowli –
filamenty wimentynowe (strzałki)
Filamenty pośrednie keratynowe
w komórkach epitelialnych
desmosomy i hemidesmosomy
desmosomy
półdesmosomy
Filamenty pośrednie wzmacniają komórkę
zwierzęcą
Filamenty pośrednie wzmacniają komórkę
Zdjęcie z mikroskopu świetlnego skóry prawidłowej i od pacjenta z chorobą
genetyczną -zwykłe pęcherzowe oddzielanie się naskórka (epidermolysis bullosa
simplex) - mutacja w obrębie genu keratyny odpowiedzialna za nieprawidłowe
formowanie filamentów keratynowych (monomery jednej z keratyn pozbawione
globularnych domen na C i N-końcach)
Odmienność filamentów jądrowych
• zbudowane z lamin
• tworzą sieć (nie liny)
• ulegają demontaŜowi
i ponownemu formowaniu
Mikrografia elektronowa sieci filamentów jądrowych oocytu Xenopus
Fosforylacja lamin konieczna do rozpadu
filamentów blaszki jądrowej
Cytoszkielet aktynowy
G-aktyna
370 aminokwasów
42 – 43 kDa
izoformy:
α−, β−
β−, γ −aktyna
konserwatywna
Cytoszkielet aktynowy
Filamenty aktynowe (F-aktyna)
agregacja
Oddziaływania
hydrofobowe
Słabe wiązania
niekowalencyjne
13
Cytoszkielet aktynowy
hydroliza ATP
Cytoszkielet aktynowy
„Polimeryzacja” aktyny
Cytoszkielet
aktynowy
50%
~
50%
50 - 200µM G-aktyny
Białka wiąŜące aktynę
(ABP -actin binding protein)
białka wiąŜące monomery
(profilina, tymozyna)
białka czapeczkujące
białka tnące
białka wiąŜące się wzdłuŜ FA
białka wiąŜące filamenty ze sobą
białka wiąŜące filamenty z błonami
Białka wiąŜące F-aktynę
białka tnące, białka czapeczkujące
- białka wiąŜące się wzdłuŜ FA
stabilizują filamenty
tropomiozyna
destabilizują filamenty
kofilina
Białka wiąŜące aktynę
białka wiąŜące filamenty ze sobą
równolegle
krzyŜowo
równolegle
krzyŜowo
- białka wiąŜące FA krzyŜowo
Komórki melanoma: (A)- niski poziom filaminy
(B) - poziom filaminy zwiększony
- białka wiąŜące FA do błony komórkowej
Rodzina białek EMR
(ezrin, radixin, monesin)
Miejsca kontaktów
zogniskowanych - focal contacts
Miejsca kontaktów zogniskowanych - focal contacts
Fibroblasty w hodowli:
A) focal contacts- zdjęcie z mikroskopu odbiciowego
B) filamenty aktynowe wybarwione znakowaną falloidyną
Organizacja filamentów aktynowych w komórce
Organizacja filamentów aktynowych
rola białek Rho
Nadrodzina RAS
Rho
Rab
Arf/Sar
Ran
Ras
Rodzina Rho
rho
rac
cdc42
Filamenty aktynowe zmieniają kształt błony
w komórkach zwierzęcych
A) mikrokosmki B) włókna napręŜenowe C) filopodia
D) pierścień kurczliwy
Filamenty aktynowe
Filamenty aktynowe w
fibroblastach REF-52 mikrografia elektronowa.
a) sieć aktynowa w
lamelipodium na końcu
wiodącym komórki
b) włókna napręŜeniowe
(stress fibers) wzdłuŜ
napręŜeń cytoplazmy
Filamenty aktynowe
zmieniają kształt błony w
komórkach zwierzęcych
Organizacja filamentów aktynowych w komórce
Mikrokosmki:
stabilna struktura
aktynowa
Aparat kurczliwy mięśni
sarkolema
2,5 µm
włókna mięśniowe: kilka- kilkaset µm - grubość
kilka- kilkadziesiąt cm - długość
Cytoszkielet aktynowy funkcje
• warunkuje kształt komórki
• ruch komórki
• ruchy wewnątrzkomórkowe
• cytokineza
• mikrokompartmentacja
Cytoszkielet aktynowy–generacja ruchu
przez polimeryzację aktyny
przez aktynozaleŜne białka motoryczne
Generacja ruchu przez polimeryzację aktyny
motorem ruchu sama aktyna
kierunkowa polimeryzacja / depolimeryzacja
aktyny
źródłem energii hydroliza ATP
w związanych monomerach aktynowych
Generacja ruchu przez polimeryzację aktyny
Zapoczątkowanie polimeryzacji aktyny w komórce:
• fragmentacja istniejących filamentów
• odsłonięcie końców „+” filamentów
• nukleacja de novo
kompleks Arp2/3
Cytoszkielet aktynowy–generacja ruchu
przez aktynozaleŜne białka motoryczne
Miozyny - aktynozaleŜne białka motoryczne
„+”
„-”
rośliny
kręgowce
około 40 rodzin
Miozyny -aktynozaleŜne białka motoryczne
koniec
2 łańcuchy cięŜkie
superhelisa
koniec
Miozyna II
dimer
4 łańcuchy lekkie
szyjka (ramię dźwigni)
Miozyny -aktynozaleŜne białka motoryczne
właściwości hydrolityczne miozyny
aktywowane przez aktynę
hamowane przez jony Mg+2
Bipolarny filament
15-20 cząsteczek
Niektóre funkcje miozyn
film
„Kroczenie”
miozyny po FA
Cykl zmian umoŜliwiający
wędrówkę miozyny
po filamencie aktynowym
cykl skurczowy około 15ms
1 filament gruby-300 głów miozyny
film
Pełzanie komórki
Mikrotubule
podjednostki strukturalne
13 (11-16)
strukturalna polarność
55kDa i 53kDa
450 aminokwasów
Mikrotubule
wydłuŜanie /
/skracanie
Mikrotubule
elongacja
+
-
in vitro
in vivo
- dodawanie dimerów tubulinowych na końcu „+”
Mikrotubule
powstawanie mikrotubul
nukleacja
elongacja
stan równowagi
Mikrotubule
powstawanie mikrotubul w komórce
MT wyrastające z ośrodków nukleacji (centrosomu)
Mikrografia elektronowa:
A) pierścienie gama-tubulinowe
B) wyrastające pojedyncze Mt
Mikrotubule
centrosom
Mikrotubule
powstawanie mikrotubul w komórce
Mikrotubule
rozmieszczenie mikrotubul w komórce
D
A-fibroblast; B-komórka epitelialna; C- komórka epidermalna kukurydzy;
D- wić komórki eukariotycznej
Mikrotubule
dynamiczna niestabilność
Mikrotubule
dynamiczna niestabilność
Film
Modyfikowanie dynamicznej niestabilności mikrotubul
białka towarzyszące – MAP (microtubule associated proteins)
Film –
dynamika mt
Mikrotubule
białka towarzyszące – stabilizujące mikrotubule
- stabilizacja ( tau)
- wiązanie z innymi
elementami
(MAP2 -FA)
Mikrografia elektronowa
przekroju poprzecznego
wiązki Mt:
C) nadekspresja MAP2
D) nadekspresja tau
Mikrotubule
białka motoryczne - kinezyny i dyneiny
B) kinezyna
C) dyneina
cytoplazmatyczna
D) dyneina rzęskowa
Mikrotubule
białka motoryczne – nadrodzina kinezyn
200 białek
min 14 rodzin
Kinezyny
KRPs (kinesin
related proteins)
„kroczą” do
końca + Mt
(wyjątek Ncd)
Mikrotubule
białka motoryczne - kinezyny
Mikrotubule - białka motoryczne
kinezyna konwencjonalna (kinezyna 1)
• miejsce wiązania ATP
• miejsce wiązania do Mt
głowa
szyjka
trzonek 1
trzonek 2
Mikrotubule
białka motoryczne - kinezyny
Kinezyny:
kierunkowość ruchu
procesywność
(krok 8nm, 1 ATP)
Film
Cząsteczka GFP-kinezyny krocząca po mikrotubuli (0,3mm/s)
Mikrotubule
białka
motorycznedyneiny:
-cytoplazmatyczne
-rzęskowe
cząsteczki dyneiny
cytoplazmatycznej - 2µm/s
rzęskowej - 14µm/s
Rola mikrotubul
organizują wnętrze komórki - polaryzacja komórki
nadają polaryzację komórce
Film fibroblast
+nokodazol
rozmieszczenie organelli
ER
Golgi
Mt
Mt
organizacja ER, aparatu Golgiego
przemieszczanie mitochondriów
Filmy
transport wewnątrzkomórkowy
Mikrotubule zaangaŜowane
w transporcie:
• pęcherzyków z ER
do aparatu Golgiego (dyneiny)
• pęcherzyków z TGN do błony
komórkowej (kinezyny)
• pęcherzyków z aparatu
Golgiego do ER (kinezyny)
Rzęski i wici
13
13 + 10
13 + 10 + 10
rzęski,
wici
centriole,
ciałka
podstawowe
Rzęski, wici - budowa
szprycha
neksyna
9+2
wewnętrzna
otoczka
ramiona dyneiny
neksyna
ramiona dyneiny
• mają aktywność ATP-azy
• mogą przesuwać się
wzdłuŜ sąsiednich MT
Rzęski
dyneina rzęskowa
9-12 łańcuchów polipeptydowych
film
Ruch wici
Bicie rzęski
0,25µm;
5-10µm
niesymetryczne;
uderzenia batem












