Europejska Akademia
Pacjentów w obszarze
innowacyjnych
terapii
http://www.eupati.eu
Arkusz informacyjny: Podsumowanie koncepcji prawnych i przepisów prawa oraz
rola organizacji pacjenckich
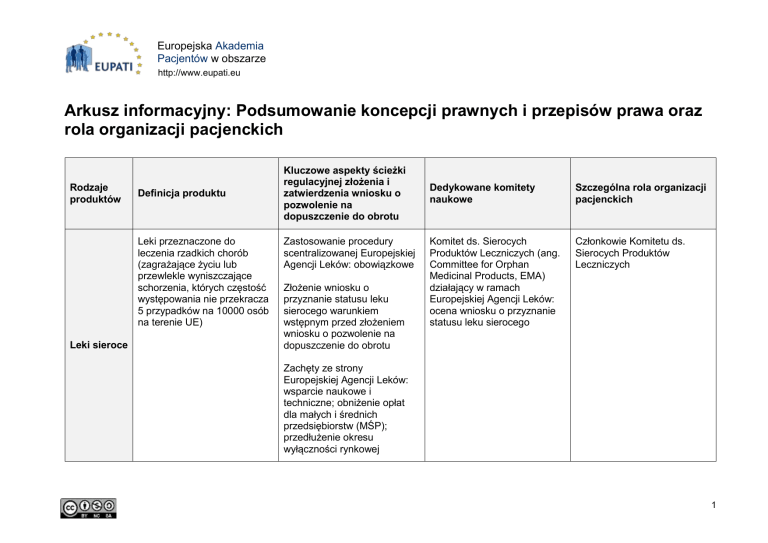
Rodzaje
produktów
Definicja produktu
Leki przeznaczone do
leczenia rzadkich chorób
(zagrażające życiu lub
przewlekle wyniszczające
schorzenia, których częstość
występowania nie przekracza
5 przypadków na 10000 osób
na terenie UE)
Leki sieroce
Kluczowe aspekty ścieżki
regulacyjnej złożenia i
zatwierdzenia wniosku o
pozwolenie na
dopuszczenie do obrotu
Zastosowanie procedury
scentralizowanej Europejskiej
Agencji Leków: obowiązkowe
Złożenie wniosku o
przyznanie statusu leku
sierocego warunkiem
wstępnym przed złożeniem
wniosku o pozwolenie na
dopuszczenie do obrotu
Dedykowane komitety
naukowe
Szczególna rola organizacji
pacjenckich
Komitet ds. Sierocych
Produktów Leczniczych (ang.
Committee for Orphan
Medicinal Products, EMA)
działający w ramach
Europejskiej Agencji Leków:
ocena wniosku o przyznanie
statusu leku sierocego
Członkowie Komitetu ds.
Sierocych Produktów
Leczniczych
Zachęty ze strony
Europejskiej Agencji Leków:
wsparcie naukowe i
techniczne; obniżenie opłat
dla małych i średnich
przedsiębiorstw (MŚP);
przedłużenie okresu
wyłączności rynkowej
1
Europejska Akademia
Pacjentów w obszarze
innowacyjnych
terapii
http://www.eupati.eu
Produkty
lecznicze
terapii
zaawansowanej
(ang. Advanced
Therapeutic
Medicinal
Products,
ATMPs)
Złożone leki wykonane z
genów, komórek bądź tkanek
(różne od konwencjonalnych
leków wytwarzanych z
substancji chemicznych lub
białek)
Proponują nowe podejście do
leczenia chorób i urazów (i
nie tylko chorób
genetycznych); są efektem
najbardziej zaawansowanych
badań naukowych
Zastosowanie procedury
scentralizowanej Europejskiej
Agencji Leków: obowiązkowe
Oprócz jakości,
bezpieczeństwa i
skuteczności stosowania
produktów leczniczych w
ocenie można również wziąć
pod uwagę kryteria
wynikające z natury
produktu:
tj. zagrożenia dla środowiska
Komitet ds. Terapii
Zaawansowanych (ang.
Committee for Advanced
Therapies, EMA) działający
w ramach Europejskiej
Agencji Leków: ocena
wniosku o pozwolenie na
dopuszczenie do obrotu
Członkowie Komitetu ds.
Terapii Zaawansowanych
Komitet Pediatryczny (ang.
Paediatric Committee,
PDCO) działający w ramach
Europejskiej Agencji Leków:
ocenia plan badań
pediatrycznych i wydaje
zwolnienie z planu badań
pediatrycznych
Członkowie Komitetu ds.
Terapii Zaawansowanych
Wymagana jest pełna
identyfikowalność
Zachęty ze strony
Europejskiej Agencji Leków:
zmniejszenie opłat
Leki stosowane u dzieci w
wieku od urodzenia do
poniżej 18 lat
Leki
pediatryczne
Zastosowanie procedury
scentralizowanej Europejskiej
Agencji Leków
Złożenie propozycji planu
badań pediatrycznych (ang.
Paediatric Investigation Plan,
PIP) warunkiem wstępnym
przed złożeniem wniosku na
poziomie Europejskiej
2
Europejska Akademia
Pacjentów w obszarze
innowacyjnych
terapii
http://www.eupati.eu
Agencji Leków (obowiązkowe
dla wszystkich nowych
produktów leczniczych)
Wniosek o pozwolenie na
dopuszczenie do obrotu musi
zawierać wyniki i informacje
wymagane w planie badań
pediatrycznych — z
wyjątkiem sytuacji, gdy
odstąpiono od planu badań
pediatrycznych tj. w
przypadkach, w których
produkt leczniczy ma być
stosowany w leczeniu
schorzeń niewystępujących u
dzieci
Zachęty ze strony
Europejskiej Agencji Leków:
konsultacje naukowe i
przedłużenie wyłączności
patentowej
Leki
generyczne
Leki opracowane w taki
sposób, aby były takie same
jak leki już dopuszczone do
obrotu — „leki referencyjne”
Zawierają takie same
substancje czynne jak leki
referencyjne i są podawane
Zastosowanie procedury
scentralizowanej Europejskiej
Agencji Leków (pod pewnymi
warunkami) lub
procedur narodowych i
innych
Nie określono komitetu
3
Europejska Akademia
Pacjentów w obszarze
innowacyjnych
terapii
http://www.eupati.eu
w takich samych dawkach do
leczenia takich samych
chorób
Ale mogą się różnić pod
względem składników
nieaktywnych, nazwy,
wyglądu, smaku
Dokumentacja wniosku: na
podstawie danych
dotyczących leku
referencyjnego oraz danych
biorównoważności leku
generycznego i
referencyjnego
Pozwolenia na dopuszczenie
do obrotu można udzielić po
upływie okresu wyłączności
leku referencyjnego
Leki
biopodobne
Leki opracowane w taki
sposób, aby były podobne do
leków biologicznych już
dopuszczonych do obrotu
(leki biologiczne to leki
złożone, wykonane lub
pochodzące ze źródła
biologicznego/żywych
komórek; mogą zawierać
krew i składniki krwi, terapie
genowe, tkanki i białka
Zastosowanie procedury
scentralizowanej
Europejskiej Agencji Leków
lub procedur
narodowych/innych
Pozwolenia na dopuszczenie
do obrotu można udzielić po
upływie okresu wyłączności
leku biologicznego
(odniesienia)
Nie określono komitetu, ale
Grupa Robocza ds.
Biopodobnych Produktów
Leczniczych (ang. Working
Party on Biosimilar Medicinal
Products, BMWP) działająca
w ramach Europejskiej
Agencji Leków przesyła
zalecenia do Komitetu ds.
Produktów Leczniczych
Stosowanych u Ludzi (ang.
Committee on Medicinal
Products for Human Use,
CHMP) i nawiązuje
współpracę z
zainteresowanymi stronami
Niektóre zainteresowane
strony we współpracy z
Grupą Roboczą ds.
Biopodobnych Produktów
Leczniczych
4










![Pismo przewodnie [DOC]](http://s1.studylibpl.com/store/data/001156315_1-5b4a18169e1331a13516a64d86d9ac9f-300x300.png)