Opracowanie hormonĂłw.doc
(933 KB) Pobierz
1. Lokalnie i zdalnie sterowana regulacja metabolizmu – mechanizmy
Regulacja lokalna dokonuje się za pośrednictwem dostępności poszczególnych
metabolitów. Natomiast w momencie, kiedy kształtuje się organizm wielokomórkowy,
poszczególne komórki w obrębie narządu i poszczególne narządy muszą się między sobą
kontaktować, aby metabolizm zachodził w sposób regulowany i zsynchronizowany. Do
tego potrzebna jest tzw. regulacja zdalnie sterowana. Zachodzi ona przy udziale 4
układów integrujących:
- układu dokrewnego
- układu immunologicznego
- układu nerwowego
- tkanki łącznej
2. Endo-, para-, i autokrynna droga przekazu informacji biologicznej.
Przekaz informacji w układzie endokrynnym dokonuje się na 3 głównych drogach:
1) droga endokrynna – przekaz informacji dokonuje się za pośrednictwem układu
krążenia. Musi istnieć komórka wyspecjalizowana, zwana komórką dokrewną,
która albo tworzy gruczoł wydzielania wewnętrznego (gruczoł endokrynowy),
albo jest to komórka w tzw. rozsianym układzie endokrynnym (APUD). Jej
wydzielina trafia do układu krążenia. Z krwią wydzielina ta przenoszona jest na
pewną odległość, a następnie opuszcza układ krążenia. Trafia na komórkę
docelową wyposażoną w receptor i poprzez ten receptor następuje zmiana
sygnału humoralnego na odpowiedź wewnątrzkomórkową metaboliczną
(molekularną) tej komórki. W takim ujęciu, substancja wydzielana nosi nazwę
hormonu.
2) droga parakrynna – substancja zostaje wydzielona przez odpowiednią komórkę,
a następnie działa na komórki docelowe bez pośrednictwa układu krążenia, a
jedynie za pośrednictwem płynu międzykomórkowego. Ta sama substancja może
działać w różnych warunkach na drodze endokrynnej i parakrynnej. Przykładem
jest interferon (w warunkach fizjologicznych działa na drodze parakrynnej,
stosowany jako lek – podawany drogą pozajelitową – działa na drodze
neurokrynnej).
3) droga autokrynna – komórka sama wydziela substancję i sama na nią odpowiada,
ponieważ wyposażona jest w odpowiedni receptor (zjawisko to nosi nazwę
sprzężenia zwrotnego dodatniego). W warunkach prawidłowych jest to komórka
embrionalna. W warunkach patologicznych taki mechanizm „błędnego koła”
występuje w komórkach nowotworowych.
3. Cytokiny – definicja pojęcia, podział, mechanizm działania, sterowane nimi
procesy.
4. Podział receptorów dla hormonów i cytokin.
Charakterystyka receptorów:
Ligandy
Agoniści 100% IA
Superagoniści >100%IA
Częściowi agoniści 0-100% IA
Antagoniści 0% IA
*IA-aktywność wewnętrzna. Stosunek efektu maksymalnego badanego liganda
do efektu wytwarzanego przez ligand naturalny (IA=100%)
Kd [M/I] –wyraża powinowactwo liganda do receptora- im mniejsze tym powinowactwo
większe.
Kd= k2/k1= [L][R]/[LR]
1. Podział ze względu na lokalizację:
Receptory jądrowe
Steroidy: estrogeny (ER α, β)
Progesteron (PR)
Androgeny (AR)
Lipofilne hormony niesteroidowe: 1,25-(OH)2- D3 (VDR)
Kwas all-trans retinowy (RAR α,β,γ)
Kwas 9 cis retinowy (RXR α,β,γ)
Kwasy tłuszczowe (PPAR α,β,γ)
Hormony tarczycy (TR α,β)
Receptory sieroce- brak znanego liganda
Klasy :
Homodimery- receptory dla steroidów : GR, PR, ER, AR, MR; łączą się z
sekwencjami palindromowymi
o Uważa się że forma wolna występuje w cytoplazmie
o Nieaktywne tworzą monomeryczne kompleksy z białkami opiekuńczymi
o Wiązanie liganda (agonisty lub antagonisty) uwalnia je i wywołuje
translokację jądrową
o Receptory typu CAR- postać wolna jest postacią aktywną, receptory dla
pochodnych steroidowych i ksenobiotyków, występują agoniści i odwrotni
agoniści receptorów
Heterodimery- receotiry dla hormonów tarczycy, retinoidów (RAR), wit. D (VDR)
i PPAR w połączeniu z RXR
Różne- receptory sieroce
Budowa:
Domena A/B – N-końcowa, activation function 1 (AF-1)- niezależna od liganda,
tkankowo specyficzna, podatna na alternatywny splicing
Domena wiążąca DNA (DBD)- wiąże HRE –element odpowiedzi na hormon
Region zawiasowy
Domena wiążąca ligand (LBD)- AF2- zależna od liganda
Domena F- C-końcowa, wysocezmienna sekwencja i długość; funkcje nieznane
Regulacja ekspresji genów
Zależna od liganda regulacja ekspresji genu- wiązanie liganda do hormonu
powoduje oddysocjowanie HSP, homodimeryzację, translokację do jądra,
wiązanie HRE
Niezależna od liganda represja transkrypcji genu (spoczynkowo wiązanie
korepresora); receptor niezależnie od występowania liganda jest w jądrze- RXR,
VDR, RAR
Spoczynkowo wiązanie korepresora, wiązanie liganda do receptora powoduje
oddysocjowanie, rekrutację koaktywatora i polimerazy, transkrypcja
Zależna od liganda transrepresja ekspresji genu-ER, PR; hamowanie receptora
poprzez wiązanie się z miejscem (domeną) wiążącym ligand (LBD)
Koaktywatory receptorów jądrowych:
Komplek Swi/Snf – ATP-zależne czynniki przebudowy chromatyny
Represja podstawowej ekspresji genów przez heterodimery RXR przy braku liganda:
Korepresory aktywowane przez receptory jądrowe-…
Korepresory jako adaptory czynników deacetylującyh-…
Terapeutyczne zastosowanie ligandów receptorów jadrowych:
PPARα- dyslipidemia, miażdżyca, zapalenie
PPARγ- cukrzyca, nadwaga, nowotwory, zapalenie, osteoporoza
LXR α/β- dyslipidemia, cukrzyca, miażdżyca
VDR- osteoporoza, łuszczyca, nowotwory, zapalenie, ch. Nerek
GR- zap. Stawów, astma, immunosupresja, nadwaga, cukrzyca
PR-antykoncepcja, nowotwory, osteoporoza
AR- rak prostaty, osteoporoza
ERα- rak piersi, osteoporoza, CVD, ch. Alzheimera
ERβ- rak prostaty, osteoporoza, nadwaga, CVD, ch. Alzheimera
RAR αβγ- nowotwory, łuszczyca
RXR αβγ- cukrzyca, nowotwory
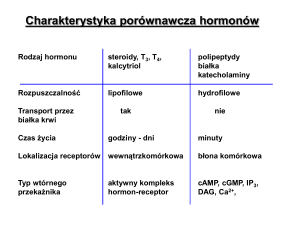
Receptory błonowe. Hormony polipeptydowe i katecholaminy; hormony rozpuszczalne
w wodzie
drugim przekaźnikiem jest cAMP;
drugim przekaźnikiem jest cGMP;
drugem przekaźnikiem jest jon Ca2+ lub (i) fosfatydyloinozytydy
przekaźnikiem jest kinaza lub kaskada kinaz
Typy:
receptory o aktywności kinazy tyrozynowej-katalityczne; związanie z ligandem
ujawnia aktywność kinazową receptora, fosforylacji ulega białko-substrat
receptora, np. receptor dla insuliny;
o domena pozakomórkowa- wiążaca ligand
o przezbłonowa
o wewnątrzbłonowa- o aktywności kinazy
Aktywacja:
o
cząsteczka sygnałowa wiąże się z dwoma receptorami, agregacja
receptorów i dimeryzacja
o tworzenie dimeru aktywuje wewnętrzną aktywność kinazy
o fosforyluje ona wewnętrzne tyrozyny (transfosforylacja)
o w ten sposób aktywowany receptor jest rozpoznawany przez białka
przekaźnikowe, co wywołuje zmianę ich konformacji
o aktywacja różnych dróg przekazywania sygnału
o nieprawidłowa agregacja i aktywacja bez ligandu -> niektóre nowotwory
receptory powiązane z kinazami tyrozynowymi
Aktywacja:
o związanie z ligandem ujawnia aktywność związanej z receptorem kinazy
(asocjacja enzymu)
o fosforylacji ulega białko-substrat kinazy tyrozynowej
o przykład: rec. Hormonów wzrostu (GH), cytokiny, prolaktyny
Receptorowe kinazy tyrozynowe:
EGFR, PDGFR, FGFR, IR
Niereceptorowe kinazy tyrozynowe:
o SRC, ABL, FAK, Janus
o Domena kinazowa
o Jedna lub więcej domen regulatorowych (SH2, SH3, PH)
receptory o aktywności cyklazy guanylowej, np. receptor ANP
o związanie z ligandem ujawnia aktywność cyklazową
o powstaje cGMP
Typy cyklaz guanylowych:
o
błonowe- związane z receptorami; domena zewnątrzbłonowa,
tranblonowa i domena homologiczna z cyklazą adenylową
o cytoplazmatyczne (rozpuszczalne)- hemoproteiny, hem jest sensorem
NO, CO, O2
receptory będące transporterami- część to receptory jonotropowe
o związanie z ligandem powoduje internalizację receptora wraz z ligandem
o ligand wewnątrzkomórkowo ujawnia swą aktywność
o nie są to typowe receptory dla hormonów
o np. transferyna i Fe
receptory związane z białkami G- metabotropowe (receptory 7TM)
o największa grupa receptorów
o związane są z białkami wiążącymi GDP
o białka te aktywują różne ścieżki sygnałowe
o np. receptory FSH, LH, TSH
o 7 domen przebłonowych – α-helisy zbudowane z aa hydrofobowych, pętle
wiążące poszczególne helisy mogące lączyć się mostkami disiarczkowymi
o Domena wewnątrzcytoplazmatyczna podlega prenylacji
o Toksyna krztuścca- rozprzęganie białek G z receptorami, wrażliwe
szczególnie podjednostki Gi
o
Toksyna cholery- rozprzęganie białek G z receptorami, wrażliwe
szczególnie Gs, synteza dużych ilości cAMP
o
o
o
o
Aktywacja:
Zmiana konformacji domen transbłonowych
Wymiana GDP na GTP podjednostki α białka G
Aktywacja podjednostki α
Dysocjacja aktywnej Gα z kompleksu Gβγ
Podjednostka Ga (20 różnych typów):
Gs (stimulatory Ga)
Gi (inhibitory Ga)
Go (związana z receptorami sierocymi (arphan))
Gt (transducyna w siatkówce, aktywacja fosfodiesteraz cGMP)
Podjednostka βγ
Typy białek G:
o heterodimeryczne (duże)
o małe, błonowe: rodzina białek RAS, 20-30 kDa
Do zakotwiczenia w błonie wymagają prenylacji, farnezylacji, palmitoilacji
itd.
o Białka Rac (-1,-2,-3)
o Białka Rho, Rab, Ran
o...
Plik z chomika:
miloszlo
Inne pliki z tego folderu:
1CYKL KREBSA.docx (8473 KB)
1WĘGLOWODANY.docx (5203 KB)
21Mocz.pdf (643 KB)
8. Lipidy.ppt (1834 KB)
atlas_moczu.pdf (3257 KB)
Inne foldery tego chomika:
Aminokwasy, puryny, pirymidyny
Biochemia Lipidy
biochemia_wyklady_2000-2001
ćwiczenia
Egzamin
Zgłoś jeśli naruszono regulamin
Strona główna
Aktualności
Kontakt
Dla Mediów
Dział Pomocy
Opinie
Program partnerski
Regulamin serwisu
Polityka prywatności
Ochrona praw autorskich
Platforma wydawców
Copyright © 2012 Chomikuj.pl