Diagnostyka genetyczna i poradnictwo genetyczne w onkologii
Dr n. med. Magdalena Badura-Stronka, Dr n.med. Małgorzata Stawicka-Niełacna, Prof.dr hab.med. Anna Latos-Bieleńska
Katedra i Zakład Genetyki Medycznej UM w Poznaniu
Poradnictwo genetyczne i diagnostyka genetyczna w onkologii
Cel:
Identyfikacja osób ze zwiększonym ryzykiem zachorowania na nowotwory złośliwe, wynikającym z wrodzonych predyspozycji
genetycznych
Obejmuje:
•
Analizę rodowodowo – kliniczną z interpretacją
•
Podstawową edukację pacjenta przed testem genetycznym
•
Wykonanie badań genetycznych i interpretację wyników
•
Określenie zaleceń profilaktycznych
•
Systematyczną kontrolę
Udział procentowy przypadków uwarunkowanych silną predyspozycją genetyczną wg lokalizacji narządowej
Rak piersi
10-20%
Rak jajnika
20-30%
Rak jelita grubego
5-20%
Rak endometrium
5%
Rak płuc
5%
Rak żołądka
10%
Rak prostaty
10%
Rak nerki
10%
Rak trzustki
10%
Cechy sugerujące dziedziczną postać nowotworu (szczególnie jeśli występują w kombinacji):
•
•
•
•
•
•
•
•
diagnoza nowotworów w młodszym wieku w stosunku do wieku średniego dla danego typu
wielokrotne nowotwory złośliwe w tym samym lub różnych narządach
zachorowania w kolejnych pokoleniach
nowotwory występujące nietypowo ze względu na korelację narządowo – płciową np. rak piersi u mężczyzn
stwierdzenie nowotworów rzadkich typów np. retinoblastoma, rdzeniasty rak tarczycy
obecność licznych charakterystycznych zmian przednowotworowych np. polipy w jelicie
zachorowanie pomimo braku działania głównych czynników ryzyka np. rak płuc u nie – palaczy
pacjent spełnia kryteria zespołu genetycznego, w przebiegu którego występują nowotwory
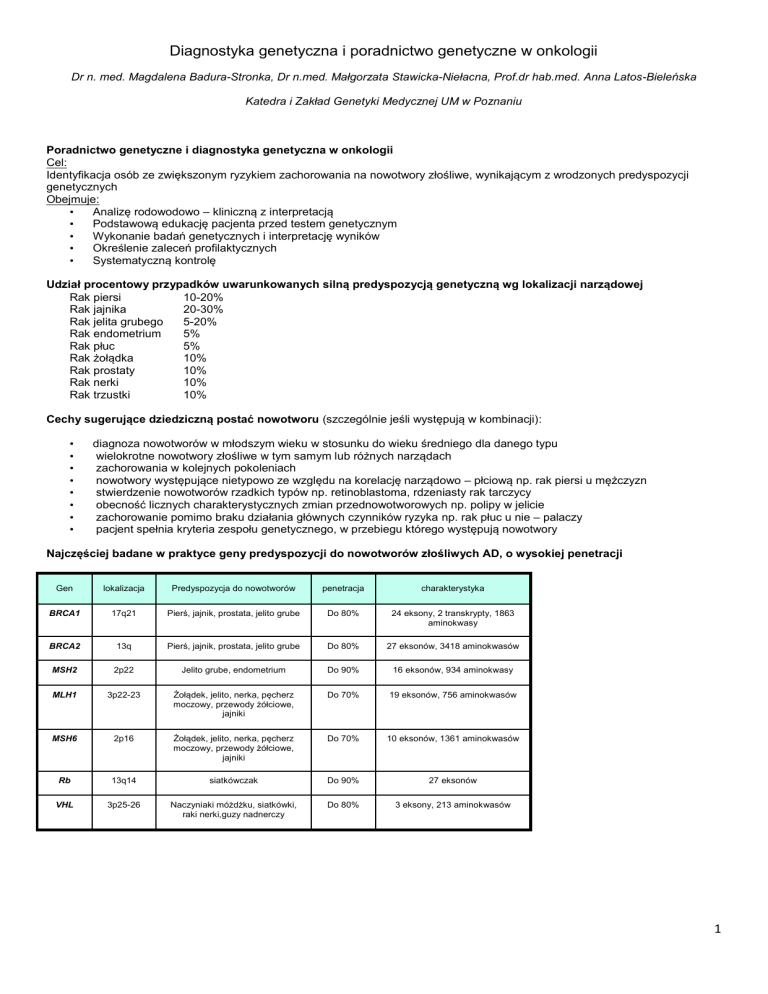
Najczęściej badane w praktyce geny predyspozycji do nowotworów złośliwych AD, o wysokiej penetracji
Gen
lokalizacja
Predyspozycja do nowotworów
penetracja
charakterystyka
BRCA1
17q21
Pierś, jajnik, prostata, jelito grube
Do 80%
24 eksony, 2 transkrypty, 1863
aminokwasy
BRCA2
13q
Pierś, jajnik, prostata, jelito grube
Do 80%
27 eksonów, 3418 aminokwasów
MSH2
2p22
Jelito grube, endometrium
Do 90%
16 eksonów, 934 aminokwasy
MLH1
3p22-23
Żołądek, jelito, nerka, pęcherz
moczowy, przewody żółciowe,
jajniki
Do 70%
19 eksonów, 756 aminokwasów
MSH6
2p16
Żołądek, jelito, nerka, pęcherz
moczowy, przewody żółciowe,
jajniki
Do 70%
10 eksonów, 1361 aminokwasów
Rb
13q14
siatkówczak
Do 90%
27 eksonów
VHL
3p25-26
Naczyniaki móżdżku, siatkówki,
raki nerki,guzy nadnerczy
Do 80%
3 eksony, 213 aminokwasów
1
Dziedziczny rak piersi i jajnika
Kryteria diagnostyczne dziedzicznego raka piersi i jajnika
A.
Trzy (diagnoza pewna)
3 krewnych dotkniętych rakiem piersi/jajnika rozpoznanym w dowolnym wieku
B. Dwa (diagnoza bardzo prawdopodobna)
1) 2 raki piersi lub jajnika wśród krewnych I stopnia (lub II stopnia przez mężczyznę)
2) 1 rak piersi i 1 rak jajnika w dowolnym wieku wśród krewnych I stopnia (lub II stopnia przez mężczyznę)
C) Jeden (diagnoza prawdopodobna)
1) Rak piersi poniżej 40 rż
2) Rak piersi obustronny, w tym jeden poniżej 50 rż
3) Rak piersi rdzeniasty lub atypowy rdzeniasty
4) Rak piersi i jajnika u tej samej osoby
5) Rak piersi u mężczyzny
6) Wczesne wystąpienie raka jajnika o dużym stopniu zaawansowania klinicznego
BRCA1
Epidemiologia dziedzicznego raka piersi w Polsce
Kiedy badania genetyczne bez względu na dane rodowodowo-kliniczne:
rak piersi <50 rż – mutacja BRCA1 u 9%
rak piersi w każdym wieku- mutacja BRCA1 u 5%
rak jajnika w każdym wieku- mutacja w BRCA1 u 14%
Cechy raków zależnych od BRCA1
•
Średni wiek w momencie rozpoznania raka piersi 42-45 lat
•
Średni wiek w momencie rozpoznania raka jajnika 54 lata
•
W 32% przypadków obustronne raki piersi
•
Szybkie tempo wzrostu guza
Skutki kliniczne mutacji w genie BRCA1
•
Ryzyko raka piersi 10x wyższe 50-80%
•
Ryzyko raka jajnika 30 - 40x wyższe 40%
•
Ryzyko raka jajowodu i otrzewnej – 10%
•
Ryzyko raków obustronnych, G3, rdzeniastych i atypowych rdzeniastych, ER i PR negatywnych,
•
Ryzyko raków jajnika III/IV stopniu FIGO
•
Ryzyko zależne od rodzaju mutacji (korelacje genotypowo – fenotypowe)
•
Niepełna penetracja (rola innych czynników genetycznych i pozagenetycznych)
BRCA1 a mutacje założycielskie
•
185delAG
populacja Żydów Aszkenazyjskich
•
5382insC
populacja polska, kraje bałtyckie, Żydzi Aszkenazyjscy
•
C61G
populacja polska
•
4153delA
populacja polska, rosyjska
•
2803delA
populacja holenderska
•
1675delA
populacja norweska
•
1135insA
populacja norweska
•
2800delAA populacja szkocka, irlandzka
•
Ex13 duplikacja populacja brytyjska
Profilaktyka raka piersi i jajnika u nosicielek
Piersi:
•
Badanie lekarskie 1x6 m-cy od 20-25 r.ż.
•
USG piersi 1x12 m-cy od 25 r.ż.
•
MMR 1x12 m-cy od 35 r.ż.
•
NMR 1x12 m-cy od 25 r.ż.
Narząd rodny:
•
USG dopochwowe 1x12 m-cy od 30-35 r.ż.
•
CA125 1x12 m-cy od 30-35 r.ż.
Profilaktyczne:
•
Adneksektomia przed menopauzą
•
Mastektomia
Rekomendacje dotyczące leczenia (cis-platyna w terapii przedoperacyjnej)
BRCA2
•
•
•
Częstość występowania mutacji jest zwiększona w rodzinach z rakiem piersi u mężczyzny (15%)
U nosicielki mutacji BRCA2 ryzyko wystąpienia raka piersi sięga 31-56% (średni wiek 52 lata)
Ryzyko wystąpienia raka jajnika sięga 11-27% (średni wiek 62 lata)
2
Rak jelita grubego
10-20% wysoka genetyczna predyspozycja
HNPCC – Zespół Lyncha
Zespół dziedzicznego nie związanego z polipowatością raka jelita grubego
5% wszystkich RJG
Mutacje w genach naprawczych DNA: MSH2, MLH1, MSH6, PMS2
Dziedziczenie autosomalne dominujące
Kryteria diagnostyczne wg ICG-HNPCC tzw kryteria amsterdamskie
predyspozycja do raka jelita grubego, cienkiego, endometrium, układu moczowego
Kryteria diagnostyczne HNPCC susp.
HNPCC – ryzyko nowotworzenia:
•
Rak jelita grubego – 75% w wieku 75 lat (średni wiek diagnozy 45 lat)
•
Rak trzonu macicy – 40% kobiet z HNPCC
•
Rak jajnika <10% kobiet z HNPCC
HNPCC – kryteria amsterdamskie:
•
U co najmniej 3 członków rodziny wykryto nowotwór związany z HNPCC (rak jelita grubego, rak endometrium, rak jelita
cienkiego, rak dróg moczowych)
•
Jeden z nich jest krewnym I stopnia dwóch pozostałych
•
Chorują 2 kolejne pokolenia
•
Przynajmniej u jednej osoby nowotwór był zdiagnozowany <50 rż
•
Wykluczono FAP
•
Nowotwory zostały zweryfikowane histopatologicznie
Zalecenia profilaktyczne u nosicieli mutacji w genach MSH2/MLH1
Kolonoskopia z polipektomią
od 25 r.ż. co 2 lata
U kobiet USG przezpochwowe
od 35 r.ż. co 1 rok
FAP – Familial adenomatus polyposis of colon, rodzinna polipowatość gruczolakowata jelita grubego
1% wszystkich raków jelita grubego
Mutacje w genie supresorowym APC oraz MUTYH
Dziedziczenie autosomalne dominujące (APC) lub recesywne (MUTYH)
Zespół Gardnera – forma FAP
z charakterystycznymi objawami pozajelitowymi (torbiele gruczołów łojowych skóry, kostniaki, włókniakowatość naciekowa, zmiany
w uzębieniu) obraz kliniczny związany jest z położeniem mutacji APC
AAPC – łagodny FAP (attenuated adenomatous polyposis coli) – lokalizacja mutacji w APC na końcu 5’
Zespół Peutz-Jeghersa
1/2-1/3 to nowe mutacje w genie STK11
Objawy:
•
polipy przewodu pokarmowego (każdy odcinek)
•
przebarwienia na błonach śluzowych jamy ustnej, odbytu, narządów płciowych, na skórze dłoni, stóp
•
Rak jelita cienkiego – ryzyko 500x większe niż w populacji ogólnej
•
Rak żołądka – ryzyko 200x większe niż w populacji ogólnej
•
Rak trzustki (100x)
•
Rak jelita grubego (85x)
•
Rak przełyku (60x)
•
Rak jajnika (30x)
•
Rak trzonu macicy, sutka, płuc (15-20x)
•
•
•
•
•
•
•
•
•
Siatkówczak (retinoblastoma)
Najczęstszy nowotwór wewnątrzgałkowy u dzieci (1:25000 urodzeń żywych)
Objawy: leucokoria (biała źrenica, „kocie oko”), zez, wytrzeszcz
90% przypadków <5rż
Występuje sporadycznie lub dziedziczona jest predyspozycja do rozwoju nowotworu
Osoba predysponowana do rozwoju nowotworu odziedziczyła 1 zmutowany allel genu supresorowego Rb na
chromosomie 13q (wszystkie komórki organizmu mają tylko jeden prawidłowy allel genu Rb)
Drugi allel traci w wyniku mutacji somatycznej (zjawisko utraty heterozygotyczności – LOH)
Geny supresorowe wykazują więc efekt recesywny na poziomie komórkowym!
90% osób z mutacją konstytucjonalną jednego allelu genu Rb zachoruje!
Gen RB – 27 eksonów, brak typowych hot-spot, utrudniona diagnostyka
3
•
•
Zespół Li Fraumeni
Spowodowany dziedziczonymi mutacjami w genie supresorowym p53
Tendencja do występowanie od dzieciństwa mnogich nowotworów złośliwych:mięsaków, raka nadnercza, białaczek,
guzów mózgu, raka sutka, płuc, trzustki, gruczołu krokowego i in.
Zespoły genetyczne z predyspozycją do nowotworzenia, rozpoznawalne na podstawie cech klinicznych
Zespół Beckwith-Wiedemann: Przerost języka, duża masa urodzeniowa, hipoglikemia w okresie noworodkowym.
Asymetria ciała (przerost połowiczy), predyspozycja do nowotworów nadnerczy, OUN, nerek
(guz Wilmsa), konieczny monitoring onkologiczny – co pół roku USG jamy brzusznej, KT głowy.
Xeroderma pigmentosum
•
Inaczej: Skóra pergaminowata i barwnikowa
•
Częstość 1/70.000 urodzeń
•
Upośledzona naprawa DNA po uszkodzeniu promieniowaniem UV
•
Występują liczne raki skóry (kolczystokomórkowe, podstawnokomórkowe i czerniak) i bliznowacenie rogówki
Ataksja-teleangiektazja (zespół Louis-Bar)
•
W kariotypie rearanżacje chromosomowe, zwłaszcza w obrębie 7 i 14 pary
•
Łamliwość chromosomów nasila ekspozycja pacjenta na promieniowanie X
•
Mutacja w genie ATM, którego produkt jest zaangażowany w inicjację naprawy podwójnej nici DNA
•
1-2,5/105 żywo urodzonych, heterozygoty 1% populacji ogólnej
•
100 x wyższe ryzyko nowotworów układu chłonnego (!), rak skóry, żołądka, piersi, jajnika
Zespół Nijmegen
•
gen NBS1
•
Białko nibrin uczestniczy w naprawie uszkodzeń podwójnej nici DNA
•
Większość pacjentów pochodzenia słowiańskiego (Polacy, Czesi) – efekt założyciela
•
Cytogenetyka – aberracje struktury w 10-30% metafaz, zwykle w obrębie 7 i 14 pary chromosomów
•
Łamliwość chromosomów nasila ekspozycja pacjenta na promieniowanie X
•
Małogłowie
•
Niskorosłość
•
W 30% prawidłowy rozwój intelektualny
•
Typowy profil (cofnięte czoło, małożuchwie)
•
Podatność na infekcje
•
Nowotworzenie – częste chłoniaki z limfocytów B, medulloblastoma, glioma, rhabdomyosarcoma
Ogólnopolskie Programy Ministerialne:
Wczesnego wykrywanie nowotworów złośliwych w rodzinach wysokiego, dziedzicznie uwarunkowanego ryzyka zachorowania na:
•
Raka piersi i jajnika
•
Raka jelita grubego nie związanego z polipowatością i raka endometrium
•
FAP, VHL, Retinoblastoma
•
Rdzeniastego raka tarczycy
•
Dziedzicznego rozlanego raka żołądka
4