SYLABUS
1. PODSTAWOWE INFORMACJE O PRZEDMIOCIE/MODULE
1.1. Cechy przedmiotu/modułu
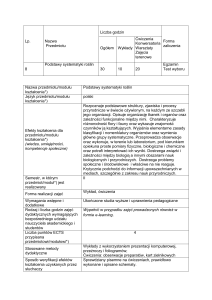
Nazwa przedmiotu/ modułu Podstawy chemii
Kod przedmiotu/ modułu*
Wydział (nazwa jednostki
prowadzącej kierunek)
Wydział Biologiczno-Rolniczy
Nazwa jednostki
realizującej przedmiot
Katedra Chemii i Toksykologii Żywności
Kierunek studiów
Odnawialne Źródła Energii i Gospodarka Odpadami
Poziom kształcenia
Pierwszy stopień
Profil
Ogólnoakademicki
Forma studiów
Stacjonarne
Rok i semestr studiów
I/1
Rodzaj przedmiotu
Obowiązkowy
Koordynator
dr hab. Maciej Balawajder
dr hab. Maciej Balawajder (w, ćw.)
dr inż. Radosław Jozefczyk (ćw.)
dr Anna Pasternakiewicz (ćw.)
* - zgodnie z ustaleniami na wydziale
Imię i nazwisko osoby
prowadzącej / osób
prowadzących
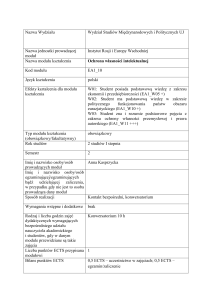
1.2. Formy zajęć dydaktycznych, wymiar godzin i punktów ECTS
Wykład
Ćwiczenia
Ćwiczenia
Konwersatoria
Seminarium Praktyki
audytoryjne
laboratoryjne
15
Zajęcia
terenowe
30
1.3. Sposób realizacji zajęć
X zajęcia w formie tradycyjnej
☐ zajęcia realizowane z wykorzystaniem metod i technik kształcenia na odległość
1.4. Forma zaliczenia przedmiotu/ modułu (z toku)
egzamin
2. WYMAGANIA WSTĘPNE
Chemia, fizyka, matematyka - zakres szkoły średniej
3. CELE, EFEKTY KSZTAŁCENIA , TREŚCI PROGRAMOWE I STOSOWANE METODY
DYDAKTYCZNE
3.1. Cele przedmiotu/modułu
Liczba
pkt
ECTS
5
C1
C2
C3
C4
C5
Poszerzenie wiedzy z zakresu występowania, budowy i właściwości związków
nieorganicznych i organicznych występujących w środowisku naturalnym i skażonym
Przygotowanie studentów do wykonywania prostych analiz chemicznych i posługiwania się
podstawowym sprzętem laboratoryjnym
Doskonalenie umiejętności w zakresie posługiwania się terminologią i nomenklaturą
chemiczną, zapisu równań reakcji chemicznych oraz wykonywania podstawowych obliczeń
chemicznych
Kształcenie umiejętności wyjaśniania zjawisk zachodzących w środowisku w oparciu o
podstawowe prawa i zjawiska chemiczne
Przygotowanie studentów do samodzielnego i zespołowego przeprowadzania doświadczeń
chemicznych.
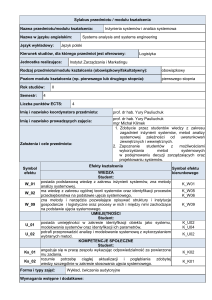
3.2. Efekty kształcenia dla przedmiotu/ modułu
EK (efekt
kształcenia)
EK_01
EK_02
EK_03
EK_04
EK_05
EK_06
EK_07
EK_08
Treść efektu kształcenia zdefiniowanego dla przedmiotu
(modułu)
Definiuje grupy związków chemicznych (nieorganicznych
i organicznych), zna ich wzory chemiczne i opisuje
podstawowe właściwości
Identyfikuje podstawowe substancje chemiczne występujące
w glebie, powietrzu i wodzie (naturalne i zanieczyszczenia)
Zapisuje równaniem chemicznym przebieg prostych
procesów chemicznych
Wie jak bezpiecznie zachować się w laboratorium
Wyciąga wnioski z przeprowadzonych eksperymentów
Wykonuje proste analizy chemiczne
Ma świadomość ryzyka i potrafi ocenić skutki wykonywanej,
działalności w zakresie szeroko rozumianego rolnictwa
i środowiska
Rozumie potrzebę ciągłego dokształcania się oraz
podnoszenia kompetencji zawodowych, osobistych,
społecznych i zdrowotnych
Odniesienie do
efektów
kierunkowych
(KEK)
K_W01
K_W01
K_W01
K_W07
K_W20
K_U14
K_U05
K_K02
K_K01
3.3. TREŚCI PROGRAMOWE
A. Problematyka wykładu
Treści merytoryczne
Podstawowe pojęcia i prawa chemiczne. Klasyfikacja pierwiastków w układzie okresowym.
Budowa atomu wg zasad mechaniki kwantowej. Wiązania chemiczne.
Klasyfikacja związków nieorganicznych: synteza i właściwości.
Równowagi fazowe. Roztwory, rozpuszczalność. Zjawiska powierzchniowe. Koloidy.
Procesy elektrochemiczne - zastosowanie ogniw, elektroliza, korozja metali.
Termodynamika reakcji chemicznych, reakcje odwracalne. Kinetyka reakcji chemicznych,
kataliza.
Klasyfikacja związków organicznych, grupy funkcyjne, przykłady związków.
Budowa i właściwości węglowodorów. Węglowodory jako źródła energii.
Organiczne zanieczyszczenia środowiska.
Inne związki organiczne występujące w przyrodzie - budowa biocząsteczek i ich
wykorzystanie w energetyce.
B. Problematyka ćwiczeń audytoryjnych, konwersatoryjnych, laboratoryjnych,
zajęć
praktycznych
Treści merytoryczne
Przepisy BHP obowiązujące w Pracowni Chemicznej. Zapoznanie się ze sprzętem i szkłem
laboratoryjnym. Obliczenia chemiczne: skład procentowy związku, obliczenia oparte
o stechiometryczne równanie reakcji chemicznej, wydajność reakcji.
Typy reakcji chemicznych: podział reakcji chemicznych, efekty cieplne reakcji,
przeprowadzenie przykładowych reakcji syntezy, analizy i wymiany; szybkość reakcji
chemicznych. Wpływ katalizatora.
Analiza jakościowa wybranych kationów i anionów: rozpuszczalność substancji w wodzie,
budowa i moc kwasów nieorganicznych, reakcje strąceniowe, wykonanie reakcji
charakterystycznych dla wybranych kationów i anionów, zapis równań reakcji w postaci
cząsteczkowej i jonowej.
Roztwory: rodzaje stężeń (obliczenia), sporządzanie roztworów o zadanym stężeniu.
Badanie właściwości fizycznych roztworów: dysocjacja elektrolityczna, pojęcie elektrolitu,
przebieg dysocjacji kwasów, zasad i soli hydroliza soli, badanie odczynu wodnych
roztworów związków nieorganicznych. Potencjometryczny pomiar pH mieszanin
buforowych: pojęcie pH, skala i obliczanie pH dla roztworów kwasów i zasad, sposoby
pomiaru pH, sporządzenie i badanie właściwości buforu octanowego.
Analiza miareczkowa: podstawowe pojęcia analizy miareczkowej, reakcje zobojętniania,
wykonanie oznaczenia alkacymetrycznego.
Procesy elektrochemiczne: reaktywność metali, korozja elektrochemiczna, ochrona przed
korozją.
Metody optyczne w analizie chemicznej: zjawisko absorpcji promieniowania, prawa
absorpcji, kolorymetryczne oznaczenie zawartości żelaza(III) w roztworze metodą krzywej
wzorcowej.
Podstawowe techniki rozdzielania i oczyszczania związków organicznych: destylacja.
ekstrakcja, krystalizacja, chromatografia; kontrola czystości rozdzielanych składników.
Węglowodory: podział i nazewnictwo węglowodorów, badanie składu chemicznego,
przeprowadzenie reakcji typowych dla alkanów, alkenów i arenów. Jednofunkcyjne
pochodne węglowodorów: alkohole, fenole: podstawowe właściwości oraz reakcje
otrzymywania.
Jednofunkcyjne pochodne węglowodorów: aldehydy, ketony, kwasy karboksylowe, estry budowa grup funkcyjnych, szeregi analogiczne, badanie wybranych właściwości.
Tłuszcze, środki powierzchniowo czynne: budowa i podział tłuszczów, badanie składu
chemicznego cząsteczki tłuszczu, otrzymywanie mydeł, porównanie właściwości mydeł
i detergentów.
Białka: budowa białek, struktura wiązania peptydowego, reakcje charakterystyczne
aminokwasów i białek (reakcja biuretowa), badanie charakteru amfoterycznego białka (pI),
właściwości koloidów białkowych (wysolenie), proces denaturacji (czynniki denaturujące).
Mono-, di- i polisacharydy: badanie właściwości redukujących cukrów, wykrywanie skrobi,
hydroliza kwasowa cukrów, badanie czynności optycznej cukrów.
Analiza jakościowa wybranych zw. organicznych metoda polarymetryczną.
Pracownia zaliczeniowa (odrabianie nieobecności, zaliczenia końcowe).
3.4. Metody dydaktyczne
Wykład: wykład z prezentacją multimedialną
Ćwiczenia: wykonywanie doświadczeń, praca w grupach, interpretacja uzyskanych wyników
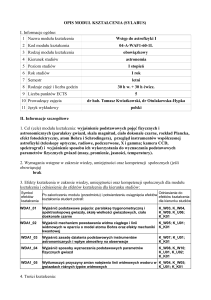
4. METODY I KRYTERIA OCENY
4.1. Sposoby weryfikacji efektów kształcenia
Symbol efektu
Metody oceny efektów kształcenia
( np.: kolokwium, egzamin ustny, egzamin pisemny,
projekt, sprawozdanie, obserwacja w trakcie zajęć)
EK_01
EK_02
EK_03
EK_04
EK_05
EK_06
EK_07
EK_08
Kolokwium pisemne, egzamin
Kolokwium pisemne, egzamin
Kolokwium pisemne, egzamin
Obserwacja ciągła
Kolokwium pisemne, odpowiedź ustna
Kolokwium pisemne, odpowiedź ustna, obserwacja
Odpowiedź ustna, obserwacja
Obserwacja
Forma zajęć
dydaktycznych (w,
ćw, …)
ćw, w
ćw, w
ćw, w
ćw
ćw
ćw
ćw
ćw
4.2. Warunki zaliczenia przedmiotu (kryteria oceniania)
Ćwiczenia: aktywne uczestniczenie we wszystkich zajęciach laboratoryjnych; ocenianie ciągłe,
pozytywne zaliczenie kolokwiów cząstkowych, ocena ustalona w oparciu o średnią
arytmetyczną ocen cząstkowych, przy <50% ocen pozytywnych poprawa w formie kolokwium
zaliczeniowego z całości materiału
Wykład: egzamin pisemny z pytaniami otwartymi (w tym równania reakcji i obliczenia)
Warunkiem zaliczenia przedmiotu jest osiągnięcie wszystkich założonych efektów kształcenia.
O ocenie pozytywnej z przedmiotu decyduje, po uzyskaniu zaliczenia z ćwiczeń liczba
uzyskanych punktów z egzaminu (>50% maksymalnej liczby punktów): dst 51-65%, dst plus
66-75%, db 76-85%, db plus 86-95%, bdb 96-100%
5. CAŁKOWITY NAKŁAD PRACY STUDENTA POTRZEBNY DO OSIĄGNIĘCIA ZAŁOŻONYCH
EFEKTÓW W GODZINACH ORAZ PUNKTACH ECTS
Aktywność
Liczba godzin/ nakład pracy
studenta
godziny zajęć wg planu z nauczycielem
45
przygotowanie do zajęć
43
udział w konsultacjach
5
przygotowanie do egzaminu
30
udział w egzaminie
2
SUMA GODZIN
125
SUMARYCZNA LICZBA PUNKTÓW ECTS
6. PRAKTYKI ZAWODOWE W RAMACH PRZEDMIOTU/ MODUŁU
wymiar godzinowy
zasady i formy odbywania praktyk
-
5
7. LITERATURA
Literatura podstawowa:
1. Dżugan M., Kisała J., Pasternakiewicz A. Chemia dla kierunków przyrodniczych. Część 1.
Chemia ogólna i analityczna, Wyd. Uniwersytetu Rzeszowskiego, Rzeszów. 2011.
2. Balawajder M., Droba M., Droba B. Chemia dla kierunków przyrodniczych. Część 2. Chemia
organiczna-ćwiczenia laboratoryjne, Wyd. Uniwersytetu Rzeszowskiego, Rzeszów. 2012.
3. Kisała K., Pogocki D. Podstawy instrumentalnych metod analitycznych dla
studentów kierunków przyrodniczych. , Wyd. Uniwersytetu Rzeszowskiego, Rzeszów. 2013.
Literatura uzupełniająca:
1. Fiszer J., Arnold J. R. P.Krótkie wykłady. Chemia dla biologów. Wyd. Naukowe
PWN, Warszawa. 2008.
2. Cox P. A. Krótkie wykłady. Chemia nieorganiczna. Wyd. Naukowe PWN, Warszawa. 2003.
3. Patrick G. Krótkie wykłady. Chemia organiczna. Wyd. Naukowe PWN, Warszawa. 2004.
4. Whittaker A. G. , Mount, A. R., Heal, M. R. Krótkie wykłady. Chemia fizyczna.
Wyd. Naukowe PWN, Warszawa. 2003.
Akceptacja Kierownika Jednostki lub osoby upoważnionej