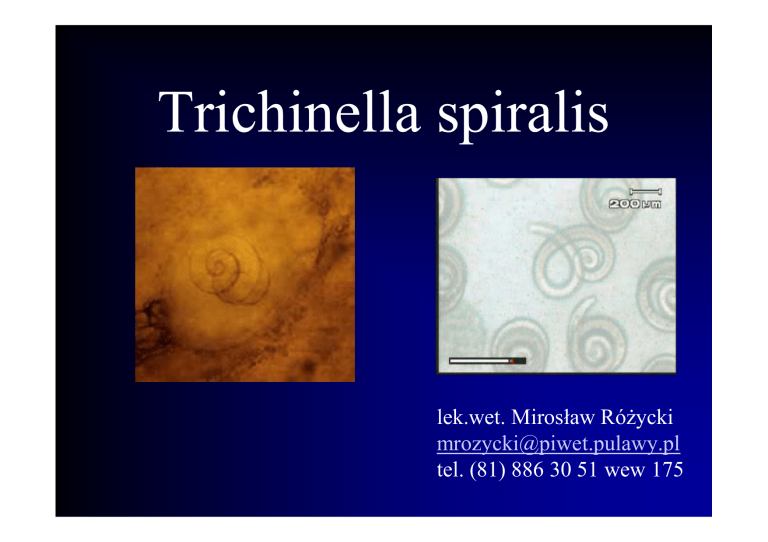
Trichinella spiralis
lek.wet. Mirosław Różycki
[email protected]
tel. (81) 886 30 51 wew 175
„Epidemiology of Trichinella spiralis in wild boars and pigs in Poland.”
“Epidemiologia i wystepowanie Trichinella spiralis w populacji świń i dzików na terenie Polski.”
Miroslaw Różycki
Department of Hygiene of Food of Animal Orygin
National Veterinary Research Institute
Występowanie włośnicy w populacji świń w 2001
Poland has long established practice in examination of pigs against Trichinella spiralis, reefer
back to the end of XIX century. Presently trichinoscopic and digestive examinations are
conducted on all slaughtered pigs, hores and hunted wild-boars. Examinations are compulsory
even if the slaughter takes place at home and the pork is for owner's use only. In the period
between the war's average of infected pigs was 0,055%. The highest percentage of infected
animals occurred in Bialystok region (plenty of forests and close to the former Russian border
were trichinosis occurred more often than in Poland). Dates from the period 1947-1957
includes 67 966 534 examined pigs and the percentage of infected with trichinellosis animals
was 0,025%. These results are twice lower than compared with the period between the wars.
Recently our veterinary sanitary inspection has examined in the period 1985-2000 over
190000000 animals and the percentage of infected animals was 0,0023%
Current epidemiological situation.
The data of investigations show that both synanthropic and natural focuses of trichinellosis
occur in Poland. Trichinellosis was diagnosed in domestic pigs (Sus domestica) and wild boars
(Sus scrofa). In 2001 were diagnosed 54 042 sample of wild boar meat (by the artificial
digestion) and 16 118 068 pig meat samples. Trichinella spiralis occurs in 105 samples of wild
boars and 45 of pigs.
Trichinellosis occurs in 13 of 16 wojewodaships.
Trichinellosis of pigs occurs in 9 wojewodaships and mean infection rate was 0.000709
The highest prevalence of trichinella spiralis in pigs was observed in Zachodniopomorskie
wojewodaship (0.00676).
Trichinellosis of wild boars occurs in 9 of 16 wojewodaships the mean infections rate was 0,15.
The highest prevalence of Trichinella spiralis in wild boars was observed in Lubelskie
wojewodaship (0.5).
Interesting information can be found after the comparison of map of Trichinella prevalence in
pigs, wild boars and map of forests in Poland. After the preparation of map of trichinella
prevalence in pig and wild boars it was observed that the regions with highest prvelance of
trichinnelosis in wild boars did not refer to the high prevalence of pig trichinellosis. In
comparison with map of forestry it was observed that wild-boars trichinellosis occurs more
often in region with large forest. This has no transfer to pig trichinellosis. The aim of the next
study will be find correlation between existing large pig farms and trichinella spiralis prevalence
Występowanie włośnicy u świń:
1. Zachodniopomorskie - 0.002611%
2. Pomorskie - 0,000279%
3. Warmińsko-Mazurskie - 0.000196%
4. Podlaskie - 0.000212%
5. Lubuskie - 0.000816%
6. Wielkopolskie - 0.000051%
7. Kujawsko-Pomorskie - 0.00676%
8. Mazowieckie - 0,000324%
9. Dolnośląskie - 0.%
10. Opolskie - 0%
11. Łódzkie - 0,0001%
12. Śląskie - 0%
13. Świętokrzyskie - 0%
14. Lubelskie - 0.%
15. Małopolskie - 0 %
16. Podkarpackie - 0. %
0%
0 - 0,0002%
0,0002- 0,0003%
>0,0003%
Występowanie włośnicy w populacji dzików
Rozmieszczenie obszarów leśnych z podziałem na
województwa
0%
0-0,15%
1,5-0,3%
>0,3%
Rys Historyczny
• On zakazał wam tylko: padliny,
krwi i mięsa wieprzowego i tego co
zostało złożone na ofiarę czemuś
innemu niż Bogu..."Koran, 2:172
• 422r pne. opis zachorowań wśród
Kartaginczyków w czasie wojny z Sycylią
• James Paget 02.02.1835
• Richard Owen 06.02. 1835
Pierwsze rysunki T.spiralis
Rys historyczny
• Saksonia - Hested
158zach./27zgonów
• Hedersleben
337zach/101zg.
• Virchow, Leukert,
Zenker,
Kuchenmister 1863
urzędowe badanie
mięsa w kierunku
włośnicy metodą
kompresorową
Strona tytułowa pracy
Virchowa nt. włośni
Jeden z pierwszych
trichinoskopów
Virchow przy pracy
Rys Historyczny
• 1881Glazier analiza retrospektywna lata
1860-1877 - 3044zach./231zg.
• 1865 Samter pierwszy opis włośnicy w
Polsce w Poznaniu
• 1865 Rudniew - pierwszy opis włośnicy w
Rosji
• 1879 obowiązek badania na terenie
Wielkopolski
Rozwój wiedzy o włośnicy w
ostatnim 50-leciu
Badania nad
rozprzestrzenieniem
zoogeograficznym
pasożyta
Rozwój wiedzy o włośnicy
w ostatnim 50-leciu
• Badania nad taksonomią T.spiralis
• Określenie i charakterystyka antygenów
T.spiralis
• Immunodiagnostyka
włośnicy
Rozprzestrzenienie
T.spiralis
• Arktyka 1956 Rausch
• Afryka Gretillat, Vasilliadis, Forester
1961, Nelson, Kozar- T.Nelsoni
• 1972 Britov i Bojew wyodrębnili 3 gat.
T.spiralis
• T.pseudospiralis Garkavi 1972 /Dagestan
Kaukaz/ w mm. szopa pracza
Antygeny T. spiralis
• Antygen powierzchniowy z stichocytów
ziarnistości α wydalany przez przełyk
• Antygen wydzielniczo-wydalniczy E/S ze
• stichocytów ziarnistości α głównie larwy
inwazyjnej.
• Masa cząsteczkowa 40 -50
49
kDa
53
Występowanie T.spiralis
• Włośnica występuje na wszystkich
kontynentach za wyjątkiem Australii.
• Włośnie występują jako pasożyty ludzi i
zwierząt, na Grenlandii i w Afryce,
atakują ponad 149 gatunków ssaków a
Trichinella pseudospiralis atakuje
również ptaki.
• W Europie jedynie Dania i Holandia
uważane są za kraje wolne od włośnicy.
Włośnica w Europie w 2004
• 270 przypadków włośnicy u ludzi z tego 172 w Polsce
Choroba wystąpiła w 9 krajach:
Dania - 9 przypadków
Francja - 3
Hiszpania - 33
Litwa - 22
Łotwa - 24
Niemcy - 5
Słowacja - 1
Szwecja - 1
Polska - 172
W całej Europie wyników dodatnich od dzików 460 z tego
w Polsce 240.
Włośnica w Polsce
• Intensywność inwazji włośnicy w
Polsce w populacji świń wynosi średnio
0,002516%,
Włośnica w Polsce
• Intensywność inwazji włośnicy w
Polsce w populacji świń latach 19851995 wynosiła średnio 0,002516%,
• W 2000r stwierdzono 0,000471%????
• W 2004 stwierdzono
29 przypadków na
19,8 mln zbadanych
świń
35
30
25
20
15
10
5
0
1
2
3
4
5
6
7
8
9
10 11 12 13
Serie1
Włośnica dzikich zwierząt
• w latach 70-tych
włośnie
stwierdzano w
1,3% populacji
lisów , 7,3 %
populacji wilków
oraz
2,9%borsuków
Włośnica świń
• Włośnie krążą w
dwu środowiskach.
Środowisku zwierząt
dzikich i zwierząt
przydomowych w
sprzyjających
warunkach dochodzi
do zazębienia się
środowisk.
Włośnica dzików
• Intensywność
inwazji włośnicy w
populacji dzików
0,375%
60
50
w y stę p o w a n i e w ł o śn i c y u d z i k ó w w l a ta c h
1 9 8 4 -1 9 9 5
40
30
Serie1
0 ,6
20
0 ,4
l
S e r ia 1
0 ,2
10
0
1
0
1
2
3
4
5
6
7
8
9 10 11 12 13 14
2
3
4
5
6
7
8
9
la t a 1 9 8 4 - 1 9 8 5
10 11 12 13
• W ostatnich latach w Polsce
zaobserwowano wzrost ilości
przypadków włośnicy w populacji
dzików /lepsza diagnostyka, większa
świadomość zagrożenia,/
• Wzrostowi ilości przypadków włośnicy
towarzyszy spadek ilości włośni/1g
badanego mięsa
Włośnica świń i dzików
Powiązanie ilości przypadków włośnicy u
dzików i świń
1
0,1 1 2 3 4 5 6 7 8 9 10 11
0,01
0,001
0,0001
dziki
świnie
• Analizując rozmieszczenie występowania
włośnicy dzików i świń obserwuje się
nakładanie się obszarów występowania
włośnicy wzdłuż dużych obszarów leśnych.
• Niepokojącym jest wzrost ilość przypadków
włośnicy o niskim stopniu intensywności
inwazji w populacji dzików.
• Oznacza to że pasożyt krąży w środowisku
zwierząt dzikich i staje się trudniej
wykrywalny tradycyjnymi metodami
badawczymi.
Włośnica na Białorusi
• Stałe regiony krążenia włośni: Mińsk,
Mohylew, Homl ,Grodno
• 3% badanych dzików wykazywało włośnicę
• Główne źródło włośnicy u ludzi to dziki
• Brak danych dotyczących występowania
włośnicy u świń
• W ciągu ostatnich 20 lat
Włośnica
odsetek dzików zarażonych
Litwie
włośnicą wzrósł z z 0,3% do
1,18%
20
18
• Głównym rezerwuarem
16
14
włośnicy są zarażone
12
bezdomne psy -18,3%
10
8
• psy domowe - 9%
6
• Odnotowano wzrost liczby 4
zarażonych świń z 0,001 do 20
1980 2000
0,05%
na
włośnica dzików
włośnica świn
w. U bezdomnych
psów
w. U psów
domowych
Ogniska włośnicy-charakterystyka
• Krąg rodziny 10-20 osób
• Czasem duże rozprzestrzenienie geograficzne
/Mosina/
• Ciężki przebieg
• Domowy ubój, kłusownictwo,
• Mięso nie badane w kierunku włośnicy
• Zwyczaje kulinarne /k. metka, k. biała /
Ogniska włośnicycharakterystyka
• Epidemie włośnicy /zakłady produkcyjne/
• Świnie z niskim stopniem intensywności
inwazji (mała liczba T.spiralis w mięśniach)
mogą zostać włączone w cykl produkcyjny.
• Duża liczba osób dotkniętych włośnicą.
• Przebieg zachorowań łagodniejszy (objawy
bywają mylone z grypą).
Czynniki kształtujące charakter
wystąpienia włośnicy
•
•
•
•
•
Stopień rozwoju larw (otorbione +/-).
Typ genetyczny Trichinella
Stopień intensywności inwazji włośnicy.
Swoista odporność organizmu na zakażenie
Wiek osób u których stwierdzono
wystąpienie włośnicy
• Zwyczaje kulinarne.
Wiadomości
•
ogólne
Gromada nicienieNematoda
• Podgromada
Aphasmida
• Rodzina Trichinellidae
37h po spożyciu
24h po spożyciu
7h po spożyciu
Dorosła samica włośnia z nb larwami
Dorosły samiec
Samiec
• Długość 1,5-1,6 mm
• Pojedyncze jądro i nasieniowód
zakończony pęcherzykiem nasiennym
• Szczecinki kopulacyjne (2) w okolicy
kloaki
Samiec
Szczecinki kopulacyjne
Pojedyncze jądro
i nasieniowód
Długość 1,5-1,6 mm
Samica
•Długość 3,0-4,8 mm
•Pojedynczy jajnik w tylnej cz. ciała
•Macica w której znajdują się liczne jaja
• Zbiornik nasienny
•Po 72h od zapłodnienia zaczynają
rodzić żywe larwy/ 5 dzień od spożycia/
Samica
Długość 3,0-4,8 mm
Samica
częciowo
wypełniona
młodymi
larwami
Samica, samiec i nowo urodzone
larwy
Nowo urodzona larwa
• Długość 100120µm
• Średnica 6µm
• Sztylecik
• mieści się w świetle
naczyń
krwionośnych
Larwa wędrująca
• Długość 8001300µm
• Średnica 30 - 40µm
• Sztylecik
Larwa włośnia wnikająca do komórki mięśniowej
Samica T.spiralis i nowonarodzone larwy
Larwa otorbiona
• Torebka owalna o
średnicy 200µm
• Kompleks
nurse-cell
Gatunki włośnicy i rozmieszczenie
geograficzne
Trichinella spiralis sensu stricto
(T1)
• 6 specyficznych markerów allozymowych
• produkcja larw >90/72h
• otorbianie w mięśniach po16-37dniach od
zarażenia
• brak oporności na zamrażanie
• wysoka patogenność dla człowieka
• obszar występowania – kosmopolityczne
Trichinella nativa (T2)
•
•
•
•
•
•
2 markery allozymowe
produkcja larw 28-54/72h
otarbianie po 20-30dniach od zarażenia
wysoka oporność na zamrażanie
wysoka patogenność dla człowieka
obszar występowania – holoarktyczny
(Grenlandia, Ameryka Północna)
Trichinella britovi ( T3)
• jeden marker allozymowy
• produkcja larw 30-75/72h
• otorbianie larw po 24-42dniach od
zakażenia
• niska oporność na zamrażanie
• umiarkowana patogeniczność dla
człowieka ( brak doniesień o ciężkim
przebiegu lub zgonach)
• występowanie: Europa – klimat
umiarkowany / już w Polsce
Trichinella pseudospiralis (T4)
•
•
•
•
4 markery allozymowe
produkcja larw 40-60/72h
brak torebki w zarażonych mięśniach
patogeniczność dla człowieka
prawdopodobnie niska
(udokumentowany 1 przypadek)
• występowanie ptaki i dzikie ssaki
Trichinella nelsoni (T7)
•
•
•
•
•
4 markery allozymowe
produkcja larw 49-60/72h
brak oporności na zamrażanie
otorbianie larw 34-60 dni po zarażeniu
średni stopień patogenności dla
człowieka
• występowanie Afryka równikowa- dzikie
zwierzęta
Mięśnie lub narządy Świnie zarażone larwami w dawce :
200
1000
10
000
m. przepony
100%
100%
100%
mm. międzyżebrowe
75
365
33
m. żwacz
125
152
65
m. dwugłowy uda
75
89
46
m. trójgłowy
ramienia
m. lędźwiowy
większy
m. najdłuższy
lędźwi
m. płatowaty szyi
75
101
59
50
112
70
75
46
31
0
7
27
m. zginacz palcowy
powierzchowny
25
85
54
m. skośne brzucha
50
126
82
Ogon
20
3
5
Język
100
26
121
Przełyk
0
26
20
Rozmieszczenie
larw w
m. świni
Konina jako nowe źródło
włośnicy
Epidemia / rok
Włochy 1975
Liczba
osób
89
Pochodzenie
koniny
Jugosławia
Typ genetyczny
Britovi
Francja 1975
125
E. wschodnia
Britovi
Włochy 1984
13
Jugosławia
Britovi
Francja 1985
343
USA
T5
Francja 1985
396
E. wschodnia
Spiralis
Włochy 1986
161
E. wschodnia
Britovi
Francja 1991
21
USA
Spiralis
Francja 1993
538
Kanada
Spiralis
Włochy 1998
?
Polska ?
?
Polska?
Polska?
Inne wektory włośnicy:
•
•
•
•
•
Baranina - Chiny 1979
Mięso psów - Chiny 1982
Renifery - 1981 wykryto T. spiralis
Wielbłądy - 1961
Ptaki - 1990 T. pseudospiralis
Patogeneza włośnicy
• Złożony patomechanizm uwarunkowany
rozwojem 2 generacji pasożyta
• Faza jelitowa i mięśniowa
• odczyn nadwrażliwości typu I
• uwolnienie leukotrienów, prostaglandyny,
kinin uruchamia szereg reakcji
powodujących rozkurcz m.gładkich naczyń,
zwiększoną ich przepuszczalność
20h po zakażeniu
27h po zakażeniu
72h po zakażeniu
Patologia
narządowajelito cienkie
•
•
•
•
•
•
I etap rozwoju włośnicy
self-cure, naciek limfocytarny,
zaburzenie wydzielania sekretyny
zaburzenia czynności trzustki,
zaburzenia czynności ruchowej jelit
uszkodzenie nabłonka błony śluzowej
górnego odcinka jelita cienkiego
• biegunki do 65-69 dnia inwazji
CPK
ELISA
Antg ELISA
Eozynofilia
Zapalenie spojówek obrzęki
Gorączka
Bóle mięśni
Wymioty, biegunka
Okres rekonwalescencji w
zależności od nasilenia
Faza jelitowa
Migracja nb larw
Okres inkubacji
Druga faza
Patologia narządowa-narząd
wzroku
• obrzęki wokół oczu,
• zajęcie mięśni oczu,
• zmiany naczyniowe spojówek, błony
naczyniowej, siatkówki i nerwu
wzrokowego,
• zaburzenia akomodacji oka
• rzadko obecność larw
Zwiększona
przepuszczalność
naczyń
krwionośnych
Zmiany pod paznokciami
Patologia narządowa-układ
mięśniowy
• Dwa etapy: wnikania i rozwoju oraz
utworzenia torebki
• początek inwazji 5-6 dzień
• korelacja pomiędzy objawami klinicznymi a
narastaniem inwazji
mięśniowej
• wzrost liczby granulocytów
kwasochłonnych i
narastanie miana przeciwciał
Droga larwy wędrującej
- Larwa znakowana
radioizotopem
Włośnie w
mięśniach
Początek tworzenia sieci
naczyń krwionośnych
Początek zamierania larwy
włośni -8 lat od
momentu zarażenia
Patologia narządowa-układ
mięśniowy,rozmieszczenie larw
Mięśnie badane m.
wytrawiania
m. piersiowy
Liczba larw w 1g
Chory lat 42 Chory lat 48
355
m. międzyżebrowe
353
m. czworogłowy uda
338
m. dwugłowy ramienia
298
m. brzuchaty łydki
278
m. przepony
250
m. oka
277
m. języka
4050
2806
4900
Patologia narządowa-układ
nerwowy
• Wynaczynienia i około naczyniowe nacieki
• przy silnej inwazji przeniknięcie larw do tk.
mózgowej
• ogniska niedokrwienia
• zaburzenia psychiczne, senność i apatia
• obrzęk mózgu
Patologia narządowa-układ
sercowo-naczyniowy
• T. spiralis nie
zagnieżdża się w m.
sercowym
• angiomiositis
• nacieki komórkowe,
• zapalenie mięśnia
sercowego
• uwalniane kinazy są
przyczyną biochemicznego
uszkodzenia m. sercowego
Uszkodzenie m.sercowego
Immunodiagnostyka włośnicy
• Wykrycie antygenu krążącego IRMA
• wykrycie przeciwciał If test
immunofluorescencji, ELISA test
immunoenzymatyczny, CIA test inhibicji
kompetencyjnej, CIE immunoelektroforeza
przeciw prądowa
• wykrycie krążących kompleksów
immunologicznych KKI
Wartość i przydatność metod
immunodiagnostycznych
• Przydatne do badań epidemiologicznych
• Wysoka czułość
• Wartość diagnostyczna dopiero po ok.2tyg
od zakażenia
• PCR - b. wysoka czułość, wysoka cena
Technika
wytrawiania
Pobieranie próbek do badań
• W przypadku całych tusz świń domowych
pobiera się próbkę o wadze przynajmniej 1 g z
filaru przepony w przejściu do części
ścięgnistej. Można użyć specjalnych
szczypczyków do włośni pod warunkiem
• zagwarantowania dokładności między 1,00 a
1,15 g.
• W przypadku hodowlanych macior i knurów
pobiera się większą próbkę o wadze
przynajmniej 2 g
Brak filarów przepony
• W przypadku braku filarów przepony
pobiera się próbkę dwukrotnie większą – 2
g (lub 4 g w przypadku hodowlanych
macior i knurów) z części żebrowej lub
mostkowej przepony, lub z mięśni
żuchwowych, języka lub z mięśni
brzusznych.
Pobieranie próbek do badań (części mięsa)
• W przypadku kawałków mięsa pobiera się
próbkę o wadze przynajmniej 5 g z mięśni
prążkowanych,
• o małej zawartości tłuszczu oraz, w miarę
możliwości, z miejsca w pobliżu kości lub
ścięgien. Próbkę tego
• samego rozmiaru należy pobrać z mięsa,
które nie ma być dokładnie gotowane lub nie
jest przeznaczone
• do innych rodzajów przetwarzania
poubojowego.
•
Kawałki mięsa
• W przypadku zamrożonych próbek do analizy pobiera się
próbkę o wadze przynajmniej 5 g z mięśni
• prążkowanych.
• Waga próbek mięsa odnosi się do próbki mięsa
niezawierającej jakiegokolwiek tłuszczu i powięzi. Należy
• szczególnie uważać przy pobieraniu próbek mięśnia z
języka w celu uniknięcia skażenia warstwą
• wierzchnią języka, której nie można wytrawić, co może
uniemożliwić odczyt osadu.
Sprzęt i odczynniki
mikser Moulinette
AV4
- pepsyna o mocy 1:10000 NF
(państwowa receptura USA)
odpowiadającej 1:12500 BP
(farmakopea brytyjska),
lub 2000 FIP
(Francuskiej Federacji Farmacji);
Ważne : data ważności, certyfikat producenta,
temp.przechowywania
Y96
Sprzęt i odczynniki chemiczne do
metody wytrawiania zgodnie z :
• ROZPORZĄDZENIE KOMISJI (WE) NR
2075/2005 z dnia 5 grudnia 2005 r.
• ustanawiające szczególne przepisy dotyczące
urzędowych kontroli w odniesieniu do włosieni
• (Trichinella) w mięsie
Wagi
Wagi WPT są prostym i niezawodnym rozwiązaniem dla
precyzyjnego odważania. Standardowo każda waga WPT zasilana jest
napięciem sieciowym 220 V. Opcjonalnie wagi WPT mogą posiadać
wewnętrzne źródło zasilania w postaci akumulatora. Wagi te
posiadają zakres ważenia do 3 kg z dokładnością 0,1g;
Funkcje wag WPT:
- liczenie sztuk, ..>>>
- drukowanie wyników pomiarów na dowolnej drukarce poprzez RS
232C ..>>>
- kontrola +/- w stosunku do masy ustawionego wzorca wyrażona w
[g], ..>>>
Pepsyna
Preparat ze śluzówki wieprzowej.
Aktywność jest wyrażana proporcją wskazującą, ile
części wagowych albuminy jaja kurzego jest trawione
przez 1 część wagową pepsyny. Aktywność jest również podawana w
jednostkach FIP/g (Międzynarodowej Federacji Farmacji) i E/g.
- pepsyna o mocy 1:10000 NF (państwowa receptura USA)
odpowiadającej 1:12500 BP (farmakopea brytyjska),
lub 2000 FIP (Francuskiej Federacji Farmacji);
Ważne : data ważności, certyfikat producenta,
temp.przechowywania
Kwas solny
16 ml kwasu chlorowodorowego, 25%
Najlepszym rozwiązaniem ze względu na bezpieczeństwo
oraz prostotę przygotowania jest stosowanie kwasu solnego 25%
w plastykowych ampułkach
Producent Polskie Odczynniki Chemiczne POCH
opakowania a 8 i 16 ml 25% HCl
Woda
2 litry wody destylowanej lub wodociągowej
ogrzanej do temperatury 46 - 480 C
Folia aluminiowa 0.03mm
lub 0.02mm
nie folia śniadaniowa
Mieszadła
Strzałka pokazuje sondę termostatu
Mieszadło magnetyczne
z płytą grzejną sterowaną termostatem
zdolne utrzymać temperaturę w mieszaniny
trawiącej w zakresie 44-460C
1000 obr/min wystarcza dla 50g próbki
1600 obr/min wystarcza dla 100- 115g
próbki
Mieszadełka pokryte teflonem o długości
ok.5 cm (odpowiednie do typu mieszadła)
Sitka
• Średnica sitka 11cm
• Średnica oczek 180 µm
• Siatka stal chromo-niklowa
(nierdzewna)
• Obręcz stal nierdzewna lub
mosiądz
• Trwałe
• Nie wolno czyścić szczotkami
• Czyszczenie 30 min. w
TAK
roztworze trawiącym
NIE
Stożkowe rozdzielacze
separacyjne
W chwili obecnej na rynku dostępne są
jedynie rozdzielacze produkcji czeskiej
NIE
TAK
Cylindry miernicze o
pojemności 50 ml lub
próbówki wirówkowe
Baseny do zliczania larw lub
płytki Petriego
Basen do zliczania larw
wykonany z płyt akrylowych
o grubości 3 mm:
dno basenu ma wymiary
180 x 40 mm i jest podzielone
na kwadraty
Płytki Petriego (w przypadku stosowania mikroskopu
stereoskopowego) dno podzielone na kwadraty 10x10 mm
Trichinoskop z poziomym
stolikiem lub mikroskop
stereoskopowy lecz nie TPR -1
Tak
Obraz w trychinoskopie przed naprawą i po
naprawie
Warunki zatwierdzania
laboratoriów wg Dyrektywy
77/96
-Laboratoria uprawnione do badań mięsa na
obecność włośni muszą mieścić się tuż obok ubojni
świń.
-Próbki mięsa wymagane do badania muszą zostać
pobrane natychmiast po uboju i bezzwłocznie
przebadane w laboratorium dopuszczonym do
badania mięsa na obecność włośni.
Odczynniki
pepsyna o mocy 1:10000 NF
(państwowa receptura USA)
Pepsyna
odpowiadającej 1:12500 BP
(farmakopea brytyjska),
lub 2000 FIP
(Francuskiej Federacji Farmacji);
2 litry wody wodociągowej ogrzanej do 46 - 480 C
16 ml kwasu chlorowodorowego, 25%
Wykonanie
16 ± 0,5 ml kwasu chlorowodorowego dodaje się do zlewki o pojemności 3 litrów
zawierającej 2,0
litra wody z kranu podgrzanej do temperatury od 46 do 48 oC; w zlewce umieszcza
się pręt
mieszający, zlewkę umieszcza się na podgrzanej płytce grzewczej i zaczyna się
proces mieszania.
Dodaje się 10 ± 0,2 g pepsyny.
100 g próbek pobranych rozdrabnia się w malakserze.
Rozdrobnione mięso przenoszone jest do 3-litrowej zlewki zawierającej wodę,
pepsynę i kwas
chlorowodorowy.
Wkładkę mieszającą malaksera wielokrotnie wkłada się do zlewki z płynem
wytrawiającym,
a pojemnik malaksera jest przemywany niewielką ilością płynu wytrawiającego w
celu usunięcia
przyczepionych skrawków mięsa.
Proces mieszania
Mieszadło magnetyczne powinno być ustawione
tak, aby utrzymywało stałą temperaturę 44 do 460 C
płyn trawienny powinien wirować z wystarczająco
dużą szybkością, aby utworzyć głęboki
wir bez rozbryzgiwania;
płyn trawienny jest mieszany
przez 30 minut max.60
• Proces trawienia uważany jest za
zadowalający, jeżeli nie więcej
niż 5 % początkowej wagi próbki
• pozostaje na sicie.
• Płyn trawienny przelany przez
sito do lejka sedymentacyjnego;
• - płyn trawienny odstawia się w
lejku na 30
minut;
• po upływie 30 minut, próbka 40
ml płynu trawiennego zostaje
szybko przelana do cylindra
mierniczego lub do rurki wirówki
Sedymentacja
• próbkę 40 ml pozostawia się na 10 minut,
po czym odsysa się 30 ml płynu znad osadu
pozostawiając tylko 10 ml;
• pozostałe 10 ml osadu przelewa się do
basenu zliczania larw lub na płytkę
Petriego;
• potem cylinder mierniczy lub rurkę wirówki
płucze się 10 ml wody wodociągowej, którą
dodaje się do próbki w basenie zliczania
larw lub na płytce Petriego; potem próbka
jest poddawana badaniu za pomocą
trychinoskopu
lub
mikroskopu
stereoskopowego;
• Produkty trawienia powinny
być przebadane
bezzwłocznie.
• W żadnych okolicznościach
ich badanie nie powinno być
odkładane do następnego
dnia.
• Jeżeli produkty trawienia są mętne, albo nie
zostały przebadane w trakcie 30 minut od
ich przygotowania to próbkę 40 ml wlewa
się do cylindra mierniczego i odstawia na
10 minut. Po 10 minutach 30 ml supernatant
odsysa się, a pozostałe 10 ml uzupełnia do
30 ml wodą z kranu. Po kolejnych
10minutach, odsysa się 30 ml, a pozostałe
10 ml wylewa się na płytkę Petriego lub do
basenu dla zliczania larw.
• Cylinder mierniczy przepłukuje się 10 ml
wody i dodaje ten płyn na płytkę Petriego
W czasie badania !
• Jeżeli osad w czasie badania jest mętny, próbkę
przelewa się do kalibrowanego cylindra
• i uzupełniona wodą z kranu do objętości 40 ml, po
czym należy zastosować powyższą procedurę.
• Procedurę można powtórzyć od 2 do 4 razy aż do
osiągnięcia przez płyn przejrzystości
• wystarczającej do wiarygodnego odczytu.
Pula mniejsza od 100 próbek
• W miarę potrzeby można dodać do 15
próbek po 1 g /ogólna masa próbek nie
więcej niż 115g/
• więcej niż 15 próbek należy badać jako
próbę zbiorczą.
• Dla puli o ilości próbek poniżej 50, ilość
płynu trawiennego może być zmniejszona
do 1 litra.
Wyniki pozytywne lub wątpliwe
w próbie 100x1g
• z każdej świni powinna być pobrana
następna próbka o wadze 20 g. Próbki
20 g z pięciu świń mogą być połączone
i przebadane. W ten sposób zostaną
przebadane 20 próbek grupowych po
pięć świń.
Wyniki pozytywne lub wątpliwe
w próbie 5 x 20g
• Gdy wykryte zostaną włośnie w
określonej puli próbek z pięciu świń,
powinny być pobrane dalsze próbki o
wadze 20 g z każdej indywidualnej
świni, przy czym każda taka próbka
powinna być odrębnie przebadana
Identyfikacja gatunku włośni
• Próbki z pasożytami przechowuje się w 90 %
alkoholu etylowym w celu konserwacji i
identyfikacji na
• poziomie gatunku we wspólnotowym lub
krajowym laboratorium referencyjnym.
• Po zebraniu pasożytów należy odkazić płyny
dodatnie (płyn wytrawiający, ciecz sklarowaną
nad osadem,
• popłuczyny itd.) poprzez podgrzewanie do
temperatury przynajmniej 60 oC.
Warunki zatwierdzania
laboratoriów wg Dyrektywy
77/96
-Laboratoria uprawnione do badań mięsa na obecność
włośni muszą mieścić się tuż obok ubojni świń i, jeżeli
zakład nie posiada jeszcze takich urządzeń, które
pomogłyby spełnić pozostałe wymagania Dyrektywy
77/96 w krajach trzecich, muszą przynajmniej posiadać
dostępne następujące udogodnienia:
-Próbki mięsa wymagane do badania muszą zostać
pobrane natychmiast po uboju i bezzwłocznie
przebadane w laboratorium dopuszczonym do badania
mięsa na obecność włośni przy ubojni. Zabronione jest
wykonywanie tych badań poza ubojnią, w której
zwierzęta zostały poddane ubojowi.
Pomieszczenie do
przygotowywania próbek
• zamykane na klucz, odpowiednio
wyposażone pomieszczenie, przystosowane
do przygotowywania próbek; jego ściany
muszą być gładkie i muszą być wykończone
zmywalnym pokryciem w jasnym kolorze
lub farbą do wysokości 2 metrów.
Pomieszczenie musi być wyposażone
zgodnie z wymogami jednej ze
stosowanych metod badań;
•
w pokoju przygotowawczym,
odpowiedni sprzęt do mycia i
dezynfekowania rąk;
•
możliwie lodówki, w których można
przechowywać próbki;
• wodoszczelne, nierdzewne pojemniki, z
hermetycznie zamykanymi wiekami,
przeznaczone do zbierania próbek po
przebadaniu, zaprojektowane w ten sposób,
by zapobiec nieuprawnionemu usuwaniu
zawartości;
•
odpowiedni sprzęt do ochrony przed
szkodnikami (owadami, gryzoniami itp.)
Pomieszczenie do badania
• zamykane na klucz, odpowiednio
wyposażone pomieszczenie, które może
zostać zaciemnione w trakcie
przeprowadzania badania z użyciem
trychinoskopu
•
sprzęt zapewniający odpowiednią
wentylację i, jeśli to konieczne, sprzęt
klimatyzacyjny zapewniający, że
temperatura w pomieszczeniu nie
przekroczy +25oC;
Pomieszczenie do badania
• odpowiednie, naturalne bądź sztuczne
oświetlenie, które nie powoduje zmiany
kolorów; należy unikać bezpośredniego
operowania światła słonecznego;
Pomieszczenia do mycia i
dezynfekcji
• - wodoodporną wykładzinę podłogową,
odporną na gnicie i łatwą w utrzymaniu w
czystości i do dezynfekowania,
• - gładkie ściany, które do wysokości co
najmniej 2 m są wykończone zmywalnym
pokryciem w jasnym kolorze.
• Postanowienie to nie musi być stosowane
jeżeli laboratoria są wyposażone w duży,
odpowiednio podłączony zlew.
Przebieralnie, umywalnie i
łazienki oraz toalety
• umywalnie z gorącą i zimną bieżącą wodą,
zaopatrzone w materiały czyszczące i
dezynfekujące oraz jednorazowe ręczniki;
Ile prób można zbadać jedna
osoba?
W celu uniknięcia przemęczenia i jego
następstw,
personelowi
powinny
przysługiwać krótkie przerwy w ciągu
dnia pracy.
Czas badania minimum 1min ?(To trochę
za mało)
Wymagania w odniesieniu do
trychinoskopów
• 1. Prosta obsługa
• 2. Intensywność podświetlenia:
•
dokładne wyniki muszą być
możliwe do odczytania nawet w
pomieszczeniu niezupełnie zaciemnionym;
• - jako źródło światła należy wykorzystać
żarówkę typu “projector” o mocy 100W
(12V).
Powiększenie
• 3. Odpowiednie powiększenie:
•
normalne powiększenie robocze:
50 razy
•
powiększenie 80 do 100 razy w
celu oszacowania przedmiotów niewyraźnie
rozpoznawalnych w normalnych warunkach
roboczych.
Rozdzielczość
• 4. Rozdzielczość:
•
przy każdym powiększaniu
konieczne jest uzyskanie wyraźnego ostrego
obrazu definiowalnego koloru
• 5. Mechanizm przełączania:
•
każdej zmianie powiększenia
towarzyszyć musi automatyczne
dostosowanie jasności obrazu.
Kontrast
• 6. Zwiększanie kontrastu:
•
kondensor musi być wyposażony w
przesłonę umożliwiającą zwiększenie
kontrastu przy kontrolowaniu co
trudniejszych przypadków
•
przesłona musi być łatwa w obsłudze
(np. dźwignia kontroli na płaszczyźnie
trychinoskopu)
Ostrość
• 7. Łatwość ustawiania ostrości:
•
szybkie ustawianie ostrości przy
użyciu pierścienia;
•
precyzyjne ustawianie ostrości
dzięki użyciu dźwigni kontroli.
• 8. Regulacja napięcia:
•
po to, by można było ustawić
wymaganą jasność.
Mechanizm blokujący
• 9. Jednokierunkowy ruch kompresora:
•
automatyczny mechanizm
blokujący musi zapewnić, że kompresor
porusza się tylko w jednym kierunku, by
uniemożliwić przypadkowe
przemieszczenie się.
• 10. Swobodny widok ekranu projektora
Ekran projektora
11.
-
Ekran projektora:
średnica co najmniej 54 cm;
posiada dużą zdolność odbijania;
trwały;
może zostać rozebrany;
łatwy w czyszczeniu.
Znakowanie
• Mięso jest oznakowane znakiem jakości zdrowotnej,
• Przy badaniu kompresorowym oznakowane znakiem który
wyraźnie różni się od znaku jakości zdrowotnej, o którym
mowa w art. 5 ust. 1 lit. a) rozporządzenia
• (WE) nr 853/2004, oraz mięso jest bezpośrednio
• dostarczane konsumentowi końcowemu lub lokalnym
• przedsiębiorstwom handlu detalicznego zapewniającym
• dostawy dla konsumentów końcowych i mięso nie jest
używane do wytwarzania produktów, których proces
produkcyjny nie powoduje zniszczenia włośni
Szkolenie
• Właściwy organ zapewnia odpowiednie wyszkolenie
całego
• personelu uczestniczącego w badaniu próbek w celu
wykrycie
• włosienia oraz jego udział w:
• a) programie kontroli jakości testów używanych do
wykrywania włośni oraz
• regularnej ocenie procedur badania, rejestrowania
• i analizy stosowanych w laboratorium.
• a) w przypadku gospodarstw wymagania ustanowione
Mięso końskie
•Należy systematycznie pobierać próbki z tusz koni,
•dzików oraz innych hodowlanych i dzikich gatunków
zwierząt zagrożonych zarażeniem włosieniem w ubojniach
lub zakładach przetwórczych zwierząt łownych jako część
badania poubojowego. Nie należy przeprowadzać takiego
pobierania próbek w przypadku, gdy właściwe organy
ustaliły za pomocą oceny ryzyka, że zagrożenie
zakażeniem włosieniem danego hodowlanego lub dzikiego
gatunku jest znikome. Należy pobrać próbkę z każdej
tuszy, a następnie zbadać ją w laboratorium wyznaczonym