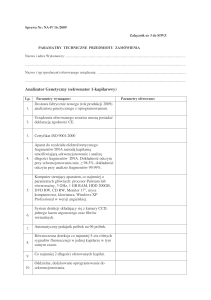
Praktyczne wykorzystanie urządzenia Blue Pippin
do przygotowywania wysokiej jakości bibliotek do DNA-Seq
Użytkownicy platform NGS w polskich laboratoriach cenią sobie możliwość automatyzacji
określonych etapów pracy podczas przygotowania bibliotek do sekwencjonowania. W ostatnim czasie
docierają do nas bardzo pochlebne opinie o elektroforetycznym systemie Blue Pippin (Sage Science).
Główne zalety tego urządzenia, podkreślane przez badaczy to:
Dostęp do kaset o różnej procentowości żelu zapewnia ogromną elastyczność jeśli chodzi o
zakresy wielkości bibliotek z jakimi chcemy pracować. Co za tym idzie możliwość dopasowania
ostatecznej wielkość biblioteki do konkretnej aplikacji i długości odczytów.
Nieskomplikowany sposób przygotowania próbek do frakcjonowania i ich odzyskania po elucji,
który pozwala na zmniejszenie nakładu pracy i oszczędność czasu.
Pracownicy Zakładu Genetyki Medycznej Uniwersytetu Medycznego w Warszawie, którzy
techniką NGS posługują na co dzień m. in. w celu identyfikacji genetycznych defektów powodujących
niedosłuch, choroby kardiologiczne oraz na potrzeby opisania genetycznego podłoża rozwoju
nowotworów, podzielili się z OpenExome swoimi doświadczeniami z użytkowania aparatu Blue Pippin.
Dr n med. Małgorzata Rydzanicz przykłada ogromną uwagę do jakości bibliotek, które mają zostać
poddane sekwencjonowaniu. Twierdzi, że przygotowanie biblioteki o prawidłowej wielkości i czystości
jest kluczowe nie tylko ze względu na jakość samego sekwencjonowania, ale również determinuje
ostateczny kosz sekwencjonowania pojedynczej próby. Nasza rozmówczyni zapytana o sens
stosowania etapu elektroforetycznego frakcjonowania fragmentów DNA w próbce odpowiada:
„Selekcja fragmentów przed wejściem w procedurę przygotowania bibliotek pozwala na ograniczenie
insertów DNA do ściśle określonej wielkości w bardzo wąskim zakresie, którego osiągnięcie przy użyciu
fragmentacji fizycznej (np. sonikacja) lub enzymatycznej (np. tagmentacja) jest niemal niemożliwe. W
przypadku kiedy obserwujemy w obrazach elektroforezy gotowych bibliotek obecność dimerów lub/i
konkatamerów adapterów ważne jest wyeliminowanie tych sekwencji przed właściwą reakcją
sekwencjonowania. Szczególnie niepożądane są dimery adapterów, które będą preferencyjnie
hybrydyzować do powierzchni komory przepływowej sekwenatora, a tym samym część
wygenerowanych klastrów nie będzie zawierała insertów DNA. Podobnie, kiedy zakres wielkości
przygotowanej biblioteki sugeruje obecność dużej frakcji o bardzo krótkich insertach (krótszych niż
zaplanowana długość odczytów), wyeliminowanie takich fragmentów pozwala na uniknięcie
sekwencjonowania adapterów”.
Dzięki uprzejmości prof. dr hab. med. Rafała Płoskiego, kierownika Zakładu Genetyki Medycznej WUM,
przedstawiamy przykłady praktycznego zastosowania elektroforezy preparatywnej na potrzeby
przygotowania wysokiej jakości bibliotek do diagnostycznych zastosowań DNA-Seq.
Application note SS_1_201503
Przykład nr 1
Celem była „poprawa profilu” przygotowanej uprzednio biblioteki całoegzomowej, poprzez
wyeliminowanie frakcji zawierającej bardzo krótkie inserty (zakres wielkości biblioteki 200-300 pz,
gdzie 180 pz to sekwencje adapterowe) oraz frakcji zawierającej długie fragmenty, a tym samym
zwiększenie kontroli nad jakością jej hybrydyzacji/klastrowania tej biblioteki na powierzchni komory
przepływowej sekwenatora HiSeq 1500 (reakcja sekwencjonowania w trybie sparowanych końców,
2x75 cykli).
A
C
A
B
B
A – Biblioteka całoegzomowa uzyskana z zastosowaniem zestawu Nextera Rapid Capture Exome
Enrichment Kit (Illumina), zakres wielkości 200-2000 pz.
B – Selekcja fragmentów w zakresie wielkości 380-420 pz z wykorzystaniem urządzenia Blue Pippin
(Sage Science). Nałożona ilość DNA 1000 ng, średnia wielkość bibliotek po selekcji fragmentów 390
pz. Kaseta żelowa 2% DF Marker V1.
C - Obraz po nałożeniu na siebie dwóch rożnych próbek, kolor czerwony – próbka A, kolor niebieski –
próbka B
Wielkość fragmentów analizowano z wykorzystaniem Bioanalyzer 2100 (Agilent), High Sensitivity
DNA Kit.
Application note SS_1_201503
Przykład nr 2
Celem pracy było przygotowanie DNA genomowego człowieka na potrzeby analizy NGS szlakiem
NebNext Ultra DNA Library Prep Kit for Illumina (New England of BioLabs). Pozyskiwano insert o
wielkości 1000 pz , a finalną bibliotekę sekwencjonowano w kierunku wykrywania zbalansowanych
aberracji chromosomowych. Właściwą reakcję sekwencjonowania prowadzono na platformie MiSeq
(Illumina) w trybie sparowanych końców (2x150 cykli).
A
D
A
B
B
C
C
A – 1 ug genomowego DNA poddano fragmentacji przy wykorzystaniu sonikatora Covaris M220,
docelowa wielkość fragmentów 800-1500 pz.
B – Selekcja fragmentów przed wejściem w procedurę konstruowania biblioteki genomowej. Za
pomocą urządzenia Blue Pippin (Sage Science) z pofragmentowanego DNA wyselekcjonowano
fragmenty w zakresie wielkości 900-1400 pz, średnia wielkość fragmentów 1100 pz. Nałożono 800 ng
DNA. Kaseta żelowa 1,5% DF Marker R2.
C – Biblioteka genomowa dla insertu o wielkości 1100 pz. Przesuniecie próbki C względem próbki B
jest wynikiem ligacji sekwencji adapterowych do insertu (+ 120 pz).
D – Obraz po nałożeniu trzech rożnych próbek. Kolor czerwony – próbka A, kolor niebieski – próbka B,
kolor zielony – próbka C.
Application note SS_1_201503
Przykład nr 3
Biblioteka całogenomowa przygotowana z DNA oczyszczanego ze bloczka parafinowego z
wykorzystaniem zestawu NebNext Ultra DNA Library Prep Kit for Illumina (New England of BioLabs). Po
izolacji DNA uzyskano znikome ilości materiału genetycznego (10 ng) o wysokim stopniu degradacji
próbki. Uzyskano bibliotekę DNA zanieczyszczoną dimerami i konkatamerami adapterów, niepożądane
sekwencje wyeliminowano z wykorzystaniem elektroforezy preparatywnej w Blue Pippin uzyskując
„czystą” bibliotekę gotową do sekwencjonowania.
A
B
A – Biblioteka całogenomowa, w obrazie elektroforezy kapilarnej widoczne dimery adapterów (strzałka
zielona) oraz konkatamery adapterów (strzałka niebieska).
B – Biblioteka po eliminacji niepożądanych sekwencji za pomocą urządzenia Blue Pippin, zakres cięcia
obejmował główny pik (22-320 pz). Nałożono 180 ng DNA. Kaseta 1,5% DF Marker R2.
Wielkość fragmentów analizowano z wykorzystaniem Bioanalyzer 2100 (Agilent), High Sensitivity
DNA Kit.
Application note SS_1_201503
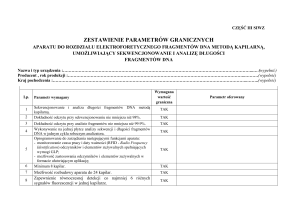
Badaczom, którzy nie zetknęli się dotychczas z urządzeniem BluePippin wyjaśniamy, że
jest to należący do grupy aparatów Pippin DNA system do elektroforetycznego
rozdziału i elucji fragmentów DNA zgodnie z zadanym przez użytkownika zakresem
długości fragmentów. Blue Pippin dedykowany jest do pracowni sekwencjonowania
następnej generacji (NGS), ponieważ usprawnia obowiązkowy dla większości szlaków
przygotowania bibliotek NGS etap selekcji fragmentów DNA składających się na
docelową bibliotekę.
Blue Pippin w porównaniu do tradycyjnego ręcznego przygotowania żeli agarozowych i
elucji DNA z wycinanych prążków, pozwala na uzyskiwanie w krótszym czasie wyższej
jakości próbek przeznaczonych do analiz NGS. Ekstrakcja przebiega poprzez
przełączenie ścieżki elektroforezy do kanału, który zbiera eluowaną frakcję do komory
wypełnionej buforem. Wyselekcjonowanie frakcje DNA pobierane są przy użyciu pipety
laboratoryjnej.
Application note SS_1_201503